Класс - 11 (базовый уровень)
advertisement

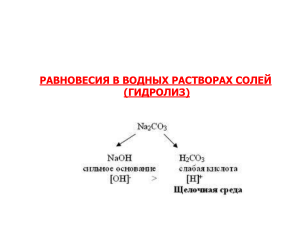
Самсонова Галина Николаевна учитель химии высшей категории МОУ-СОШ с.Александровка Советского района, Саратовской области 11 класс (базовый уровень) Тема урока: « Гидролиз неорганических веществ» Цели: образовательная: расширить представление учащихся о гидролизе, ознакомив с сущностью гидролиза солей; развивающая: развивать представление учащихся о многообразии веществ в природе, о зависимости свойств от состава и строения вещества; воспитательная: формирование научных взглядов на окружающую нас природу, интереса к знаниям, рефлексивных качеств личности. Задачи: образовательная: сформировать умения в составлении уравнений реакций гидролиза различных солей, определять среду их раствора; развивающая: способствовать развитию интеллектуальных умений, на основе логического мышления научить выделять главную причину, определяющую сходство и различие в свойствах солей; воспитательная: формирование культуры монологической речи, общения, самодисциплины, эстетических качеств. Методы и методические приемы: 1. Словесный – фронтальная беседа, разъяснение, инструктаж. 2. Наглядный - использование таблиц. 3. Практический – выполнение лабораторных опытов. 4. Самостоятельная работа – написание уравнений реакций. 5. Проблемный, частично - поисковый. Тип урока: урок формирования знаний Вид урока: урок – лекция с элементами беседы и лабораторным опытом Оборудование и реактивы для учителя: таблицы «Сильные кислоты», «Сильные основания», «Характеристика сред растворов». Оборудование и реактивы для учащихся: на каждом столе учащихся склянки с растворами карбоната натрия, хлорида алюминия, хлорида натрия, универсальная индикаторная бумага. Литература для учителя: О.С. Габриелян «Химия 11 класс», базовый уровень, Дрофа, 2007 год. О.С. Габриелян и др. Настольная книга учителя. 11 класс. В.Г. Денисова. Поурочные планы. 11 класс, изд. «Учитель»,2007 год. Литература для учащихся О.С. Габриелян « Химия 11 класс» базовый уровень, Дрофа, 2007 год. Пособия для подготовки к ЕГЭ. Типовые тестовые задания. (2008- 2011гг.) Этапы урока 1. Организационный момент (1 минута) II. Сообщение темы урока, постановки цели урока, мотивация учебной деятельности III. Актуализация знаний IV. Введение новых знаний Деятельность учителя 1. Проверка готовности учащихся к уроку 2. Приветствие 3. Выявление отсутствующих на уроке учащихся Сообщение темы урока 1. Организует беседу, направленную на актуализацию важнейших опорных знаний: 1) сильные и слабые электролиты ( примеры сильных и слабых кислот и оснований); 2) какая среда в водных раствора кислот, щелочей; 3) как экспериментально определить характер среды; 4) соли- сильные электролиты ( определение в свете ЭД, составление уравнение диссоциации) 1. Учитель спрашивает: «Какая среда в водных растворах солей?» 2.Учитель предлагает экспериментально проверить характер среды в растворах предложенных солей. Деятельность учащихся 1. Проверка готовности к уроку 2. Приветствие учителя Запись темы урока в тетради 1. Отвечают на вопросы. 2. Записывают уравнения реакции диссоциации 1.Учащиеся высказывают свои предположения. 2. Выполняют лабораторный опыт, заполняют таблицу: Характер среды в водных растворах солей Na2CO3 AlCl3 NaCl Делают вывод о том, что среда в растворах солей может быть разной. 3. Учитель указывает, что в лабораторном 3.Учащиеся знакомятся с таблицей. опыте исследовались разные по составу соли. Их делят на 4 группы, предлагает рассмотреть схему 6 на стр. 164. 4. Учитель объясняет поведение в растворах солей, различных по составу . А) гидролиз соли, образованной сильным основанием, слабой кислотой, на примере карбоната калия. Записываем алгоритм составления уравнения реакции обратимого гидролиза карбоната калия . 1.Составляем уравнение ЭД. 2.Выбрать ион слабого электролита. 3.Записать его взаимодействие с водой 4. Определить среду раствора Вывод: гидролиз солей, образованных сильным основанием и слабой кислотой, идет по аниону, процесс гидролиза обратим, реакция среды в растворах щелочная ( рН > 7) Б) гидролиз соли, образованной слабым основанием и сильной кислотой, на примере гидролиза хлорида алюминия. Уравнение гидролиза составляем по алгоритму 4.Учащиеся записывают уравнения гидролиза карбоната натрия в тетрадь Вывод: гидролиз солей, образованных слабым основанием, сильной кислотой, идет по катиону. Процесс обратим, реакция среды в раство- Учащиеся высказывают свое мнение, вместе с учителем делают правильный вывод. Учащиеся записывают вывод в тетрадь Учащиеся записывают уравнение гидролиза и вывод в тетрадь. V. Первичное закрепление и систематизация знаний. VI. Определение и разъяснение домашнего задания. рах кислая (рН < 7). В) учитель спрашивает учащихся о том, будут ли подвергаться гидролизу соли, образованные сильным основанием и сильной кислотой? Почему? 5. Учитель подводит итог проделанного исследования, вместе с учащимися составляет определение реакций гидролиза солей. 1. Выполнить по одному уравнению реакции гидролиза из упражнений 3,4 на стр.174 учебника. 2. Составить по одному уравнению реакции гидролиза солей по катиону и аниону. Самостоятельная работа по дидактическим карточкам. Учитель объясняет домашнее задание: 16 стр. 163-170 ( кроме стр. 168-169 «Соли образованные слабым основанием, слабой кислотой»), упражнение 3-4 (закончить) стр.174 Индивидуальные задания: по материалам ЕГЭ Учащиеся высказывают своё мнение, вместе с учителем делают вывод, записывают его. 5. Учащиеся записываю определение в тетрадь. Учащиеся выполняют уравнения, двое работают у доски. Учащиеся работают самостоятельно, проверяют свою работу по проверочным карточкам. Учащиеся записывают домашнее задание