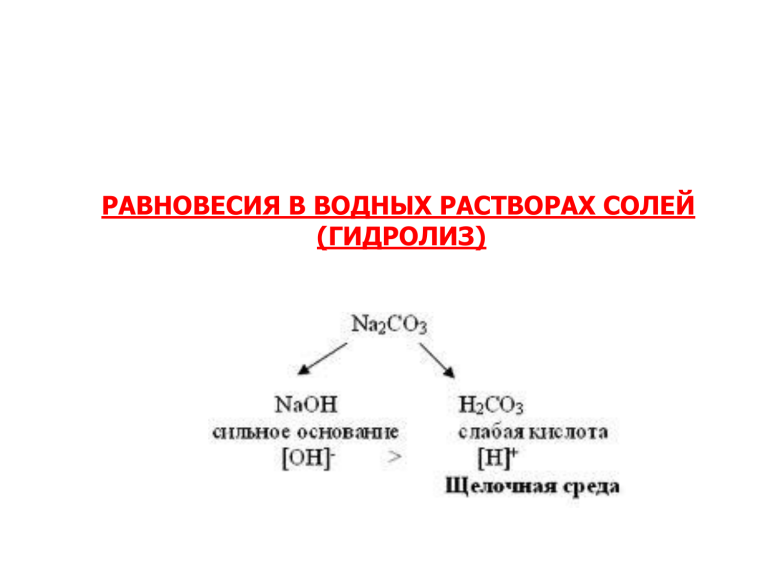
РАВНОВЕСИЯ В ВОДНЫХ РАСТВОРАХ СОЛЕЙ (ГИДРОЛИЗ) Гидролиз – взаимодействие ионов растворенной соли с ионами Н+ и ОН- воды. Гидролиз является реакцией обратной нейтрализации и частным случаем сольволиза. Гидролизу подвергаются гидриды, карбонаты, органические соединения. нитриды, реакции сульфиды, В зависимости от состава соли различают следующие механизмы протекания процесса гидролиза: 1. Соль, образованная сильной кислотой и сильным основанием, гидролизу не подвергается, т.к. при растворении в воде этих солей не может происходить связывание ни Н+, ни ОН-, возникающих в результате ионизации воды. Поскольку не происходит связывание ионов воды, не может изменяться и рН. Следовательно, рН растворов солей, образованных сильными кислотами и сильными основаниями, таков же как у чистой воды. Пример: хлорид натрия, сульфат калия, нитрат натрия. 2. Соль образованная сильной кислотой и слабым основанием – гидролиз по катиону В водных растворах таких солей происходит связывание ОН- воды и накапливание Н+ в растворе, например: NH4Cl H 2O NH4+ + ClOH- + H+ NH4+ +OH- NH4Cl + H2O NH4+ + H2O NH3∙H2O NH3∙H2O + HCl NH3∙H2O + H+ pH<7 Т.о. раствор NH4Cl будет вследствие гидролиза иметь кислую реакцию. Если катион слабого основания в соли гидролизе образуется основная соль, например: многовалентен, MgCl2 + H2O = MgOHCl + HCl Mg2+ + HOH = MgOH+ + H+ то при 3. Соль образованная сильным основанием и слабой кислотой – гидролиз по аниону В водных растворах таких солей происходит связывание Н+ воды и накапливание ОН- в растворе, например: KCN H 2O KCN + H2O CN- + H2O K+ + CNOH- + H+ CN- + H+ HCN KOH + HCN HCN + OH- pH>7 Т.о. раствор KCN будет вследствие гидролиза иметь основную реакцию. Гидролиз солей, образованных слабыми многоосновными кислотами и сильными основаниями, протекает обычно с образованием кислой соли: Na2CO3 + H2O = NaHCO3 + NaOH CO32- + HOH = HCO3- + OH- 4. Соль образованная слабым основанием и слабой кислотой – гидролиз по аниону и по катиону В этом случае происходит связывание ионов Н+ и ОНводы. Продуктом гидролиза будут слабое основание и слабая кислота. CH3COONН4 CH3COO- + NН4+ H2O OH- + H+ CH3COONН4 + H2O CH3COOН + NН3∙H2O Реакция раствора подобных солей зависит от относительной силы, образующихся кислоты и основания. Если константа диссоциации кислоты больше константы диссоциации основания, то среда кислая и наоборот, если величины К близки (как в данном случае) – среда нейтральная. К(NН4ОН) = 1,76∙10-5 К(CH3COOН ) = 1,75∙10-5 Количественная оценка способности соли подвергаться гидролизу 1. Константа гидролиза Константа гидролиза есть константа равновесия процесса гидролиза, и по своему физическому смыслу определяет степень необратимости гидролиза. Чем больше Кh, тем необратимее гидролиз. Кh имеет свое выражение для каждого случая гидролиза. А) Вычисление константы гидролиза соли, образованной сильным основанием и слабой кислотой CH3COONa + НОН ⇄ CH3COOН + NaОН CH3COO- + НОН ⇄ CH3COOН + ОН- K рав. (*) c(CH 3COOH ) c(OH ) c(CH 3COO ) c( H 2O ) Зная что, Kw Kh c( H ) c(OH ) Kh K CH 3COOH c(CH 3COOH ) c(OH ) c(CH 3COO ) , можем написать что c(OH ) и подставим это выражение в (*) Kw K рав. c( H 2O) Kh c(CH 3COOH ) K w c(CH 3COO ) c ( H ) 1/KCH3COOH или в общем виде Kh Kw K HA Kw c( H ) B) Вычисление константы гидролиза соли, образованной сильной кислотой и слабым основанием NH4Cl + НОН ↔ NH3∙H2O + НCl NH4+ + HОН ↔ NH3∙H2O + Н+ K рав. (*) c( NH 3 H 2O) c( H ) c( NH 4 ) c( H 2O) Зная что, Kw Kh c( H ) c(OH ) K рав. c( H 2O ) c( NH 3 H 2O ) c( H ) c( NH 4 ) , можем написать что c( H ) и подставим это выражение в (*) Kh Kh Kw K NH 3 c( NH 3 H 2O) K w c( NH 4 ) c(OH ) или в общем виде 1/KNH3 Kh Kw KB Kw c(OH ) C) Вычисление константы гидролиза соли, образованной слабой кислотой и слабым основанием CH3COONH4 + НОН ↔ NH3 ∙H2O + CH3COOН CH3COO- + NH4+ + HОН ↔ NH3 ∙H2O + CH3COOН K рав. Kh c( NH 3 H 2O ) c(CH 3COOH ) c( NH 4 ) c(CH 3COO ) c( H 2O) K рав. c( H 2O ) c( NH 3 H 2O ) c(CH 3COOH ) c( NH 4 ) c(CH 3COO ) Запишем константы диссоциации для кислоты и основания: K CH3COOH c(CH 3COO ) c( H ) c(CH 3COOH ) c(CH 3COOH ) c(CH 3COO ) c( H ) (1) K CH 3COOH K NH 3 c( NH 4 ) c(OH ) c( NH 3 H 2O ) c( NH 3 H 2O) c( NH 4 ) c(OH ) (2) K NH3 Подставим (1) и (2) в формулу для гидролиза Kh c( NH 4 ) c(CH 3COO ) c( H ) c(OH ) c( NH 4 ) c(CH 3COO ) K CH3COOH K NH3 Kh c( H ) c(OH ) K CH3COOH K NH3 Kw K A KB Kw K CH3COOH K NH3 2. Степень гидролиза Степень гидролиза – это отношение гидролизованных молекул соли к общему количеству их в растворе (h). h cгидролиз . собщ. Степень гидролиза зависит: от Кдис кислоты или основания, образующихся в результате гидролиза, чем меньше их Кдис тем больше степень гидролиза соли; от температуры возрастает степень диссоциации воды, т. е. увеличивается концентрация ионов Н+ и ОН-; с повышением температуры раствора степень гидролиза повышается. от концентрации гидролизуемой соли, у солей, образованных сильными основаниями и слабыми кислотами, сильными кислотами и слабыми основаниями, степень гидролиза зависит от концентрации: чем меньше концентрация, тем больше степень гидролиза. Вычисление степени гидролиза 1. Соль образованная сильным основанием и слабой кислотой Введём следующие обозначения: с (моль/л) – молярная концентрация соли в растворе; h – степень гидролиза; (сh) – концентрация гидролизированной части соли; (с- сh) - концентрация негидролизированной части соли; Принятые обозначения подставим в формулу для константы гидролиза: Kh c(CH 3COOH ) c(OH ) c(CH 3COO ) ch ch c ch c2 h2 c(1 h) c h2 1 h Kw K HA Т.к. h является малой величиной <<1, то знаменателем (1- h) можно пренебречь: h K HA Kw c(соль) Аналогичным образом можно вывести формулу для соли образованной сильной кислотой и слабым основанием h KВ Kw c(соль ) и для соли образованной слабой кислотой и слабым основанием h Kw K В K HA Kh 1. Вычисление рН солей, образованных сильной кислотой и слабым основанием Уравнение в общем виде BH+ + НОН = Н+ + B∙H2О Kh c( B H 2O) c( H ) c( BH ) При условии, что с(B∙H2O) = c(Н+), h ≤ 5%, c(BH+) = с(соли), формула для константы гидролиза примет вид Kh с( Н ) c2 (H ) c(соли ) К h с(соли ) K w с(соли ) KB Чтобы найти рН прологарифмируем полученное выражение lg с( Н ) pH 1 2 pK w K w с(соли ) lg KB 1 2 pK B 1 2 pH lgc(соль) Другой способ вычисления рН. Учитывая что, с(Н+) = с(соли)∙h, то рН = -lgc(соли) - lgh 2. Вычисление рН солей, образованных сильным основанием и слабой кислотой Уравнение в общем виде А- + НОН = АН + ОН- Kh c( HA) c(OH ) c( A ) При условии, что с(HA) = c(ОН-), h ≤ 5%, a c(A-) = с(соли), то формула для константы гидролиза примет вид Kh с(OН ) c 2 (OH ) c(соли ) К h с(соли ) K w с(соли ) K HA Чтобы найти рН прологарифмируем полученное выражение K w с(соли ) lg K HA lg с(OН ) pOH 1 2 pK w 1 2 pK HA pOH lgc(соль) 1 2 pH 14 pOH pH 1 2 pK w 1 2 pK HA 1 2 lgc(соль) Другой способ вычисления рН. Учитывая что, с(OН-) = с(соли)∙h, то рН = 14+lgc(соли) + lgh В случае солей образованных многокислотным основанием или многоосновной кислотой используют те же формулы для расчета рН, но константы кислотности или основности берут по последней ступени. Например: Na2CO3 pH (pK1= ) 1 2 pKw 1 2 (pK2= ) pKHA 1 2 lg c(соли ) 3. Вычисление рН солей, образованных слабым основанием и слабой кислотой CH3COONH4 pH 1 2 pK w 1 2 pK HA 1 2 4. Вычисление рН кислых солей NaHS, NaHCO3 pH pK 1 pK 2 2 pK B Процессы гидролиза используются в анализе для следующих целей: 1. Для обнаружения отдельных ионов, например висмута(III): BiCl3 2H 2O Bi (OH )2 Cl Bi (OH )2 Cl BiOCl 2HCl H 2O Амфотернные соединения. Расчёт рН амфолитов Соединения, которые в зависимости от условий способны вести себя в растворах и как кислота и как основание называются амфолитами или амфотерными, а само явление амфотерностью. Например: вода, этанол, гидроксиды некоторых металлов (гидроксид алюминия, гидроксид цинка), анионы кислых солей (HSO4-, HCO3- и др.) +H2O +H2O B H 3O BH Кислотные свойства Амфолит BH 2 OH Основные свойства Пример: NaHCO3 является амфотерным соединением: 2 3 CO H 3O +H2O +H2O HCO3 Кислотные свойства H 2CO3 Амфолит OH Основные свойства Гидроксид алюминия так же проявляет амфотерные свойс +H2O +H2O [Al(OH)4 (H 2O) 2 ] H 3O Кислотные свойства [Al(OH) 3 (H 2O) 3 ] Амфолит [Al(OH) 2 (H 2O) 4 ] OH Основные свойства B H 3O Кислотные свойства +H2O +H2O BH Амфолит BH 2 OH Основные свойства При определенном рН, характерном каждому амфолиту, эти два процесса ионизации уравниваются, т.е. концентрация положительных ионов становится равной концентрации отрицательных ионов. Это амфолита. значение рН называется изоэлектрической точкой Т.о. при большем рН амфолит содержит больше анионов (ОН-), а при рН меньше изоэлектрической точки в растворе преобладают положительно заряженные ионы (Н+). Например: As(OH)3 pHizo = 4,6; Zn(OH)2 pHizo = 7,5; Al(OH)3 pHizo = 4,2; Для полного осаждения амфотерных гидроксидов рН должен быть равен рНизо, т.к. в этом случае процессы ионизации по обоим типам минимальны. На практике создают рН = рНизо ± 1 для полнейшего осаждения амфолита. Т.о. Zn(OH)2 полностью осаждается при pHizo ≈ 8,7, а Al(OH)3 pHizo ≈ 5,0. Для растворения гидроксидов и перевода их в раствор в виде катиона, необходимо создать кислую среду со значением рН < рНизо. для химического анализа важно уметь рассчитывать рН в изоэлектрической точке pH 1 2 pK w 1 2 pK HA 1 2 pK B Применение амфотерных соединений в химическом анализе: 1. Для разделения ионов при проведении систематического анализа: Al3+, Zn2+ +NaOH Раствор гидроксокомплексов Fe3+, Mn2+ 2. Осадок гидроксидов Разделение сульфатов бария и свинца: PbSO4 +NaOH BaSO4 +NaOH раствор Na2[Pb(OH)4] не растворяется 3. Обнаружение некоторых ионов а) Al3+ + 3OH- +3OH- Al(OH)3 [Al(OH)6]3+ 3NH4+ б) Обнаружение Sn(II) с помощью Bi3+ 4. При обнаружении и определении органических амфолитов, которые имеют значение в фармацевтической практике. Например, аминокислоты.









