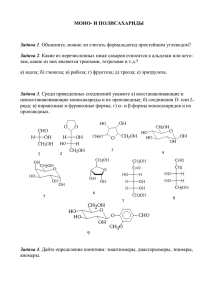
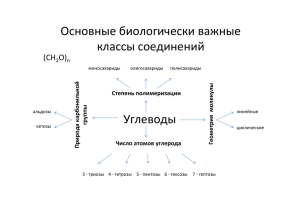
181 Глава 23 УГЛЕВОДЫ Углеводы (сахара) – полигидроксикарбонильные соединения и их производные. Многие из них имеют брутто-формулу Сn(Н2О)n. Первые известные сахара – глюкоза и фруктоза имели именно такой состав, что позволило немецкому химику К. Шмидту в 1844 г. дать другое название сахарам – углеводы. Позже было показано, что многие сахара не отвечают формуле Сn(H2O)n, однако название «углеводы» прочно укоренилось в химической литературе. Среди многочисленных веществ, составляющих окружающий нас мир, углеводы и их производные играют исключительно важную роль в промышленности и повседневной жизни человека, обеспечивая его пищей, одеждой и различными изделиями из древесины. Углеводы в виде различных производных входят в состав клеток любого живого организма, играя роль конструкционного материала, поставщика энергии, обеспечивающих его жизнедеятельность, субстратов и регуляторов биохимических процессов. Взаимодействуя с нуклеиновыми кислотами, липидами и белками углеводы образуют те сложные высокомолекулярные комплексы, которые лежат в основе субклеточных структур – основ живой материи. Углеводы являются начальными продуктами фотосинтеза, т.е. первыми органическими веществами в круговороте углерода в природе, и служат соединительным звеном между минеральными и органическими веществами. Огромное практическое значение углеводов привлекло к ним внимание человека с незапамятных времен. Обработка древесины, изготовление бумаги и хлопчатобумажных тканей, хлебопечение и брожение – все эти процессы, известные с глубокой древности, непосредственно связаны с переработкой углеводсодержащего сырья. Тростниковый сахар был, по-видимому, первым органическим веществом, полученным человеком в химически чистом виде. Вслед за тростниковым сахаром в 1792 г. была выделена фруктоза, а в 1802 г. Т. Ловиц1 получил кристаллическую глюкозу. В 1811 г. К. Кирхгоф2 при обработке крахмала соляной кислотой провел первый химический гидролиз полисахарида, а три года спустя он же осуществил первое ферментативное расщепление крахмала под воздействием энзимов слюны. Наконец, в 1861 г. А. Бутлеров действием известковой воды на водный раствор формальдегида получил смесь сахаров, названных им метиленитаном. Таким образом, был проведен первый исторический синтез сахаров. Углеводы делят на три большие группы: моносахариды - простейшие полигидроксикарбонильные соединения, обычно не подвергающиеся гидролизу; полисахариды - природные полимеры, состоящие из моносахаридных остатков, способные гидролизоваться; олигосахариды - промежуточный класс углеводов, содержащих от 2 до 10 моносахаридных остатков. 23.1. КЛАССИФИКАЦИЯ, СТРОЕНИЕ И НОМЕНКЛАТУРА МОНОСАХАРИДОВ 23.1.1. Классификация моносахаридов 1 2 Моносахариды делятся на: альдозы – в состав которых входит альдегидная группа и кетозы – в их состав входит кетогруппа. По числу углеродных атомов в цепи моносахариды подразделяются на: триозы – 3 атома углерода, тетрозы – 4 атома углерода, пентозы – 5 атомов углерода, гексозы – 6 атомов углерода, высшие сахара – больше 6 атомов углерода. По функциональным группам, в частности, выделяют: Ловиц Т. (1757-1804) – русский химик. Основные исследования в области адсорбции и кристаллохимии. Кирхгоф К. (1764-1833) – русский химик. Основные исследования в области катализа. 182 нейтральные сахара – в состав входят только гидроксильные и карбонильные функции, кислые сахара – присутствует карбоксильная или иная кислотная функция, аминосахара – присутствует аминогруппа, дезоксисахара – вместо гидроксильной группы находится атом водорода. 23.1.2. Структура моносахаридов Центральное место в химии моносахаридов занимают альдопентозы (III), кетогексозы (II) и альдогексозы (I): 1 CH2 OH 1 CHO 2C 2 CHOH 2 O 3 CHOH 4 CHOH 5 CHOH 6 CH OH 2 III II I 1 CHO 2 CHOH 3 CHOH 4 CHOH 5 CH OH 3 CHOH 4 CHOH 5 CHOH 6 CH OH 2 Так как разнообразие моносахаридов связано, прежде всего, со стереохимическими различиями, а структуры обычных и наиболее известных и распространенных моносахаридов различаются числом углеродных атомов и относительным положением функциональных групп, методы установления химического строения различных моносахаридов достаточно близки. Они будут рассмотрены на двух наиболее распространенных представителях моносахаридов – глюкозе и фруктозе. Эти работы были проведены в конце XIX века Б. Толленсом, Э. Фишером и Г. Килиани. К началу этих исследований было известно, что глюкоза имеет состав С6Н12О6. При ацетилировании уксусным ангидридом она образует пентацетат, что указывает на то, что в моносахариде имеется пять гидроксильных групп. Исходный моносахарид восстанавливает аммиачный раствор оксида серебра и фелингову жидкость. Он легко окисляется бромом. Эти реакции ведут к образованию глюконовой кислоты (IV) с тем же числом гидроксильных групп, что и в исходной глюкозе. Присутствие альдегидной группы в моносахариде также подтверждается восстановлением глюкозы до шестиатомного спирта сорбита (V). Наличие в глюкозе неразветвленной цепи из шести атомов углерода подтверждается восстановлением моносахарида иодистоводородной кислотой до 2-иодгексана (VI) и глюконовой кислоты до гексановой (VII). Этот же вывод можно сделать на основании синтеза циангидрина (VIII) из глюкозы и его восстановления после омыления (IX) до гептановой кислоты (Х). Все изложенное можно проиллюстрировать приведенной ниже схемой: CH 2O Ac CHOAc C HOAc C HO Ac C HO Ac C H2 OAc C H 2O H C HOH Ac2 O C HO H C HO H C HO H CH 2 OH CH O CHOH Na/Hg CHOH C HOH C HO H C H2 OH V VI CH 3 (CH 2) 4 COOH VII IV HI C H3 C HI C H2 C H2 CH 2 CH 3 Br2 COOH CHOH CHOH HI C HOH C HOH C H2 O H HCN C N C HO H C HO H C HO H CHO H CHOH C H 2O H VIII COOH CHOH CHOH HI CHOH C HOH C HO H C H2 OH CH 3(CH 2 ) 5COOH X IX Строение кетогексозы фруктозы было предложено на основании следующих реакций. Аналогично глюкозе фруктоза образует пентаацетат, а ее восстановление приводит к смеси двух шестиатомных спиртов, один из которых сорбит (V), что указывает на структурное сходство моносахари- 183 дов. В отличие от глюкозы фруктоза не окисляется бромом, а жесткое воздействие, например, азотной кислотой приводит к расщеплению углеродной цепи и образованию гликолевой и винной кислот. Следовательно, в фруктозе в отличие от глюкозы существует кетогруппа. Ее локализация вытекает из следующей серии реакций. При действии на фруктозу (II) образуется циангидрин (XI), омыление которого дает гидроксикислоту (XII). При ее восстановлении была получена 2-метилкапроновая кислота (XIII), откуда следует, что кетогруппа находится у второго углеродного атома фруктозы. C H 2O H C H2 O H C H2 O H OH OH C CN C CO O H C O C H3 C HO H HI C HO H HC N C HO H C H C H C H C H C HC O O H 3 2 2 2 C HO H C HO H C HO H X III C HO H C HO H C HO H C H2 O H C H2 O H C H2 O H II X II XI 23.1.3. Конфигурация моносахаридов Из приведенных ранее структурных формул моносахаридов видно, что они содержат большое число асимметрических атомов углерода. Количество стереоизомеров для альдогексоз при четырех асимметрических атомах равно 24 = 16, а для альдопентоз и кетогексоз (три асимметрических атома) оно уменьшится до восьми. Для обозначения конфигурации стереоизомерных моносахаридов редко используют R,Sсистему. Вместо этого традиционно применяют гораздо раньше введенную D,L-номенклатуру. Родоначальником генетического ряда D-альдоз является правовращающий D-глицериновый альдегид. CHO H OH CH2OH (R)- или D-глицериновый альдегид От этой триозы можно перейти синтетически к тетрозам. В основе синтеза Килиани (подробней см. раздел «Химические свойства») лежит присоединение синильной кислоты по альдегидной группе. При этом наряду с увеличением углеродной цепи на один атом углерода возникает новый асимметрический центр и, следовательно, образуется пара диастереомеров. Специфическое восстановление амальгамой натрия нитрилов до альдегидов завершает синтез. [H] HCN * * RCHCH=O RCH=O RCHCN OH OH Этот метод позволяет из одного моносахарида получить два моносахарида с большей на один углеродный атом цепью и отличающихся конфигурацией верхнего тетраэдра. Такие диастереомерные пары называют эпимерами. Пару эпимеров разделяют обычно кристаллизацией их производных, например фенилгидразонов. Переход от D-триозы, к D-тетрозам и т.д. образует ряд D-альдоз. У всех этих моносахаридов одинаковая конфигурация нижнего асимметрического центра, а различие во взаимной конфигурации обозначается тривиальными основами, например: HO OH трео- OH OH OH рибо- HO HO OH OH OH манно- HO HO OH галакто- Таким образом, название альдозы состоит из обозначения конфигурации нижнего тетраэдра, тривиальной основы, обозначающей конфигурацию всех асимметрических центров, и суффикса -оза. 184 Ряд D-альдоз H C HO OH C H 2O H D-глицериновый альдегид CHO OH OH CH 2 OH H H D-эритроза H H H C HO OH OH OH C H 2O H H H H H D-треоза HO H H D-рибоза CHO H OH C H 2O H HO H CHO H OH OH CH 2O H H HO H CHO OH H OH CH 2O H D-ксилоза D-арабиноза HO HO H CHO H H OH CH 2O H D-ликсоза C HO C HO CHO CHO C HO C HO C HO CHO O H HO H H OH H O H H O H HO H H O H HO H OH H O H HO H HO H H OH H O H HO H HO H OH H OH H OH H OH H O H HO H HO H HO H OH H OH H OH H OH H OH H OH H OH H OH C H2 O H CH 2O H CH 2 OH C H2 OH C H2 OH C H2 OH C H 2O H CH 2 OH D-аллоза D-альтроза D-глюкоза D-манноза D-гулоза D-идоза D-галактоза D-талоза Аналогично, исходя из L-глицеринового альдегида, строится и L-ряд альдоз. Используя в качестве исходного соединения дигидроксиацетон, можно составить ряд D-кетоз. CH2OH CO CH2OH CH2OH CO H OH CH2OH дигидроксиацетон D-эритрулоза CH2OH CO H OH H OH CH2OH D-рибулоза CH2OH CO H OH H OH H OH CH2OH D-псикоза L-эритрулоза CH2OH CO HO H H OH CH2OH D-ксилулоза CH2OH CH2OH CO CO H OH HO H H OH HO H H OH H OH CH2OH CH2OH D-фруктоза CH2OH CO HO H CH2OH D-сорбоза CH2OH CO HO H HO H H OH CH2OH D-тагатоза 23.1.4. Установление конфигурация D-глюкозы и D-маннозы К 60-м годам XIX века было выделено достаточное количество моносахаридов и встал вопрос об определении их конфигурации. Эти исследования были выполнены Э. Фишером на основе доказательства конфигурации D-глюкозы и D-фруктозы. С этой целью путем окисления или восстановле- 185 ния он «уравнивал концы» моносахаридов, превращая последние в двухосновные карбоновые кислоты или полиолы. В результате для отдельных молекул появлялась плоскость симметрии, что вело к потере молекулой оптической активности. При таком приеме не затрагивались асимметрические атомы молекул. Это давало возможность исключить отдельные конфигурации для моносахаридов. Проследим эти приемы на примере установления стереохимических формул D-глюкозы и Dманнозы. При окислении арабинозы азотной кислотой была получена оптически активная арабинаровая кислота (XIV). Для нее, а следовательно, и для арабинозы, возможны конфигурации арабино- (XV) или ликсо- (ХVI) и исключаются ксило- (XVII) и рибо- (XVIII), как оптически недеятельные за счет наличия плоскости симметрии: COOH COOH COOH OH HO OH HO HO OH OH HO OH HO OH OH OH OH OH COOH COOH COOH XIV XV ХVI XVII XVIII С помощью циангидринового синтеза из арабинозы были получены глюконовая и манноновая кислоты. Следовательно, конфигурации атомов С4, С3 и С2 в арабинозе совпадают с конфигурацией атомов С5, С4 и С3 в маннозе и глюкозе. По этой причине глюкозе и маннозе не могут соответствовать алло-, альтро-, гуло-, идо-конфигурации, которые образуются из ксилозы и рибозы. При окислении D-глюкозы и D-маннозы получаются оптически активные глюкаровая (XIX) и маннаровая (XX) кислоты: COOH COOH COOH OH HO OH OH HO HO HO HO HO HO OH OH HO HO HO OH OH OH OH OH COOH COOH COOH XIX XX XXI XXII XXIII При окислении галактозы образуется оптически недеятельная галактаровая кислота (XXI). По этой причине для D-глюкозы и D-маннозы исключается галакто-конфигурация (XXII). Как следует из генетического ряда, приведенного ранее, галактоза и талоза различаются стереохимией атома С2. Следовательно, тало-конфигурация (XXIII), также не может соответствовать D-глюкозе и D-маннозе. Для них остаются только две возможные конфигурации: CHO CHO OH HO HO HO OH OH OH OH CH2OH CH2OH Выбор между ними был сделан с помощью циангидринового синтеза на основе глюкозы и маннозы и последующего окисления до гептаровых кислот. Получение из глюкозы оптически недеятельной дикарбоновой кислоты (ХХVI) позволяет для D-глюкозы приписать строение XXIV, а для маннозы – XXV: COOH COOH COOH COOH OH OH HO HO CHO OH OH OH OH OH [O] [O] HO HO HO HO HO OH OH OH OH OH OH OH OH OH OH COOH CH2OH CH2OH COOH CH2OH XXVI D-глюкоза (XXIV) 186 COOH OH HO HO COOH OH [O] OH OH COOH HO HO COOH CHO HO HO OH OH CH2OH OH OH CH2OH HO HO HO COOH HO [O] HO HO OH OH CH2OH OH OH COOH D-манноза (XXV) Учитывая тот факт, что фруктоза дает один и тот же озазон с D-глюкозой и D-маннозой, Э.Фишер предложил для нее следующую структуру: CH2OH CO HO OH OH CH2OH Вскоре аналогичным образом были установлены относительные конфигурации остальных пентоз и гексоз. 23.1.5. Циклические формы моносахаридов Фишеровские проекции с альдегидными и кетонными группами, т.н. цепные или линейные структуры, хорошо применимы для описания конфигурации моносахаридов. Однако отдельные свойства этих соединений не могут быть объяснены с помощью фишеровских формул. Прежде всего, карбонильная группа не дает некоторых альдегидных реакций, например, с фуксинсернистой кислотой, не образует бисульфитное производное. Полные ацетаты сахаров вообще не проявляют никаких альдегидных свойств. Кроме того, один из гидроксилов в моносахаридах обнаруживает особые свойства. Он легко при нагревании с 3 % раствором хлороводорода в метаноле образует изомерную смесь монометоксильных производных. Обычно в таких мягких условиях спирты простых эфиров не образуют, а в ацеталь входят две метоксильные группы. Кроме того, свежеприготовленные растворы моносахаридов мутаротируют – изменяют значение величины оптического вращения. Так, перекристаллизованный из воды образец D-глюкозы при растворении в воде имеет первоначальное удельное вращение []D +111, а водный раствор глюкозы, кристаллизованной из пиридина, - []D +19,2. При стоянии растворов удельное вращение меняется и в обоих случаях достигает []D +52,5. На основании цепных формул моносахаридов эти феномены объяснить невозможно. Для объяснения обнаруженных фактов А. Колли еще в 1870 г. предложил для моносахаридов циклическую структуру с трехчленным окисным кольцом: HOCH2 CHOH CHOH CHOH CH CHOH O . После появления теории напряжения А. Байера Б. Толленс предложил пятичленный окисный цикл: * HOCH2 CH CHOH CHOH CHOH O . Полуацетальная циклическая форма хорошо объясняет особенности свойств и поведения моносахаридов. Примечательно, что в этом случае появляется новый асимметрический атом, (в формуле Толленса он отмечен звездочкой) гидроксильная группа при котором может находиться над и под плоскостью кольца. Такую диастереомерную пару называют - и -аномерами. Возникший полуацетальный гидроксил, в свою очередь, получил название аномерного или гликозидного. Экспериментальное установление размеров цикла. Высказанное Б. Толленсом предположение о наличии в моносахаридах пятичленного окисного кольца требовало экспериментального подтверждения. Для решения этого вопроса У. Хеуорс1 взял для исследования метилгликозиды моноса- 1 Хеуорс У. (1883-1950) – английский химик-органик. Основные исследования посвящены углеводам, в том числе, витамину С. Нобелевская премия 1937 г. 187 харидов, в которых гликозидный гидроксил блокирован, что исключает наличие равновесия между кольчатой и цепной формами. При метилировании -метилглюкозида (XXVIII) был получен метил-тетра-О-метилглюкозид (XXIX), кислотный гидролиз которого привел к тетра-О-метилглюкозе (XXX). При ее окислении азотной кислотой вопреки ожиданиям была получена триметоксиглутаровая (XXXI), а не диметоксиянтарная кислота. Таким образом, цикл является не пяти-, а шестичленным: OMe OH HO O OMe OMe (MeO)2SO2 MeO NaOH O OH OMe CH2OH CH2OMe Me = CH3 XXVIII H2O H+ CHO OMe [O] MeO COOH OMe MeO OMe OH CH2OMe OMe COOH XXX XXXI XXIX Другое подтверждение циклической структуры гликозидов было получено Хадсоном и Джексоном по результатам периодатного окисления. При действии на -метилглюкозид иодной кислоты, которая, как известно, расщепляет только -гликольные группировки, поглощается 2 моль окислителя и образуется 1 моль муравьиной кислоты. Нетрудно убедиться в том, что такие результаты могут быть получены только в случае шестичленного цикла: OСH3 OH O OH HO HIO4 OСH3 CHO O HCOOH + CHO CH2OH CH2OH Ниже приведены данные по ожидаемому составу продуктов окисления и расходу окислителя для всех циклических структур, возможных для -метилглюкозида: ОСН3 O O ОСН3 OH HO OH OH CH2OH 1 моль СН2О 2 моля НСООН 3 моля HIO4 OH OH CH2OH 1 моль СН2О 1 моль HCOOH 2 моля HIO4 HO ОСН3 OH O HO OH CH2OH 1 моль СН2О HCOOH не образуется 2 моля HIO4 ОСН3 OH O OH CH2OH СН2О не образуется 1 моль HCOOH 2 моля HIO4 ОСН3 OH O HO OH OH CH2 СН2О не образуется 2 моля HCOOH 3 моля HIO4 Наличие шестичленного цикла было доказано на примерах других моносахаридов. В последствии У. Хеуорс обнаружил и моносахариды с пятичленными циклами. Моносахариды в пятичленной циклической форме называются фуранозами, а в шестичленной – пиранозами. Аномеры. Как уже упоминалось, каждый моносахарид может существовать в двух диастереомерных формах, что связано с наличием дополнительного асимметрического атома углерода, появляющегося в результате замыкания пиранозного или фуранозного цикла. Такие стереоизомерные моносахариды получили название аномеров. Аномер обозначается как -, если в проекции Фишера конфигурация его аномерного гидроксила совпадает с конфигурацией нижнего асимметрического центра, а при несовпадении - : 1 CHO 2 OH 3 HO 4 OH OH 6 CH2OH 5 1 1 HO 2 3 HO 4 5 6 OH O OH CH2OH -D-глюкопираноза CHO OH 2 3 HO 4 5 OH OH 6 CH2OH 1 2 3 HO 4 5 OH OH O OH CH2OH 6 -D-глюкофураноза 188 Конфигурация при С1 в аномерных альдозах была выяснена экспериментальным путем Я.Безекеном. Он установил, что электропроводность водных растворов борной кислоты резко возрастает при добавлении -цис-гликолей: _ OH HO C C OH HO + B + HO C C OH HO O C C O B C O O C H+ Этот факт послужил основой для экспериментального определения конфигурации аномеров. Прибавление свежеприготовленного раствора -D-глюкозы резко увеличивает электропроводность водного раствора борной кислоты, после чего электропроводность постепенно падает, пока не достигнет некоторого постоянного значения. Прибавление раствора -D-глюкозы вызывает постепенное увеличение электропроводности, пока не достигнет такого же постоянного значения, что и в случае -D-глюкозы: -D-глюкоза -D-глюкоза 2 4 6 t, час 8 10 Рис. 23.1. Изменение электропроводимости борной кислоты в присутствии - и -D-глюкозы Из этих результатов вытекает, что -D-глюкопираноза должна иметь цис-, а -Dглюкопираноза – транс-конфигурацию при С2 и С1- атомах: Проекция Хеуорса. По сравнению с проекционными формулами Фишера лучшее представление о конфигурации циклических форм моносахаридов можно получить с помощью перспективных формул Хеуорса. O O Цикл в этой проекции располагается перпендикулярно плоскости бумаги, так чтобы атом кислорода был удален от наблюдателя, а связи НСОН направлены параллельно плоскости бумаги. Часто с целью упрощения структуры связи СН не изображают. Образование проекций Хеуорса можно представить как сближение реагирующих с карбонильным атомом углерода гидроксильных групп, находящихся у - и -углеродных атомов. При этом для замыкания цикла необходим поворот на 120 по связям С3-С4 и С4-С5 соответственно. 1 CHO 2 H 3 OH HO 4 H H 5 OH H OH CH2OH 6 CH(OH)CH2OH 4 OH HO 6 1 CHO 2 H 3 OH HO 4 H H 5 OH H 5 OH 6 CH2OH 3 CHO 2 1 CH2OH HO 5 H OH CHO 4 OH 1 3 HO 6 CH2OH OH CHO OH 2 1 3 4 OH 4 HO 3 CHO 2 1 2 OH OH 6 CH2OH 5 OH OH OH 3 OH 6 4 CH2OH HO 5 H O 2 OH 5 6 1 OH CH2OH 5 O OH 4 1 OH 2 HO 3 OH Для гексопираноз упрощенно переход от проекций Фишера к проекции Хеуорса можно осуществить следующим образом. Гидроксиметиленовая группа моносахаридов D-ряда располагается над 189 плоскостью рисунка, а у сахаров L-ряда – под плоскостью. Гидроксильные группы, которые в проекции Фишера располагались слева, направляют вниз, а расположенные слева – вверх, например: CH2OH HO O OH OH O OH HO OH HO OH CH2OH -D-глюкопираноза Кетогексозы, точно так же, как и альдогексозы, в большинстве случаев существуют в шестичленной (пиранозной) форме, причем замыкание цикла протекает с участием кетогруппы и гидроксильной группы при атоме углерода С6: O CH2OH HO OH HO OH -D-фруктопираноза O OH HO CH2OH HO OH -D-фруктопираноза В случае альдопентоз кольчато-цепная таутомерия ведет к замыканию кольца с участием альдегидной группы и гидроксила при атоме углерода С5, что приводит к образованию пираноз. В отличие от альдогексоз, альдопентозы чаще существуют в фуранозной форме. Особенно это касается полисахаридов. HO CH O 2 O OH OH OH HO OH OH OH -D-ксилопираноза -D-рибофураноза Мутаротация. Причиной мутаротации моносахаридов является кольчато-цепная таутомерия, которая реализуется в растворах сахаров. Со временем устанавливается равновесие между линейной и циклическими пиранозными и фуранозными формами моносахаридов. И хотя содержание линейной формы невелико (обычно около 0,1%), однако за счет смещения равновесия моносахариды дают качественные реакции на карбонильную группу. CH2OH CH2OH H O O O CHO OH OH OH OH HO OH HO OH OH OH -D-глюкопираноза -D-глюкофураноза OH CH2OH CH2OH D-глюкоза CH2OH O OH HO O OH OH OH HO OH OH -D-глюкопираноза -D-глюкофураноза 23.1.6. Конформации моносахаридов Большинство моносахаридов находятся в форме пиранозных циклов, для которых наиболее стабильными являются конформации «кресло» (обозначаются С от английского слова chair – кресло). В связи с наличием атома кислорода, вносящего асимметрию в конформацию «кресло», для моносахаридов существуют две формы, называемые 1С4 и 4С1 (верхний индекс показывает какой атом находится выше плоскости, а нижний индекс – соответственно, ниже плоскости). 190 HO OH OH O OH 1 4 HO O HO HO 4 1 OH OH 1 OH 4 C1 C4 -D-глюкопираноза Выбор между двумя конформациями зависит от пространственного расположения заместителей: конформация с наименьшим числом аксильных заместителей является наиболее устойчивой. При этом, чем больше объем заместителя в аксильном положении, тем менее устойчива конформация. Особенно это касается гидроксиметильной группы – CH2OH в гексопиранозах, пространственное расположение которой является решающим фактором устойчивости конформации. Как и в молекуле циклогексана, особенно сильное отрицательное влияние на устойчивость конформаций моносахаридов оказывает 1,3-диаксильное расположение заместителей. Например, у рибопиранозы 1,3-диаксиальное взаимодействие реализуется в обеих конформациях: 1 O 4 OH 4 HO HO OH 1 O HO 4 C4 C1 1 OH OH OH Кроме того, на устойчивость конформации моносахаридов влияет «2-эффект», связанный с наличием в цикле атома кислорода. Если гидроксильная группа у С2 расположена аксиально, а заместитель у С1 – экваториальный, то кислородные атомы гидроксилов и кислород цикла оказываются пространственно сближенными, что ведет к сильному отталкиванию и, тем самым, к неустойчивости конформации. Это легко продемонстрировать на примере -D-маннопиранозы с помощью проекций Ньюмена: OH OH 2 HO OH O O HO 1 1 OH 4 C HO 2 1 Из-за наличия атома кислорода в цикле моносахаридов возникает еще один фактор неустойчивости – «аномерный эффект». Например, в равновесной смеси - и -метил-D-глюкопиранозидов неожиданно преобладает -аномер, находящийся в аксильном положении. Это явление объясняется взаимодействием диполя С1-Х и суммарного диполя свободных электронных пар кислорода цикла. Отталкивание между этими диполями сильнее для экваториального аномера, когда диполи параллельны, и слабее для аксиального аномера. O X Существуют количественные критерии расчета неустойчивости конформаций, которые удовлетворительно согласуются с экспериментальными данными. По-видимому, отсутствие факторов неустойчивости для -D-глюкозы определяет ее широкое распространение в природе. 23.2. ХИМИЧЕСКИЕ СВОЙСТВА МОНОСАХАРИДОВ 23.2.1. Реакции восстановления Подобно всем карбонильным соединениям моносахариды способны к восстановлению в полиолы. 191 CH2OH OH CHO OH [H] HO HO OH OH CH2OH OH OH CH2OH D-глюкоза D-сорбит При восстановлении альдоз образуется только один полиол, а восстановление кетоз дает два стереоизомерных спирта. Так, из D-фруктозы получают D-сорбит и D-маннит: СH2OH CH2OH CH2OH C O OH HO HO HO [H] HO OH OH + OH OH OH OH CH2OH CH2OH CH2OH D-фруктоза D-сорбит D-маннит Восстановление моносахаридов в лаборатории чаще всего проводят при помощи боргидрида натрия NaBH4 или амальгамой натрия. Гидрирование в промышленности осуществляют над платиновыми, палладиевыми, скелетными никелевыми катализаторами при комнатной температуре и атмосферном давлении. 23.2.2. Реакции окисления Окисление альдегидной группы. Легче всего окислению в моносахаридах подвергается альдегидная группа с образованием альдоновых кислот. Наилучшим окислителем для препаративных целей является бром. В промышленности с целью получения глюконата кальция проводят электролитическое окисление глюкозы бромом в присутствии карбоната кальция. Бром, выделяющийся из бромида кальция на аноде, окисляет глюкозу до альдоновой кислоты, которая при взаимодействии с карбонатом кальция дает глюконат. Образующиеся в результате окисления альдоновые кислоты легко превращаются в лактоны, в равновесной смеси которых преобладает -форма: COOH CH2OH CH2OH OH O O HO H O OH O O OH OH HO OH OH OH CH2OH лактон D-глюконовая кислота лактон Окисление первичной спиртовой группы. При каталитическом окислении легче всего окисляются первичные спиртовые группы с образованием уроновых кислот. Для проведения этой реакции моносахарид превращают в гликозид или какое-нибудь другое производное с целью защиты аномерного центра: COOH CH2OH O O O2/Pt OH OH OCH3 HO OCH3 HO OH OH -метил-D-глюкопиранозид -метил-D-глюкопиранозидуроновая кислота Избирательное окисление -гликольных группировок. Для этой реакции используются иодная кислота и тетраацетат свинца. Такие реакции широко используются в химии углеводов при установлении строения моно-, олиго- и полисахаридов. Реакция применима для расщепления -гликолей и ведет к образованию двух альдегидов: R CHOH CHOH R' + HIO4 RCHO + H2O + R'CHO + HIO3 Соединения, содержащие триольную группировку, распадаются по следующей схеме: CH2OH CHOH CH2OH + HIO4 CH2OH CHO + CH2O + H2O + HIO3 HIO4 H2СO + HCOOH + HIO3 192 Таким образом, на окисление -гликольной группировки расходуется 1 моль иодной кислоты, из первичной спиртовой группы образуется формальдегид, а из среднего звена 1,2,3-триольной группировки выделяется муравьиная кислота. Реакция протекает количественно и на ее основе разработан ряд аналитических методов. Одновременное окисление альдегидной и первичной гидроксильной групп. При окислении моносахаридов азотной кислотой образуются дикарбоновые гидроксикислоты - альдаровые кислоты: CHO COOH OH OH HO HNO3 HO OH OH OH OH CH2OH COOH D-глюкоза D-глюкаровая кислота (сахарная кислота) 23.2.3. Действие на моносахариды кислот и оснований. При действии кислот и оснований моносахариды претерпевают многочисленные превращения. Первой стадией этого процесса является образование енола: O. . . CH H O OH R CHOH CHO CHO H+ C OH H OH H OH H OH H OH OH R R R Из образовавшегося енола могут получиться три вещества: исходная альдоза, ее эпимер по С2атому и кетоза. Эта реакция известна под именем Лобри де Брюина и Альберта ван Экенштейна (1895 г.). CHO OH CH2OH CHOH OH CO C OH R OH OH CHO R R HO HO OH R Отщепление молекулы воды в кислой или щелочной среде ведет к образованию 3-дезокси-2кетоальдозы: CH O H -H2O C OH H + CHO CHO +H2O CHOH C OH C O R CH CH2 -H2O CH O H OH R R +H2O C OH CH OH R В кислой среде 3-дезокси-2-кетоальдозы превращаются в производное фурана – 5-гидроксиметилфурфурол: 4 3 HOH2C 5 O 2 1 CHO . Последний при дальнейшем воздействии соляной кислоты распадается до левулиновой кислоты СН3СОСН2СН2СООН. Превращение сахаров в производные фурана имеет большое практическое значение. В про- 193 мышленности для получения фурфурола подвергают переработке различные отходы сельскохозяйственного производства, богатые пентозанами - полисахаридами, состоящими из пентоз. С этой целью сырье нагревают с кислотами, что сначала вызывает гидролиз, а затем превращение пентоз в фурфурол. В щелочной среде 3-дезоксигексозулозы через ряд перегруппировок превращаются в сахариновые кислоты. COOH H3C OH OH OH CH2OH -глюкосахариновая кислота Сахариновые кислоты нашли применение в синтезе разветвленных моносахаридов. 23.2.4. Методы укорочения и удлинения углеродной цепи моносахаридов При установлении строения моносахаридов или в синтетических целях часто прибегают к укорочению или удлинению цепи моносахаридов. Метод Руффа состоит в действии пероксида водорода на соль альдоновой кислоты в присутствии ионов трехвалентного железа. Считают, что реакция окисления протекает через стадию образования 2-кетоальдоновой кислоты: COOH COOH CHO OH CO H O HO HO OH OH OH OH OH OH CH 2OH CH2OH CH2OH D-глюконовая кислота 2-оксо-D-арабиногексоновая кислота D-арабиноза Распад по Волю заключается в действии на оксимы моносахаридов уксусного ангидрида с последующей обработкой полученного нитрила аммиачным раствором гидроксида серебра: CH NOH C N CHO OH OCOCH3 HO HO AgOH (CH3CO)2O CH OCO 3 OH OH OCOCH3 NH3 OH OH OCOCH3 CH2OH CH2OH CH2OCOCH3 D-арабиноза оксим D-глюкозы Расщепление по Веерману. Третий метод деградации моносахаридов состоит в расщеплении амида альдоновой кислоты при действии хлорноватистой кислоты в условиях реакции Гофмана: O CONH2 NCO C CHO OH OH OH H O HO HO HOCl O NH3 HO OH OH Na2CO3 OH -HNCO OH OH OH O CH 2OH CH2OH CH2OH CH2OH D-глюконолактон D-глюконамид, 80 % D-арабиноза, 49 % Синтез Килиани. Циангидринный синтез является классическим методом удлинения цепи альдоз. Э. Фишер нашел, что при этом образуются два энантиомерных нитрила, которые после гидролиза превращаются в альдоновые кислоты. Последние легко превращаются в -лактоны. На этой стадии происходит разделение эпимеров на индивидуальные соединения за счет их различной растворимости. Их восстановление амальгамой натрия приводит к альдозам: 194 OH H2O, H+ HO HO OH HO OH Na (Hg) HO HO CH2OH CH2OH L-глюконовая кислота L-глюконолактон CH2OH CHO OH HO O HO HO CHO C O COOH CN OH HO HO CH2OH L-глюкоза HCN HO HO CN OH OH CH2OH L-арабиноза HO HO CH2OH H2O, H+ COOH OH OH O CO OH Na (Hg) OH СHO OH OH HO HO HO HO CH2OH L-манновая кислота CH2OH L-маннонолактон CH2OH L-манноза Нитрометановый метод. В основе нитрометанового метода лежат конденсация первичных и вторичных нитроалканов с альдегидами и гидролиз образовавшихся солей аци-форм нитросоединений минеральными кислотами. Полученные в реакции эпимеры сравнительно просто разделяются кристаллизацией. HO * R CHO + CH3NO2 R CHOH CH2 NO2 RCHOH CH NO2 Na H+ * R CHOH CHO 23.2.5. Реакции по карбонильной группы Реакции с гидроксиламином. При взаимодействии моносахаридов с гидроксиламином образуются хорошо растворимые в воде и спирте оксимы. Большинство оксимов мутаротируют в растворах, что подтверждает наличие таутомерных превращений между открытой и циклической формами оксимов: CHO HC NOH CH2OH OH OH OH H O NH OH HO HO 2 OH HO HO NHOH OH OH OH CH2OH CH 2OH По этой причине оксимы не используются для идентификации и выделения сахаров. Реакции с гидразинами. На первоначальном периоде развитие химии углеводов тормозилось трудностью получения кристаллических производных углеводов, т.к. сахара вследствие высокой гидрофильности имеют тенденцию к образованию некристаллизующихся сиропов. Это препятствие было преодолено Э. Фишером введением в 1884 г. в синтетическую практику фенилгидразина, который реагирует со многими карбонильными соединениями, образуя малорастворимые и хорошо кристаллизующиеся гидразоны. CHO CH2 N NH C6H5 OH OH HO HO OH + C6H5NHNH2 OH OH OH CH2OH CH2OH D-глюкоза гидразон D-глюкозы При взаимодействии моносахаридов с избытком фенилгидразина образуются озазоны. Вначале получается гидразон. Затем под действием фенилгидразина происходит окисление гидроксильной группы в -положении до кетона, который также вступает в реакцию с фенилгидразином: 195 CHO OH HO CH N NH C6H5 C N NH C6H5 HO OH OH + 3C6H5NHNH2 - C H NH , 6 5 2 OH OH - NH3 CH2OH CH2OH D-глюкоза озазон D-глюкозы Поскольку в молекуле моносахарида в этой реакции исчезает один асимметрический центр, то эпимеры альдоз, а также 2-кетозы и 2-аминосахара, имеющие одинаковую конфигурацию остальных углеродных атомов, дают один и тот же озазон. Эти соединения сыграли важную роль в развитии химии углеводов, т.к. широко использовались в установлении строения и стереохимии моносахаридов. 23.2.6. Реакции по спиртовым гидроксильным группам Сложные эфиры моносахаридов. В химии углеводов наиболее широкое распространение получили ацетаты и бензоаты. Эти эфиры используются в качестве временной защиты гидроксильных групп, а также при выделении и разделении сахаров. Сложноэфирные группы легко удаляются при омылении метилатом натрия или аммиаком, что приводит к регенерации исходных веществ. Ацетилирование сахаров обычно проводят действием уксусного ангидрида в пиридине на холоду. В этих условиях образуются полные ацетаты с сохранением конфигурации у С1. CH2OH CH2OCOCH3 O O O (CH3CO)2O OH OCCH3 OH OCOCH3 HO CH3OCO OH OCOCH3 В отличие от ацетатов бензоильная группа может быть введена избирательно, она имеет меньшую склонность к миграции и более устойчива в условиях гидролиза. Бензоилирование осуществляют обычно действием бензоилхлорида в пиридине или в присутствии щелочи по Шоттен-Бауманну. Обычно реакция протекает менее энергично, чем ацетилирование, что используется для избирательного введения защиты по первичноспиртовому или гликозидному гидроксилу. Например, при получении 1,6-ди-О-бензоил-D-маннита или 1-О-бензоил-4,6-О-бензилиден-D-глюкозы. O CH2O C O CH C 6 H5 HO 2 O HO O C6H5 CH OH O C OH C 6 H5 OH O O CH2O C OH C 6 H5 1,6-ди-О-бензоил-D-маннит 1-О-бензоил-4,6-О-бензилиден-D-глюкоза Сульфаты. В связи с тем, что сульфаты полисахаридов широко распространены в природе и играют важную биологическую роль, сульфаты моносахаридов представляют интерес как мономерные единицы природных биополимеров. Сульфаты моносахаридов обычно получают действием пиридинсульфотриоксида в пиридине при комнатной температуре. Этерифицируется в первую очередь первичноспиртовая группа: CH2OH CH2OSO3H O O C5H5N . SO3 OH OH OH OH HO HO OH OH Сульфоэфиры сахаров легко расщепляются кислотами. Простые эфиры сахаров. Наибольший интерес среди простых эфиров вызывают метиловые эфиры, т.к. частично метилированные сахара широко распространены в природе, в частности, они входят в состав полисахаридов, сердечных гликозидов и антибиотиков. Метилирование осуществляют действием на моносахариды иодистого метила в присутствии оксида серебра (метод Пурди-Ирвина) или диметилсульфатом 196 (СН3О)2SO2 в присутствии едкого натра (метод Хеуорса). CH2OCH3 CH2OH O O CH3I OCH3 OH Ag2O OCH3 HO OCH3 CH3O OCH3 OH В отличие от сложных эфиров метиловые эфиры являются очень устойчивыми соединениями, что сыграло решающую роль в установлении строения углеводов. Тритиловые (трифенилметиловые) эфиры имеют большое значение в синтетической химии углеводов, т.к. тритилированию подвергаются преимущественно первичные спиртовые группы. Их получают действием на моносахариды трифенилхлорметана (TrCl) в пиридине. CH2OTr CH2OH O O TrCl OH OH C5H5N Tr = -C(C6H5)3 OCH3 HO OCH3 HO OH OH Избирательность объясняется, по-видимому, большим объемом тритильной группы. Она устойчива к действию оснований и легко удаляется в кислой среде. 23.2.7. Реакции и производные гликозидного гидроксила Полуацетальная или иначе гликозидная гидроксильная группа отличается по своему поведению от обычных гидроксилов. Она легко подвергается нуклеофильному замещению на галоген или алкоксильную группу. Гликозилгалогениды. Типичным способом получения гликозилгалогенидов является действие безводных галогеноводородов на ацетаты моносахаридов. CH2OCOCH3 CH2OCOCH3 O O HBr OCOCH OCOCH3 3 Br OCOCH CH3OCO CH3OCO 3 OCOCH3 OCOCH3 В гликозилгалогенидах атом галогена легко подвергается замещению под действием различных нуклеофилов и элиминированию под действием оснований. O CN OH OCOR' O NHR RNH2 OCOR' O SR OCOR' OCOR' Zn AgCN ROH O Br OCOR' RSNa O OR ArONa OCOR' O OAr AgOCOR H2O OCOR' O OCOR O OH OCOR' OCOR' Гликозиды. Наиболее обширный класс соединений, образованных за счет полуацетального гидроксила, представляют гликозиды. При кипячении углеводов со спиртами в присутствии кислот происходит замена полуацетального (гликозидного) гидроксила на алкоксильную группу с образованием смешанного ацеталя, называемого гликозидом. 197 CH2OH CH2OH O O CH3OH OH OH HCl OCH3 HO OH HO OH OH В зависимости от природы гетероатома, соединяющего моносахарид с углеводородным атомом, различают O-гликозиды, S-гликозиды, N-гликозиды, C-гликозиды и т.п. CH2OH O X = O, S, N, C OH X-R HO OH Наиболее широко распространены в растительном мире О-гликозиды. В качестве неуглеводной (агликонной) составляющей выступают фенолы, флавоноиды, терпеноиды, стероиды и т.п. Среди моносахаридов чаще всего встречаются D-галактоза, D-глюкоза, L-арабиноза, L-рамноза и Dглюкуроновая кислота. Ниже приведены примеры отдельных гликозидов. CH 2OH CH2OH OO OO OH CH CH CH2OH OH OH СН 3О HO HO OH OH кониферин (спаржа) арбутин (брусника) H3C COOH OH O HO OH O HO CH 3 СOOH O O OO O CH3 CH3 СOOH OH O HO OH OH OH кверцетин (листья чая ) HO O OH глицирризин (солодка) CH3 O H3C CH2OH OO OH HO C2 H5 H3C CH 3 H 3C CH 3 OH CH3 CH 3 CH3 HO O CH3 HO O H C H3C O OH O OH конвалля токсин (ландыш) OH Расщепление гликозидной связи проводят в кислой среде или с помощью ферментов. Фермент эмульсин из косточек миндаля расщепляет только -глюкозидную связь, а фермент мальтаза из дрожжей действует только на -глюкозидную связь. В нуклеозидах, относящихся к N-гликозидам, гетероциклический агликон связан с D-рибозой или 2-дезокси-D-рибозой через атом азота. Агликонами выступают тимин, цитозин, урацил, аденин и гуанин. Ниже приведены структуры отдельных нуклеозидов. - глюкозид- -ситостерина (масла высших растений) OH 198 O NH2 N N N N CH2OH O HO OH аденозин O N HN H2 N N N NH CH2OH O N CH2OH O HO HO OH гуанозин NH2 OH уридин O O H3C N N CH2OH O HO OH цитозин O NH N CH2OH O HO O OH риботимидин 23.3. ВАЖНЕЙШИЕ МОНОСАХАРИДЫ Формально к моносахаридам принадлежат D- и L-глицериновый альдегид и дигидроксиацетон. Их эфиры с фосфорной кислотой играют важную роль в расщеплении углеводов в организме. Однако наибольшее распространение в природе получили пентозы и гексозы. Пентозы. L-Арабиноза и D-ксилоза – структурные единицы пентозанов, откуда их получают кислотным гидролизом. Восстановлением ксилозы готовят ксилит – заменитель сахара для диабетиков. D-Рибоза входит в состав нуклеиновых кислот. Альдо- и кетогексозы. Из 16 стереоизомерных альдогексоз в природе найдены D-глюкоза, Dманноза, D-галактоза и D-талоза. D-Глюкоза (виноградный сахар, декстроза) содержится в винограде и фруктах, является структурным звеном сахарозы, клетчатки, крахмала, гликогена. D- и L-Галактоза встречается в растительных и животных биополимерах, входят в состав лактозы. В виде уроновой кислоты является структурным мономером пектиновых веществ и полисахаридов бактерий. D-Манноза в свободном виде найдена в кожуре апельсинов; структурный фрагмент полисахаридов маннанов, откуда ее и получают. D-Фруктоза (фруктовый сахар, левулеза) содержится в спелых фруктах, меде, структурный фрагмент сахарозы и полисахарида инулина. Дезоксисахара - моносахариды, в молекуле которых одна или несколько гидроксильных групп заменены на атомы водорода. Дезоксисахара – являются структурными фрагментами нуклеиновых кислот, полисахаридов, сердечных гликозидов, антибиотиков. 2-Дезокси-D-рибоза входит в состав ДНК. L-Рамноза (6-дезокси-L-манноза) является структурным фрагментом растительных гликозидов. L-Фукоза (6-дезокси-L-галактоза) входит в состав олигосахаридов молока и различных гликопротеинов. Аминосахара формально получаются заменой гидроксила на аминогруппу. N-Ацетил-D-глюкозамин (2-ацетамидо-2-дезокси-D-глюкоза) – структурный фрагмент гликопротеинов, гиалуроновой кислоты, олигосахаридов молока, полисахаридов бактерий. Из Nацетилглюкозамина построен полимер хитин, из которого кислотным расщеплением выделяют Dглюкозамин. D-Галактозамин – структурный фрагмент гликопротеинов, некоторых бактериальных полисахаридов, хондроитинсульфата (стекловидное тело). Аскорбиновая кислота (витамин С) находится в тесной связи с моносахаридами, содержится в большом количестве в шиповнике, свежих фруктах. Суточная потребность человека составляет около 30 мг. Недостаток витамина С вызывает цингу и повышенную инфекционную восприимчивость. Аскорбиновая кислота была первым витамином, полученным в чистом виде и первым синтетическим витамином. С химической точки зрения витамин С является производным моносахарида – γ-лактон 2-оксоL-гулоновой кислоты. 199 COOH O HO H OH H HO H COOH OH OH H OH HO H CH2OH CH2OH таутомерные формы 2-оксо-L-гулоновой кислоты HO OH O O HO OH аскорбиновая кислота В настоящее время аскорбиновую кислоту получают в промышленности исходя из глюкозы. Последнюю превращают в D-сорбит путем гидрогенизации над медно-хромовым катализатором. Далее сорбит подвергают селективному окислению с помощью Acatobacter xylinum до L-сорбозы: CH2OH CH2OH CH2OH HO HO CO HO H2 Acetobacter HO HO OH xylinum OH OH H O HO HO CH2OH CHO CH2OH 70 % 97 % Для окисления гидроксиметильной группы у С6-атома необходима защита остальных спиртовых групп, что достигается превращением L-сорбозы в ее диацетонид (дикеталь). После окисления защиты удаляют кислотным гидролизом. 2-Оксо-L-гулоновую кислоту енолизируют с одновременной внутримолекулярной циклизацией: H3C CH3 H3C C CH3 C OH O KMnO4 CH3COCH3 O O O O H+ HO H+ O O CH2OH HO HOH2C CH2OH COOH 2 H2C H2C OH O O O O диацетонид L-сорбофураноза C диацетонид C H3C CH L-сорбофуранозы H3C CH 2-оксо-L-гулоновой 3 3 кислоты (97 %) COOH CO HO HO H+ OH OH O O HO CH2OH OH OH 2-оксо-L-гулоновая кислота (82 %) аскорбиноваяч кислота 23.3.1. Брожение моносахаридов Многие моносахариды, а также дисахариды мальтоза, сахароза и лактоза после гидролиза способны вступать в анаэробное (без доступа кислорода) расщепление под воздействием ферментного препарата из дрожжей (зимаза). Это набор ферментов, из которых многие присутствуют в клетках животных и растений. Характер продуктов брожения зависит от типа микроорганизмов, типа субстрата, рН среды, наличия или отсутствия кислорода. Спиртовое брожение – это расщепление не самих моносахаридов, а сложных эфиров моноз и фосфорной кислоты, которые образуются в водных растворах с участием аденозинтрифосфата (АТФ), который этерифицирует гидроксильную группу у С6-глюкозы, превращаясь при этом в аденозиндифосфат (АДФ). Процесс катализируется ферментом глюкокиназой. Под воздействием фермента изомеразы 6-фосфо-глюкоза трансформируется в 6-фосфо-фруктозу. Последняя еще раз фосфорилируется, превращаясь в 1,6-дифосфат фруктозы. Полученный продукт под влиянием фермента альдолазы расщепляется на фосфат дигидроксиацетона и 3-фосфаглицеринового альдегида, которые в присутствии фермента изомеразы, превращаются друг в друга: 200 OH OH CH2OH HC HC H O H OH H OH АТФ АТФ HO H O глюкокиназа HO H O изомераза HO H O фосфофруктокиназа H OH H OH H OH H H H CH2OPO 3H2 CH2OH CH2OPO 3H2 HO HO H H CH2OPO 3H2 H OH O CH2OPO 3H2 CH2OPO3 H2 C O HO H H OH H OH CH2OPO3 H2 CH2OPO3 H2 C O CH2OH альдолаза H CO H OH CH2OPO 3H2 3-Фосфат глицеринового альдегида с участием фермента дегидрогеназы, глутатиона (ГSH) – донора меркаптогруппы и никотинамидадениннуклеотида (HАД), выступающего в качестве переносчика водорода, превращается через несколько стадий в пировиноградную кислоту: H ГS O H O PO O ГSH + НАД; H3PO4 2 3 НАД H C O C C дегидрогеназа ГS C OH -НАД-Н H C OH -ГSH -НАД-Н2 H C OH H C OH 2 H C OH CH2OPO3 H2 CH2OPO 3H2 CH2OPO 3H2 CH2OPO3H2 АДФ; фосфоглицераткиназа -АТФ HO O HO O HO O фосфоглицеромутаза HO O енолаза АДФ C C C C -H2O -АТФ H C OPO 3H2 C OPO3H2 C O H C OH CH2OH CH2 CH3 CH2OPO3H2 пировиноградная кислота При спиртовом брожении пировиноградная кислота под воздействием фермента пируватдекарбоксилазы дает уксусный альдегид, который восстанавливается НАД-Н2, входящего в состав фермента алкогольдегидрогеназы, до этанола. алкагольдегидрогеназа OH пируватдекарбоксилаза H НАД-Н2 H3C C C CH3CH2OH H3 C C O - CO2 - НАД O O Уксуснокислое брожение. Если брожение протекает в присутствии кислорода, то в качестве основного продукта выделяют уксусную кислоту. В атмосфере воздуха этиловый спирт окисляется кислородом в присутствии алкогольоксидазы, выделяемой уксуснокислыми бактериями: CH3CH2OH O2 алкогольоксидаза CH3COOH + H2O2 Таким путем получают пищевую уксусную кислоту. Этот процесс протекает при скисании молодого вина при нарушении технологии брожения. Молочнокислое брожение. При ферментативном брожении под действием Lactobacillus delbruckii пировиноградная кислота восстанавливается до молочной с помощью НАДН2: O НАД-H O 2 H3C C C CH3CHOH C OH OH -НАД O Эта реакция лежит в основе производства самой молочной кислоты, а также хлеба, кисломолочных продуктов, при силосовании кормов в сельском хозяйстве. Квашение плодов и овощей осуществляется под воздействием Bacterium lactic aerogenes. В этом случае образуются молочная и уксусная кислоты, этиловый спирт. В заключение отметим, что известны и другие виды брожения, например, лимоннокислое, пропионовокислое, маслянокислое, ацетон-бутиловое и т.п. 23.3.2. Фотосинтез сахаров в растениях 201 Весь сложный органический материал зеленых растений синтезируется из диоксида углерода и воды за счет солнечной энергии, в преобразовании которой непосредственно участвует хлорофилл. 6CO2 + 6H2O h дыхание 6O2 + C6H12O6 Животные организмы не способны осуществлять такой синтез, и поэтому целиком зависят от органического материала, который получают с пищей. С помощью меченого диоксида углерода 14СО2 было установлено, что первым устойчивым производным ассимилированного углекислого газа является фосфоглицериновая кислота Н2О3РОСН2СН(ОН)14СООН, которая образуется за счет взаимодействия углекислоты с дифосфатом рибулозы. Фосфорный эфир глицериновой кислоты под действием света восстанавливается в фосфат глицеринового альдегида. Последний вступает в альдольную конденсацию со своим изомером – фосфатом дигидроксиацетона и стереоспецифически, как и в большинстве энзиматических реакций, превращается в дифосфат фруктозы. Наряду с этим, образуется и дифосфат рибулозы, необходимый для новой ассимиляции оксида углерода(IV): CH2OPO 3H2 H O H CH2OPO3 H2 C CO h HO O HC O H OH + H2O + CO2 + -1/2O2 H OH H OH HO O CH2OPO3 H2 CH OPO3H2 C 2 H OH CH2OPO3 H2 CH2OPO3 H2 C O CH2OPO3 H2 CH2OH CO HO H H OH HC O H OH H OH CH2OPO3 H2 CH2OPO3H2 23.4. ВАЖНЕЙШИЕ ОЛИГОСАХАРИДЫ Олигосахариды образуются за счет О-связи между гликозидным гидроксилом одного моносахарида и любым гидроксилом другого моносахарида. В том случае, когда в образовании этой связи участвуют оба гликозидных гидроксила, синтезируются невосстанавливающие дисахариды. К ним относятся трегалоза и сахароза. Если же один из моносахаридных остатков дисахарида содержит свободный полуацетальный (гликозидный) гидроксил, то такие дисахариды называются восстанавливающими, поскольку в этом случае возможно окисление олигосахарида до карбоновой кислоты. Наиболее распространенными дисахаридами являются мальтоза, целлобиоза и лактоза. Коротко остановимся на методах установления строения восстанавливающих дисахаридов. Мальтоза С12Н12О11 получается с выходом около 80 % при действии на крахмал фермента амилазы. Дисахарид восстанавливает реактив Толленса, окисляясь до мальтобионовой кислоты. Кроме того, мальтоза реагирует с фенилгидразином, давая озазон С12Н20О9(=N-NH-C6H5)2. Поскольку мальтоза расщепляется -глюкозидазой (мальтазой) до глюкозы, то она является глюкозилглюкозой. Остается выяснить, какая из гидроксильных групп восстанавливающего моносахарида участвует в образовании гликозидной связи в мальтозе и каковы размеры циклов обоих звеньев D-глюкозы. Ответ на этот вопрос дает исчерпывающее метилирование и последующий гидролиз перметилированной мальтобионовой кислоты. В результате этих процедур образуются 2,3,5,6-тетраО-метил-D-глюконовая кислота и 2,3,4,6 тетра-О-метил-D-глюкоза. Эти продукты указывает на то, что мальтоза представляет собой 4-О-(-D-глюкопиранозил)-D-глюкопиранозу: 202 HOCH2 HO HO HOCH2 O HOCH 2 OH O HO O Br2 HO HO OH HO мальтоза CH3OCH2 СН3О СН3О O HOCH 2 OH O HO мальтобионовая кислота O CH3OCH2 ОСН3O СН3О СН3ОСН2 H2O, OСН3 H+ СН3О СООСН3 СН3О OСН3 OH HO СН3O O + OH ОСН 2,3,4,6 - тетра-Ометил-D-глюкоза метил-окта-О-метил-D-мальтобионоат COOH (СH3O)2SO2, NaOH 3 COOH ОСН3 OH ОСН3 CH2OCH3 2,3,5,6-тетра-О-метилD-глюконовая кислота Целлобиоза С12Н22О11 может быть получена при частичном гидролизе целлюлозы. Целлобиоза является восстанавливающим дисахаридом, образует озазон. Последовательность тех же реакций окисления, метилирования и гидролиза, что и для мальтозы, показывает, что целлобиоза содержит два пиранозных кольца и глюкозидную связь с ОН-группой у С4. Отличие от мальтозы заключается в том, что глюкозидная связь между моносахаридами расщепляется эмульсином из горького миндаля, способного гидролизовать -глюкозидные связи. Таким образом, целлобиоза является 4-О-(-Dглюкопиранозил)-D-глюкопиранозой. OH OH HO HO O O OH HO O OH OH Лактоза С12Н22О11 входит в состав женского и коровьего молока. В промышленности она получается в качестве побочного продукта при производстве сыра. Лактоза – восстанавливающий сахар, поэтому она образует озазон. Поскольку лактобионовая кислота, образующаяся при окислении лактозы бромом, распадается при гидролизе на галактозу и глюконовую кислоту, то восстанавливающим фрагментом дисахарида является глюкоза. Метилирование и последующий кислотный гидролиз указывают на пиранозные циклы моносахаридов и 14-связь между ними. Поскольку лактоза расщепляется ферментом -галактозидазой, она представляет собой 4-О-(-D-галактопиранозил)-Dглюкопиранозу. HO OH OH O HO O OH HO O OH OH Из невосстанавливающих дисахаридов изучим строение сахарозы. Сахароза С12Н22О11 не восстанавливает реактив Толленса, не образует озазон, не окисляется бромом и, в отличие от рассмотренных дисахаридов, не мутаратирует в растворах. Следовательно, в сахарозе оба гликозидных гидроксила участвуют в образовании связи между моносахаридами. При кислотном гидролизе сахарозы образуются фруктоза и глюкоза. Высокая лабильность к кислоте указывает на то, что один из моносахаридов в дисахариде находится в фуранозной форме. При метилировании сахарозы и последующем гидролизе получаются 2,3,4,6-тетра-О-метил-D-глюкоза и 1,3,4,6тетра-О-метил-D-фруктоза. На основании различных методов, в том числе рентгеноструктурного, пришли к заключению, что сахароза представляет собой -фруктофуранозид и -D-глюкопиранозид. Поэтому её можно определить как -D-глюкопиранозил-(1→2)--D-фруктофуранозид или -Dфруктофуранозил-(2→1)--D-глюкопиранозид. CH2OH HOCH2 O O HO HO HO OH O CH2OH OH Сахароза – важный пищевой продукт, известный уже несколько столетий. Первоначально ее добывали из сока сахарного тростника. В настоящее время половину сахарозы добывают из сахарной 203 свеклы. Хотя присутствие сахарозы в корнеплодах известно давно, ее промышленное производство начато только во время британской блокады в период Наполеоновских войн, когда завоз тростника из Центральной Америки стал невозможен. Под воздействием инвертазы, содержащейся в организме пчел, происходит инвертирование сахарозы из нектара до равной смеси D-глюкозы и D-фруктозы. Этот инвертированный пчелами сахар представляет собой мед. 23.5. ПОЛИСАХАРИДЫ 23.5.1. Полисахариды растительного происхождения Основными полисахаридами этой группы являются целлюлоза, гемицеллюлозы, пектиновые вещества, крахмал, фруктозаны и биополимеры водорослей. Целлюлоза чрезвычайно широко распространена в растительном мире. Ее содержание составляет от 40-50 % в древесине до 98 % в вате хлопчатника. В промышленности целлюлозу выделяют химической обработкой древесины, с помощью которой удаляются лигнин, гемицеллюлозы и другие сопутствующие вещества. Для этого проводят экстракцию сырья смесью бисульфита кальция и сернистой кислоты (сульфитный метод), едким натром (натронный метод) или едким натром с сульфидом натрия (сульфидный метод) при давлении и температуре. Строение целлюлозы было установлено с помощью частичного и полного кислотного гидролиза, метилирования и окисления иодной кислотой. Полный кислотный гидролиз целлюлозы дает только глюкозу, а гидролиз ее перметилата приводит к 2,3,6-три-О-метил-D-глюкозе с небольшой примесью 2,3,4,6-тетра-О-метил-D-глюкозы. Таким образом, результаты метилирования указывают на линейное строение целлюлозы с 14-связями между моносахаридами. На основании спектральных данных определена -конфигурация гликозидных центров. Количество моносахаридных остатков может достигать 10 000. OH OH ... H OH1 4 O O O O O 1 O 4 O O HO O . . OH OH .H OH целлюлоза Приведенная структура подтверждается получением при частичном и ферментативном гидролизе целлобиозы и ее олигомеров, а также периодатным окислением, при котором на каждый моль моносахарида расходуется один моль окислителя. Линейные макромолекулы целлюлозы, располагаясь параллельными пучками, образуют за счет водородных связей очень прочные трехмерные структуры. В древесине эти целлюлозные пучки окружены лигнином, что дает структуры, которые можно сравнить с армированным бетоном. Ферментов, расщепляющих -гликозидные связи в пищеварительном тракте человека в отличие от животных нет, поэтому человек не способен переварить целлюлозу, но тем не менее она является необходимым веществом нормального питания. Целлюлоза и ее производные имеют колоссальное практическое значение. При ее обработке смесью концентрированной азотной и серной кислоты образуется полностью нитрованная целлюлоза, которая идет на изготовление пороха. Целлюлоза, содержащая от двух до трех нитрогрупп на остаток глюкозы, представляет собой пироксилин, необходимое сырье в производстве целлулоида и коллодия. Из последнего ранее готовили нитролаки и фотопленки. Из-за их горючести и ядовитости в настоящее время они сняты с производства. При действии на целлюлозу смеси уксусного ангидрида и уксусной кислоты в присутствии каталитических количеств серной кислоты синтезируют ацетат целлюлозы, который затем подвергают частичному омылению. При этом происходит частичная деградация макромолекулы. Такой ацетат целлюлозы применяют вместо нитрата в производстве безопасной кино- и фотопленки. При продавливании ацетонового раствора ацетата целлюлозы через фильеры с последующем испарением растворителя получают ацетатный шелк. При обработке целлюлозы сероуглеродом в щелочи она превращается в ксантогенат целлюлозы: 204 CH2ONa O O OH OH nCS2 S H2C O C SNa O O OH OH n n Продавливанием ее раствора через фильеры в подкисленные растворы регенерируют исходную целлюлозу. Так готовят вискозное волокно, идущее на производство текстильных тканей и шинного корда. При продавливании раствора через длинные узкие щели готовят целлофан. Сырьем для производства бумаги также служит целлюлоза. После отбеливания ее смешивают с наполнителем (гипс или тяжелый шпат) и проклеивают. На такой бумаге чернила не расплываются. Фильтровальная бумага состоит из чистой целлюлозы. Огромное значение имеет целлюлоза в производстве этилового (гидролизного) спирта, который готовят гидролизом целлюлозы до глюкозы, подвергаемой далее брожению. Гемицеллюлозы в зависимости от моносахаридного состава главной цепи делятся на ксиланы, глюкоманнаны и галактаны. Ксиланы составляют главную часть гемицеллюлоз покрытосеменных растений. Наиболее изученным представителем этой группы является О-ацетил-(4-О-метилглюкуроно)-ксилан. Остаток 4-Ометил-D-глюкуроновой кислоты присоединен к гидроксилу С2-ксилозы каждого десятого остатка пентозы. Главная линейная цепь ксилана имеет (1→4)-связи. Ацетильные остатки локализованы преимущественно у С3-ксилозы. COOH O CH3O HO HO O O HO O O O CH3COO O OH Полисахариды зерновых культур представляют собой арабиноксиланы, в которых арабинофуранозные остатки присоединены к остаткам ксилозы основной цепи 13-связями. Глюкоманнаны голосеменных растений имеют линейную структуру с (1→4)-связями с невыясненной регулярностью чередования остатков глюкозы и маннозы. Галактаны хвойных состоят из мономеров галактозы с (1→3)- и (1→6)-связями. По концам полисахаридов имеются арабофуранозные и арабопиранозные фрагменты. Пектиновыми веществами называют полиурониды, присутствующие во всех растениях и в ряде водорослей. Главным строительным звеном является D-галактуроновая кислота, часто этерифицированная метиловым спиртом. 14-Связи между моносахаридными остатками были доказаны перйодатным окислением с доокислением, в результате чего была выделена D-винная кислота: COOH O HO HO HIO4 O COOH O HO HO O COOCH3 O HO HO O COOH O HO HO O COOH O H H+ H C C O O O COOH Br2 O H CHC O O COOH HO OH COOH + COOH COOH O Важным в практическом отношении свойством пектиновых веществ является способность их растворов к образованию прочных гелей или студней. Обычным промышленным источником служат яблоки, цитрусовые. Основное применение пектины находят в фармацевтической и пищевой промышленности. 205 Крахмал является основным резервным полисахаридом семян злаков – пшеницы, риса, кукурузы. Он также содержится в клубнях картофеля. Обычно крахмал содержит около 20% растворимой в воде фракции амилозы и 80% амилопектина. Амилоза представляет собой линейный полисахарид с (14)-связями между остатками Dглюкопиранозы. Эти сведения были получены на основе метилирования, периодатного окисления, частичного и ферментативного расщепления амилозы. Вискозиметрические измерения дают значения степени полимеризации порядка 1000 остатков глюкозы. Амилоза дает интенсивное синее окрашивание с иодом. Предполагают, что ее цепи закручены в виде спирали, внутренние размеры которой позволяют разместиться молекуле иода. O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O O Пространственное строение амилозы и амилопектина Амилопектин, в отличие от амилозы, обладает высокоразветвленной структурой. Остатки Dглюкозы в основной цепи соединены (1→4)-связями. При метилировании наряду с 2,3,4,6-тетра-Ометил- и 2,3,6-три-О-метил-D-глюкозой выделяют 2,3-ди-О-метил-D-глюкозу, что указывает на наличие разветвления по С6-атому глюкозы в амилопектине. Как и амилоза амилопектин образует йодный комплекс, который имеет красный цвет. Причем существует линейная зависимость между степенью разветвления полисахарида и длиной волны поглощения в видимой области спектра. Крахмал находит обширное применение в пищевой и текстильной промышленности, в производстве бумаги, клея и т.п. C H2 O H O HO C H2 OH C H2O H O O HO OH CH C H 2O H O 2 O HO C H2 OH O Фруктаны построены из остатков D-фруктозы и выполняют аналогично крахмалу роль пищевого резерва растений. В качестве примера может служить инулин, содержащийся в клубнях и корнях представителей сложноцветных (топинамбур, артишок, одуванчик). По результатам метилирования установлено, что остатки D-фруктозы связаны между собой 2→1-связями, а сами моносахариды находятся в фуранозной форме. Отсутствие восстанавливающих свойств в инулине и наличие в гидролизате небольшого количества D-глюкозы объясняется тем, что восстанавливающий конец молекулы заменен гликозид-гликозидной группировкой типа сахарозы. Степень полимеризации составляет около 35. и н ул и н Из полисахаридов водорослей наиболее часто встречаются агар, каррагинин и альгиновая кислота. Агар получают в промышленности экстракцией красных водорослей и используют в качестве желирующего агента. Основной компонент агара – агароза – построена из D-галактозы и 3,6ангидро-L-галактозы: HO OH HO OH HO HO O O O O O O O O HO HO HO OSO3H O На основании метилирования установлено, что остатки D-галактопиранозы имеют заместители в положении 3, а 3,6-ангидро-L-галактозы – в положении 4. Содержание остатков серной кислоты невелико и они, по-видимому, находятся по С6-атому D-галактозы.. Строение агарозы предложено с 206 учетом ферментативного и частичного гидролиза. В каррагинанах, построенных аналогично агарозе, сульфатная группа находится у С2 и С6галактозы. Основным компонентом бурых водорослей является альгиновая кислота – полиуронид, состоящий из D-маннуроновой и L-гулуроновых кислот. HOOC HO HOOC HO COOH O O HO O O O O HO HO O OH Альгиновую кислоту получают из бурых водорослей, главным образом из ламинарии. Используют в качестве желирующего агента и эмульгатора. Камеди – это полисахариды, выделяющиеся в виде вязких растворов и образующие стеклообразную массу при повреждении коры многих растений. Их образование связывают с патологическим состоянием – механическими или инфекционными повреждениями. Камеди состоят из кислых и нейтральных биополимеров. В состав кислых полисахаридов входят D-глюкуроновая кислота, D-ксилоза и D-фукоза, а нейтральных – D-галактоза и L-арабиноза. Полисахариды слизей представляют собой линейные галактоманнаны с (1→4)-связями. Некоторые представители имеют разветвление в положении 3. Слизи являются продуктами нормального метаболизма растений и служат либо пищевым резервом, либо веществами, удерживающими воду, особенно в тканях суккулентов. Камеди и слизи находят широкое применение в медицине, пищевой промышленности, в производстве бумаги, текстильных изделий, при получении эмульгаторов и клеев. 23.5.2. Зоополисахариды Гликоген представляет собой резервный полисахарид, общий для всех животных организмов. Он построен исключительно из остатков D-глюкозы. Методами метилирования, периодатного окисления, частичного кислотного гидролиза и ферментативного расщепления доказано, что он является ближайшим аналогом амилопектина. Отличие от последнего состоит в большей разветвленности и более тесной «упаковке» макромолекулы. Хитин – основной компонент наружного скелета ракообразных и насекомых. При полном кислотном гидролизе хитина в жестких условиях образуются эквимолярные количества глюкозамина (2-амино-2-дезокси-D-глюкозы) и уксусной кислоты. Из анализа продуктов частичного гидролиза следует, что хитин представляет собой однородный линейный полимер N-ацетилглюкозамина, в котором моносахаридные остатки в пиранозной форме связаны между собой (1→4)-связями. OH OH O O O HO O HO NH NH C CH3 C CH3 O O По химическому строению, физико-химическим свойствам и биологической роли хитин сходен с целлюлозой. 23.5.3. Мукополисахариды Гиалуроновая кислота – полисахарид, родственный хитину, выделена из стекловидного тела глаза, синовиальной жидкости суставов. В его состав входит D-глюкуроновая кислота и Nацетилглюкозамин. На основании ферментного расщепления макромолекулы микробиальной гиалуронидазой и последующего анализа продуктов распада с помощью периодатного окисления и метилирования для гиалуроновой кислоты было предложено следующее строение: OH COOH O O HO O O HO C CH3 NH OH O . 207 Растворы гиалуроновой кислоты благодаря вязкости выполняют в суставах организма функцию смазочного материала, а также регулируют распределение воды в организме и обеспечивают избирательную проницаемость тканей. Гепарин – мукополисахарид с молекулярной массой 10-20 тысяч. Имеет блочное строение. Выделяют два блока, в состав которых входят глюкозамин и, соответственно, -L-идуроновая и -Dглюкуроновая кислоты. Сильнокислый характер гепарину придают остатки серной кислоты по амино- и С6-гидроксигруппам глюкозамина и гидроксилу у С2-уроновых кислот. OSO3H OSO3H COOH O O O O O O HO HO HO HO OSO3H HOOC OSO3H HO3SNH HO3SNH n m O O Гепарин обладает специфическим свойством увеличивать время свертываемости крови и применяется в медицине для предотвращения образования тромбов после некоторых видов хирургических операций и инфарктов миокарда. Получают из печени крупного рогатого скота. Весьма близки к гепарину по строению хондроитинсульфаты – сульфатированные мукополисахариды. Они входят в состав соединительной ткани животных. Углеводные цепи построены из чередующихся остатков 4-О-замещенной -D-глюкуроновой кислоты и 3-О-замещеного N-ацетил--Dгалактозамина, сульфатированного в положение 4 (хондроитинсульфат А) или в положение 6 (хондроитинсульфат С). Степень полимеризации равна 150 дисахаридным единицам: HO OSO3H HO3SO OH COOH COOH O O O O O O O O HO HO NH C CH3 NH C CH3 OH OH O O хондроитинсульфат А хондроитинсульфат С Хиндроитинсульфат В или -гепарин отличается от хиндроитинсульфатов А и С тем, что вместо D-глюкуроновой кислоты содержит ее эпимер по С5 – L-идуроновую кислоту. 23.5.4. Полисахариды микроорганизмов Декстраны представляют собой глюканы с (1→6)-связями, вырабатываемые бактериями Leuconostoc и Streptocoсcus. Они обладают антигенными свойствами. В настоящее время декстраны в больших количествах производятся в промышленности в качестве заменителей плазмы крови, а также исходных веществ при получении молекулярных сит – сефадексов, нашедших широкое применение в лабораторной практике для разделения веществ по молекулярной массе. Мурамин – полисахарид клеточных стенок бактерий. Структурно напоминает хитин, в котором один из остатков глюкозамина образует простой эфир с D-молочной кислотой (N-ацетилмурамовая кислота). OH OH O O O O O HO NH NH C CH3 H3C CH COOH C CH 3 O O