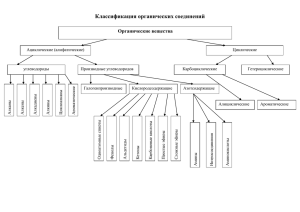
ОСОБЕННОСТИ СТРОЕНИЯ, РЕАКЦИОННОЙ СПОСОБНОСТИ И МЕТОДЫ СИНТЕЗА ГАЛОГЕНПРОИЗВОДНЫХ Галогенпроизводные углеводородов Галогенопроизводными называются производные углеводородов, в которых один или несколько атомов водорода заменены атомами галогена. 2 Галогенпроизводные углеводородов Классификация 3 H H H C C F H H H H H C C Cl H H R Hal H H H C C Br H H H H H C C 4 H H I • 1. Строение и классификация галогенопроизводных H H C2H5Br H C C Br CH3 CH2 Br H H бромэтан (этилбромид) -I эффект H H C Cl H2C CH +М эффект > ... Cl ... ... Cl .. . H -I эффект H . Cl H H H хлорэтен (винилхлорид) H хлорбензол Классификация галогеноуглеводородов • Галогеноуглеводороды классифицируют по нескольким структурным признакам. • 1. По типу атома галогена галогеноуглеводороды подразделяют на фторо-, хлоро-, бромо-, иодопроизводные, а также смешанные производные, содержащие атомы различных галогенов. • • 2. По числу атомов галогена различают моно-, ди-, тригалогениды и т.д. Дигалогениды, содержащие атомы галогена при одном и том же углеродном атоме, называют геминальными (от лат. gemini – близнецы), а при соседних атомах углерода – вицинальными (от лат. vicinus – соседи). • 3. • • • По строению углеводородных радикалов, связанных с атомом галогена, галогеноуглеводороды подразделяют на предельные – галогеналканы (например, хлорметан СH3–Cl) и галогеноциклоалканы (бромциклогексан С6Н11–Br и др.); непредельные – галогеналкены (винилхлорид CH2=CH–Cl, аллилхлорид CH2=CH–CH2–Cl), галогеналкины (CHC–CH2–F); галогенарены, которые делятся на две группы: 1) соединения, содержащие галоген в ароматическом ядре Br CH2Cl бензилхлорид Cl CHCl2 бензилиденхлорид NO2 бромбензол 2) соединения, содержащие галоген в боковой цепи м-нитрохлорбензол • 4. Классификация алкилгалогенидов в зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связан атом галогена, CH3 CH2 CH2 CH2 Cl CH3 CH3 CH2 CH Cl Первичный бутилхлорид Вторичный бутилхлорид CH3 CH3 C CH3 Cl Третичный бутилхлорид 10.09.2019 • 2. Номенклатура • Название галогенопроизводных углеводородов образуют путем прибавления перфикса галогено- (бромо-, хлоро- и т.д.) к названию родоначального углеводорода. Цепь или цикл нумеруют таким образом, чтобы галоген получил наименьший номер. В ненасыщенных соединениях предпочтение в нумерации отдается кратной связи. 4 3 2 1 1 H2C CH3 CH CH2 CH2 Cl CH3 3-метил-1-хлорбутан CH3 CH2 Cl этилхлорид (ИЮПАК: хлорэтан CHCl3 хлороформ 2 3 CH CH2 Br 3-бромпропен CH3 CH2 CH2 CH2 Br бутилбромид 1-бромбутан CHBr3 бромоформ H2C CH Cl винилхлорид хлорэтен) CHI3 йодоформ • 3. Изомерия 3.1. Cтруктурная изомерия 3.1.1. Изомерия положения заместителей CH3 CH2 CH2 CH2 Br CH3 CH2 CH CH3 Br 1-бромбутан 2-бромбутан 3.1.2. Изомерия углеродного скелета CH3 CH3 CH2 CH2 CH2 Cl 1-хлорбутан CH3 CH CH2 Cl 2-метил-1-хлорпропан • 3.2. Пространственная изомерия Cl H C H Cl Cl C C Cl транс-1,2-дихлорэтен H C H цис-1,2-дихлорэтен • 4. Физические и биологические свойства 200 180 t кип, oC R-I 157 150 130 102.5 100 72.8 129 101 71 154 R-Br 134 R-Cl 107 78 42.5 50 38.4 4.5 46.5 12.2 0 -23.7 n -50 0 1 2 3 4 5 6 7 Рис. 1. Зависимость температуры кипения алкилгалогенидов от количества атомов углерода в цепи для хлор-, бром-, йодалканов (С1-С6). CH3Cl t кип. oC -23,7 CHCl3 CHCl3 40 61,2 CCl4 76,8 Галогенопроизводные являются гидрофобными веществами: они плохо растворяются в воде и хорошо растворяются в неполярных гидрофобных растворителях. Многие галогенопроизводные растворители: хлороформ, четырёххлористый углерод используются хлористый используются масел, жиров и эфирных масел. для как хорошие метилен, растворения F Cl фторотан F C C H F 1,1,1-трифтор-2-бром-2-хлорэтан Br Cl Cl Cl C Cl C H ДДТ – мощный инсектицид Cl Химические свойства галогеноуглеводородов • Реакционная способность галогенопроизводных определяется характером связи углерод-галоген и структурой молекулы. • Природа галогена обусловливает полярность, поляризуемость и прочность связи углерод–галоген, что, в конечном счете, определяет реакционную способность конкретного галогеноуглеводорода. Галогенопроизводные углеводородов 5. Химические свойства Характеристика связи C-Hal F(4,0) > Сl(3,0) > Вг(2,8) > I(2,5); Сsp3(2,5) Связь Энергия, кДж/моль Длина, нм С—F 448 0.142 C—Cl 326 0.177 C—Br 285 0.191 C—I 213 0.213 C—H 414 0.112 С—C 347 0.154 16 Галогенопроизводные углеводородов Химические свойства Характеристика связи C-Hal Прочность связи углерод– галоген уменьшается при переходе от фтора к хлору, брому и иоду; С—I > С—Вr > C—CI > C—F Следовательно, наименее реакционноспособными являются фторопроизводные, а наиболее реакционноспособными – иодопроизводные углеводородов. ''+ < '+ < + 17 • В целом наличие электроотрицательного атома галогена, проявляющего –I-эффект, приводит к перераспределению электронной плотности в молекуле и возникновению двух реакционных центров: ''+ '+ R C Отщепление Н+ (СН-кислотный центр) H C + > '+ > '' X Взаимодействие с нуклеофилом (электрофильный центр) Из этого следует, что к реакциям нуклеофильного замещения SN по электрофильному центру под действием нуклеофильных реагентов. 2. Элиминирования Е с участием СН-кислотного центра. 3. Реакции восстановления (по полярной связи С-Х возможны реакции с активными металлами, а повышенная степень окисления атома углерода при галогене допускает). 1. Галогеноуглеводороды способны Нуклеофильное замещение в галогеналканах • Реакции замещения галогена в галогеналканах протекают под действием нуклеофильных реагентов (Nu:) H R C H X H субстрат + Nu: C R H нуклеофил Nu + X: уходящая группа Нуклеофилом называется частица (анион или молекула), имеющая на внешнем электронном уровне неподеленную пару электронов и способная предоставить эту пару для образования связи любому элементу, отличному от водорода (частица, отдающая электронную пару атому водорода, считается основанием). Легкость протекания реакции нуклеофильного замещения обусловлена относительной стабильностью уходящей группы. Реакция осуществляется в том случае, если уходящая группа устойчивее вступающего нуклеофила. • Атака нуклеофилом электрофильного атома углерода приводит к гетеролитическому разрыву связи углеродгалоген и замещению галогена. • Галоген в данном случае является хорошо уходящей группой и отщепляется в виде аниона. • Хорошая» уходящая группа – это слабое основание (например Н2О), «плохая» уходящая группа – сильное основание (например ОН - ). • Соединения, содержащие «хорошие» уходящие группы, легче вступают в реакции нуклеофильного замещения, чем соединения с «плохими» уходящими группами. • Ряд увеличения основности уходящих групп: HSO4 < CH3SO3 < CH3 SO3 < I < Br < H2O < Cl < F В ряду галогенид-ионов наиболее стабилен иодид-ион, затем бромид- и хлорид-ионы, наименее стабилен фторид-ион, то есть реакционная способность галогеналканов уменьшается в ряду: С–I > С–Br > С–Cl >> С–F • 5. Химические свойства • 5.1. Реакции нуклеофильного замещения + NaI -NaBr KOH, H2O -KBr CH3 CH2 Br CH3ONa -NaBr KSH -KBr NH3 CH3 CH2 I этилйодид рeакция Финкeльштeйна CH3 CH2 OH этанол CH3 CH2 O CH3 мeтилэтиловый эфир рeакция Вильямсона CH3 CH2 SH этантиол -NH4Br CH3 CH2 NH2 этиламин рeакция Гофмана KCN -KBr CH3 CH2 CN рeакция Кольбe AgNO2 -AgBr пропионитрил CH3 CH2 NO2 нитроэтан рeакция Мeйeра Галогенпроизводные углеводородов Химические свойства Реакции нуклеофильного замещения Реакции, в результате которых в молекуле исходного соединения происходит замещение атома или группы атомов на другой нуклеофил, называют реакциями нуклеофильного замещения. Эти реакции обозначают SN. (от англ. substitution nucleophilic). 22 Галогенпроизводные углеводородов Химические свойства Реакции нуклеофильного замещения Взаимодействие галогеналканов с водными растворами щелочей CH3CH2Br + KOH бромэтан CH3CH2OH + KBr этанол 23 Галогенпроизводные углеводородов Химические свойства Реакции нуклеофильного замещения (SN2 и SN1) Взаимодействие галогеналканов с водными растворами щелочей, Реакция нуклеофильного замещения S N 2 Нуклеофил CH3 - HO Уходящая группа СН3-СН2-Br + NaOH→ СН3-СН2-OH + Na Br + CH2 Механизм SN 2 характерен только для первичных и вторичных атомов углерода Br + бромэтан - HO CH3 CH3 - CH2 Br переходное состояние HO CH2 + Br- этанол 24 • Кинетика реакции. Установлено, что в данном случае скорость реакции зависит как от концентрации галогеналкана, так и от концентрации щелочи и подчиняется уравнению второго порядка: v = k[CH3-СН2-Br][OH-] Следовательно, в лимитирующей стадии участвуют две частицы: гидроксид–ион и этилбромид. Реакция является одностадийным синхронным процессом и заключается в постепенном переходе от исходного вещества к конечному. При этом одновременно образуются новые связи и разрываются старые: Энергетический профиль реакции SN2 представлен на диаграмме HO E _ HO + C Br C =/ Br Е акт. HO C координата реакции _ + Br • Механизм реакций нуклеофильного замещения В случае вторичных и первичных алкилгалогенидов, как правило, реакция идёт как бимолекулярное нуклеофильное замещение SN2: В случае SN2 реакций скорость реакции зависит от концентраций нуклеофила и субстрата реакция 2-го порядка поэтому SN2 : v = k [S] [Nu] - 2 Реакции нуклеофильного замещения Бимолекулярное нуклеофильное замещение (SN2) RX + Nu- E RNu + X- переходное состояние скорость реакции V = k[RX][Nu-] обращение конфигурации * NaI * ацетон I S-изомер Cl R-изомер Nu- + C X Nu X Nu -X- переходное состояние Стереохимия процесса. Гидроксид–ион атакует атом углерода, несущий частичный положительный заряд, со стороны, противоположной атому брома. Образование связи с нуклеофилом происходит одновременно с разрывом связи между атомом углерода и уходящим галогенид-ионом. H H HO C CH3 Br В переходном комплексе три связи атома углерода располагаются в одной плоскости, а возникающая связь с нуклеофилом и разрывающаяся связь с уходящей группой направлены перпендикулярно этой плоскости, то есть происходит обращение конфигурации (Вальденовское обращение). Это особенно важно, когда реакционным центром в субстрате служит асимметрический атом глерода Галогенпроизводные углеводородов Химические свойства Реакции нуклеофильного замещения Скорость реакции нуклеофильного замещения зависит от следующих факторов: - нуклеофильной реакционной способности реагента; - основности нуклеофильного реагента; - концентрации реагента; - величины положительного заряда на атакуемом атоме углерода в субстрате; - энергии связи и характера уходящей группы; -строения радикалов, связанных с атакуемым атомом углерода; - природы растворителя. 30 Факторы, влияющие на скорость реакции Таким образом, протеканию замещения по бимолекулярному механизму (SN2) благоприятствуют: 1. Строение радикала, обеспечивающее беспрепятственный подход нуклеофила к реакционному центру, то есть скорость реакций SN2 зависит от строения радикала и уменьшается в ряду: СН3 > первичный > вторичный > третичный; 2. Проведение реакции в неполярном и полярных апротонных растворителях. (Протеканию реакции по механизму SN2 способствуют неполярные (гексан) и диполярные апротонные растворители, например ацетон ); 3. Использование сильного нуклеофила. В полярных апротонных растворителях по нуклеофильности они располагаются в следующий ряд: I– < Br– < Cl– < F– 3 Галогенпроизводные углеводородов Химические свойства Нуклеофильная реакционная способность реагента Под нуклеофильной реакционной способностью (нуклеофильной силой) принято понимать способность реагента (аниона или нейтральной молекулы) образовывать за счет неподеленной пары p-электронов одного из входящих в него атомов ковалентную связь с имеющим дефицит электронной плотности атомом углерода в органической молекуле (субстрате). 32 Галогенпроизводные углеводородов Химические свойства Нуклеофильная реакционная способность реагента –CH 3 NH3 > H2O > HF –NH 2 –OH > NH3 > –NH2 > –OH > F– > H2O F– > HF I– > Br– > Cl– > F– CH3O– > H—O– CH3NH2 > H—NH2 33 Галогенпроизводные углеводородов Химические свойства Основность нуклеофильных реагентов – это способность присоединять протон. Она располагается в следующий ряд. I– < Br– < Cl– < F– 34 Механизм – SN1 • В случае третичных и вторичных алкилгалогенидов нуклеофильное замещение механизму – SN1: CH3 CH3 C Cl + KOH идёт по CH3 H2O CH3 C OH + KCl CH3 CH3 1. CH3 CH3 диссоциация + CH3 C CH3 C Cl •ассоциация CH3 CH3 C + + Cl CH3 CH3 S -субстрат 2. диссоциативному + OH- CH3 карбокатион нуклеофил CH3 CH3 C OH CH3 продукт v = k [S] – скорость реакции зависит только от концентрации субстрата, реакция первого порядка. поэтому SN1 • Реализации замещения по мономолекулярному механизму (SN1) способствуют: • • • увеличение степени замещенности реакционного центра алкильными радикалами, (увеличение степени замещенности – реакционного центра алкильными радикалами повышает устойчивость карбокатиона и облегчает протекание реакции по механизму SN1) , то есть, скорость SN1–реакций алкильных производных следует порядку: третичный > вторичный > первичный > СН3.; • • -использование сильноионизирующего растворителя • (Растворитель облегчает поляризацию связи углерод-галоген, стабилизирует переходное состояние и сольватирует уходящий анион, молекулы таких растворителей обычно содержат атомы водорода, способные образовывать водородные связи, например, вода, спирты, карбоновые кислоты, аммиак ); • • -применение слабого нуклеофила. • по нуклеофильности в ионизирующих располагаются в следующий ряд: протонных растворителях они • I– > Br– > Cl– > F– • Реакции нуклеофильного замещения могут конкурировать с реакциями элиминирования (Е) – отщепления галогеноводорода. Реакции элиминирования • Элиминирование (отщепление) может классифицироваться как -, - или - элиминирование. • H Cl C OHCl Cl CH3 H H3C C C CH3 H _ :CCl3 + H2O _ OH Cl Br CH2 CH2 CH2 Br H H3 C C H3 C Zn _ .. CCl2 + H2O + Cl -элиминирование _ + H2O + Cl -элиминирование C CH3 + 2 NaBr -элиминирование Наиболее распространенным типом реакций отщепления является -элиминирование Так как в процессе реакции от молекулы галогеналкана отщепляются атом водорода и атом галогена, такие реакции называются дегидрогалогенированием. • 5.2. Реакции элиминирования (отщепления) – дегидрогалогенирования KOH, спирт, t CH2 CH2 H Cl -HCl H2C CH2 NB! Если проводить эту реакцию в воде, а не в спирте, то основным продуктом будет спирт, а не алкен и идет по механизму SN • Реакции дегидрогалогенирования идут в соответствии с правилом Зайцева: Отщепление атома водорода в реакциях отщепления, происходит от наименее гидрогенизированного атома углерода. H2C HC H H2C H CH CH3 KOH, C2H5OH -HBr H3C HC 80% Br H CH CH CH3 Br H CH CH3 KOH, C2H5OH -HBr H2C CH CH2 CH3 20% • Механизмы реакций элиминирования Механизм E1 Мономолекулярное элиминирование B: H R C R C H R R C R C + -ClR Cl субстрат R R R карбокатион R -BH+ C C R R продукт v = k [S] –скорость реакции зависит только от концентрации субстрата, Е1 третичных реакция первого порядка, поэтому для и вторичных галогеналканов с объемными заместителями у реакционного центра, часто конкурирует с SN1-реакциями и подчиняется тем же закономерностям. реализуется • Механизм элиминирования Е1 включает две стадии: отщепление галогена с образованием карбкатиона и отщепление протона от атома углерода (Сβ), соседнего с катионным центром (Сα): 1. CH3 CH3 C Br медленно CH3 CH3 2. CH3 C CH3 CH3 CH3 C + Br CH3 C2H5O CH2 CH3 C + C2H5OH CH3 • Механизм E2 B: R H R C C R -BH+ R R R Cl -Cl- C C R R В случае реакций элиминирования Е скорость реакции зависит от концентраций 2-х компонентов; В: и субстрата, поэтому реакция 2-го порядка Е2 : v = k [В: ] [S] • Бимолекулярное элиминирование (Е2) характерно для первичных и вторичных галогеналканов с небольшими по объему заместителями у реакционного центра.CH CH CH + KOH C2H5OH CH CH CH + KBr + H O 3 3 2 3 2 Br • Реакция Е2 часто конкурирует с SN2 и представляет одностадийный согласованный собой процесс βэлиминирования, протекающий через переходное состояние, в котором разрыв связей Сα-Х и Сβ-Н и образование -связи происходят одновременно. = C2H5O H CH2 CH Br / CH3 CH3 C2H5OH + CH2 CH CH3 + Br • C2H5O + CH3 CH Br Реакция Е2 подчиняется правилу Зайцева: протон отщепляется преимущественно от наименее гидрогенизированного Сβ-атома: _ CH3 CH CH2 CH3 Br C2H5O CH3 CH CH CH3 бутен-2 (81%) + HBr CH2 CH CH2 CH3 + HBr бутен-1 (19%) Галогенпроизводные углеводородов Химические свойства Реакции ароматических галогенопроизводных OH Cl KOH 300°C, 150 атм KCl Cl 44 • Арилгалогениды не взаимодействуют с нуклеофильными реагентами ни по механизму SN2, ни по механизму SN1. • В первом случае ароматическое кольцо затрудняет атаку с тыла и препятствует образованию переходного комплекса. • Во втором случае, в качестве интермедиата должен образовываться нестабильный фенилкатион, в котором вакантная sp2-гибридная орбиталь расположена перпендикулярно рорбиталям кольца, в связи с чем невозможна делокализация положительного заряда с участием π-системы. • Способность к реакциям нуклеофильного замещения возрастает, если в орто- и/или параположениях к галогену находится сильная электроноакцепторная группа, чаще всего нитрогруппа. • Это обусловлено тем, что на атоме углерода, связанном с атомом галогена, увеличивается положительный заряд, и атом углерода легко взаимодействует с нуклеофильными агентами с вытеснением галогена. Cl OH Cl OH • + OH NO2 160 °C + Cl H2O NO2 анионный -комплекс, (комплекс Мейзенгеймера) NO2 • 5.3. Взаимодействие с металлами • 5.3.1. При взаимодействии алкилгалогенидов с щелочными металлами идёт реакция Вюрца: CH3 Br + Br CH3 + 2Na CH3 CH3 + 2NaBr Из металлоорганических соединений наибольшее практическое значение имеют магнийорганические. CH3 CH2 Br + Mg эфир CH3 CH2 Mg Br Mg-органические соединения – реактивы Гриньяра (Гриньяр, Нобелевская премия, 1912) C2H5Cl + 3 O2 2 CO2 + 2 H2O + HCl • Качественная реакция на галогенопроизводные называется пробой Бейльштейна: • При нагревании галогенопроизводного с медью, атомы галогена отщепляются с образованием летучих хлоридов меди, окрашивающий пламя в красивый зелёный или сине-зелёный цвет. Восстановление • При каталитическом гидрировании галогеналканов или действии на них водорода в момент выделения, а также иодоводорода происходит замещение атома галогена водородом: RX 2 [H] C2H5I + HI RH + HX C2H6 + I2 • 6. Получение галогенопроизводных • 6.1. Галогенирование алканов CH4 + метан h Cl2 хлор • 6.2. Гидрогалогенирование CH3Cl + хлорметан хлороводород HCl алкенов Cl H2C CH пропен CH3 + HCl H3C CH CH3 2-хлорпропан H C C H HCl HC CH2 Cl винилхлорид H2C CH C CH + HCl H2C CH C Cl хлоропрен CH2 • 6.3. Замещение гидроксигруппы спиртов на галоген C2H5OH + HCl H2SO4 C2H5Cl + H2O В лабораторной практике чаще применяются методы замещения гидроксильной группы при действии на спирты PCl5, PCl3 и SOCl2: 2 R-OH + PCl3 R-OH + PCl5 2 R-OH + PI3 2 R-OH + SOCl2 2 RCl + HPO 2 + HCl RCl + POCl3 + HCl 2 RI + HPO 2 + HI 2 RCl + SO 2 + H2O •ВЫВОДЫ Галогенопроизводными называются производные углеводородов, в которых один или несколько атомов водорода заменены атомами галогена. CH3 CH2 Cl CH3 CH2 CH2 CH2 Br H2C CH Cl этилхлорид бутилбромид винилхлорид (ИЮПАК: хлорэтан 1-бромбутан хлорэтен) Реакционная способность галогенопроизводных определяется характером связи углерод-галоген и структурой молекулы. Природа галогена обусловливает полярность, поляризуемость и прочность связи углерод–галоген, что, в конечном счете, определяет реакционную способность конкретного галогеноуглеводорода. Из этого следует, что 1. Галогеноуглеводороды способны к замещения SN реакциям нуклеофильного по электрофильному нуклеофильных реагентов. центру под действием 2. Элиминирования 3. Е с участием СН-кислотного центра. Реакции восстановления (по полярной связи С-Х возможны реакции с активными металлами, а повышенная степень окисления атома углерода при галогене допускает). Галогенпроизводные углеводородов Химические свойства Реакции нуклеофильного замещения (SN2 и SN1) Взаимодействие галогеналканов с водными растворами щелочей Реакция нуклеофильного замещения S N 2 Нуклеофил СН3-СН2-Br + NaOH→ СН3-СН2-OH + Na Br Механизм SN 2 характерен только для первичных и вторичных атомов углерода CH3 - HO + CH2 Br + бромэтан - HO CH3 CH3 - CH2 Br переходное состояние Уходящая группа HO CH2 + Br- этанол 56 Факторы, влияющие на скорость реакции Таким образом, протеканию замещения по бимолекулярному механизму (SN2) благоприятствуют: 1. Строение радикала, обеспечивающее беспрепятственный подход нуклеофила к реакционному центру, то есть скорость реакций SN2 зависит от строения радикала и уменьшается в ряду: СН3 > первичный > вторичный > третичный; 2. Проведение реакции в неполярном и полярных апротонных растворителях. (Протеканию реакции по механизму SN2 способствуют неполярные (гексан) и диполярные апротонные растворители, например ацетон ); 3. Использование сильного нуклеофила. В полярных апротонных растворителях по нуклеофильности они располагаются в следующий ряд: I– < Br– < Cl– < F– 3 Механизм – SN1 • В случае третичных и вторичных алкилгалогенидов нуклеофильное замещение механизму – SN1: CH3 CH3 C Cl + KOH идёт по диссоциативному CH3 H2O CH3 C OH + KCl CH3 CH3 CH3 диссоциация + CH3 C CH3 C Cl CH3 •ассоциация CH3 CH3 C + Cl CH3 CH3 S -субстрат + + OH- CH3 карбокатион нуклеофил CH3 CH3 C OH CH3 продукт v = k [S] – скорость реакции зависит только от концентрации субстрата, реакция первого порядка. поэтому SN1 • Реализации замещения по мономолекулярному механизму (SN1) способствуют: • • • увеличение степени замещенности реакционного центра алкильными радикалами, (увеличение степени замещенности – реакционного центра алкильными радикалами повышает устойчивость карбокатиона и облегчает протекание реакции по механизму SN1) , то есть, скорость SN1–реакций алкильных производных следует порядку: третичный > вторичный > первичный > СН3.; • • -использование сильноионизирующего растворителя • (Растворитель облегчает поляризацию связи углерод-галоген, стабилизирует переходное состояние и сольватирует уходящий анион, молекулы таких растворителей обычно содержат атомы водорода, способные образовывать водородные связи, например, вода, спирты, карбоновые кислоты, аммиак ); • • -применение слабого нуклеофила. • по нуклеофильности в ионизирующих располагаются в следующий ряд: протонных растворителях они • I– > Br– > Cl– > F– • Реакции нуклеофильного замещения могут конкурировать с реакциями элиминирования (Е) – отщепления галогеноводорода. • Арилгалогениды не взаимодействуют с нуклеофильными реагентами ни по механизму SN2, ни по механизму SN1. • В первом случае ароматическое кольцо затрудняет атаку с тыла и препятствует образованию переходного комплекса. • Во втором случае, в качестве интермедиата должен образовываться нестабильный фенилкатион, в котором вакантная sp2-гибридная орбиталь расположена перпендикулярно рорбиталям кольца, в связи с чем невозможна делокализация положительного заряда с участием π-системы. • 5.2. Реакции элиминирования (отщепления) – дегидрогалогенирования KOH, спирт, t CH2 CH2 H Cl -HCl H2C CH2 NB! Если проводить эту реакцию в воде, а не в спирте, то основным продуктом будет спирт, а не алкен и идет по механизму SN • Реакции дегидрогалогенирования идут в соответствии с правилом Зайцева: Отщепление атома водорода в реакциях отщепления, происходит от наименее гидрогенизированного атома углерода. H2C HC H H2C H CH CH3 KOH, C2H5OH -HBr H3C HC 80% Br H CH CH CH3 Br H CH CH3 KOH, C2H5OH -HBr H2C CH CH2 CH3 20% • 5.3. Взаимодействие с металлами • 5.3.1. При взаимодействии алкилгалогенидов с щелочными металлами идёт реакция Вюрца: CH3 Br + Br CH3 + 2Na CH3 CH3 + 2NaBr Из металлоорганических соединений наибольшее практическое значение имеют магнийорганические. CH3 CH2 Br + Mg эфир CH3 CH2 Mg Br Mg-органические соединения – реактивы Гриньяра (Гриньяр, Нобелевская премия, 1912) Восстановление • При каталитическом гидрировании галогеналканов или действии на них водорода в момент выделения, а также иодоводорода происходит замещение атома галогена водородом: RX 2 [H] C2H5I + HI RH + HX C2H6 + I2 • 6. Получение галогенопроизводных • 6.1. Галогенирование алканов CH4 + метан h Cl2 хлор CH3Cl + хлорметан хлороводород HCl • 6.2. Гидрогалогенирование Cl H2C CH пропен CH3 + HCl H3C CH CH3 2-хлорпропан