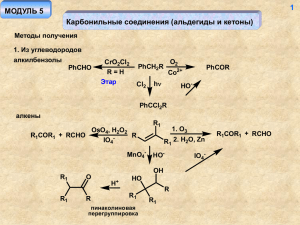
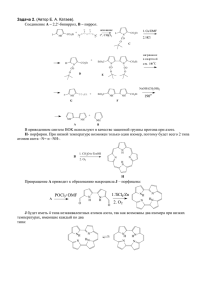
02. Карбоновые кислоты.Гетерофункцыональные производные
реклама
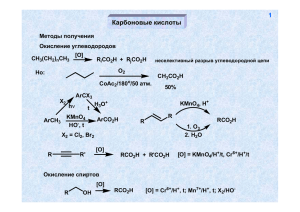
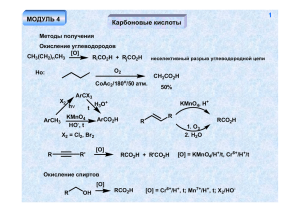
лектор: канд. биол. наук, доцент Лихацкий П.Г. 37 Карбоновые кислоты Получение 1. Окисление углеводородов X2 ArCH3 ArCX3 h t H3O+ KMnO4 HO-, t X2 = Cl2, Br2 ArCO2H KMnO4, H+ R RCO2H R 1. O3 2. H2O 2. Окисление спиртов [O] R RCO2H OH [O] = Cr6+/H+, t; Mn7+/H+, t; X2/HO- 3. Из алкилгалогенидов RX CNSN2 RCN H3O+ RCO2H 38 4. Окисление альдегидов [O] [O] = Cr6+/H+, t; Mn7+/H+, t; X2/HO-, O2 (воздух); Ag+ (реактив Толленса, реакция "серебряного зеркала"); R'CO3H (реакция Байера-Виллигера) RCO2 H RCHO 5. Из кетонов Окисление происходит с разрушением скелета O MnO4-, H+ R1 H2C CH2R2 t R1CH2CO2H + R1CO2H + R2CH2CO2H + R2CO2H R'CO3H O R1H2C O RCOCH3 CH2R2 X2 HO- H3O+ RCO2- R1CH2CO2H + R2CH2OH + X = Cl, Br CX3H галоформный распад 39 Перегруппировка Фаворского O O Br2 R R R + R HO O - R R -H2O H -BrBr Br O HO R R HO - O- CO2- CO2H R R R R R R 6. Использование металлоорганических соединений RMgX 1. CO2 2. H3O+ RCO2H Синтез муравьиной кислоты (в промышленности) NaOH CO p, t HCO2Na H3O+ HCO2H 40 Свойства карбоновых кислот Тривиальные названия некоторых кислот RCO2H: R = Н (муравьиная), CH3 (уксусная), C2H5 (пропионовая), C3H7 (масляная), C4H9 (валериановая), C5H11 (капроновая), C15H31 (пальмитиновая), C16H33 (маргариновая), C17H35 (стеариновая) Высокая растворимость в воде, высокая температура кипения H O O R R O 1. Кислотность R ± O O O O H+ R OH H R O O делокализация заряда Акцепторные заместители R повышают устойчивость аниона (и кислотность соответствующей кислоты), доноры - снижают RCO2H R рК CH3 C6H5 CF3 H 3.75 4.75 4.2 0.2 41 Сила кислоты Х-C6H2CO2H X pK 2-CO2H 2-OH 4-NO2 4-CO2H 3-CO2H 2-CH3 H 3 (4)-CH3 4-OCH3 4-NH2 3.62 3.9 4.49 2.95 3.54 4.2 4.3 2.98 3.4 4.92 Отсутствие прямого сопряжения заряженных атомов кислорода с заместителем в ароматическом кольце R R O O- O- O "Косвенное" влияние мезомерных заместителей X X донор CO2- CO2- CO2- CO2O O2N N акцептор O 42 Влияние орто-заместителя O O O -H+ O O OCH3 H O H O H более устойчивая ВМВС Производные карбоновых кислот Образование солей PhOH NaOH O R OH NaHCO3 PhONa RCO2Na нарушение планарности (сопряжения) 43 Образование сложных эфиров (реакция этерификации) R'OH H+ R R R OH R OH R O R' OH O R' R OH2 ± H+ O O OH R R'OH H2O R OH R O OH H+ O O H+ R' R' R' H R' OH ± OH OH OH OH H+ ± O RCO2R' + H2O ± RCO2H OH Все стадии процесса обратимы. Положение равновесия определяется количеством воды - при проведении этерификации воду необходимо удалять. В избытке воды в кислой среде происходит гидролиз эфира по той же самой схеме. Образование эфиров при взаимодействии карбоновых кислот со спиртами в условиях щелочного катализа невозможно вследствие того, что первая стадия процесса – депротонирование карбоксильной группы, а образующийся карбоксилат-анион является очень слабым электрофилом. O O HO- R' R R' R O реакция необратима - HO- O OH H - R'OH H HORCO2H -H2O O Другие способы получения сложных эфиров: RCO2H SOCl2 R (PCl5, PCl3 Cl Cl O O Cl R R'OH O R O O R' R' -Cl- R O O RCO2- R'X SN2 R' R O OH + R' -H RCO2- 44 45 Синтез амидов карбоновых кислот R'NH2 RCO2 H RCO2- R'NH3 t RCONHR' реакция происходит в жестких условиях нет хорошей уходящей группы! аммонийная соль O R O R'NH2 -H+ R NHR' X - RCONHR' -X X если Х - хорошая уходящая группа (Cl, в некоторой степени OR), реакция происходит легко Метод, используемый в пептидном синтезе RCO2H R'NH2 ДЦК RCONHR' реакция происходит быстро и в мягких условиях N C N дициклогексилкарбодиимид (ДЦК) R1 N C N R1 O RCO2H + R1 O R N HN C N R1 R O N R1 O R1 R'NH2 -H+ O RCONHR' + N R1 H+ R'HN HN 46 R1 N N H H дициклогексилмочевина очень хорошая уходящая группа Гидролиз нитрилов в кислой среде RCN H3O+ R C OH NH H2O -H+ R C NH RCONH2 C R NH H+ OH OH OH H2O R + R R NH2 NH2 OH R 47 -H OH R NH2 OH NH3 OH OH R в щелочной среде + HOR C N H2O OH RCO2H -H+ OH OH N H2O -HO- RCONH2 NH O R OH H+ OH NH2 H H O - NH3 -HO- HORCO2H H2O RCO2- Обратная реакция (дегидратация амидов) RCONH2 SOCl2 или P2O5 t RCN HO- - NH3 48 O O R R NH NH повышенная NH-кислотность ± O H+ O R R NH2 NH2 пониженная основность нитрозирование O O R' R N H NaNO2 H3O+ R' R N-нитрозоамиды канцерогены N NO O O NaNO2 R NH2 H3O+ H2O R N N -N2, -H+ RCO2H очень хорошая уходящая группа легко протекающий гидролиз 49 Ангидриды карбоновых кислот RCO2Na O RCOCl R O SOCl2 (0.5 моль) RCO2H P2O5 RCO2H не всегда возможно R O Взаимодействие производных карбоновых кислот с металлоорганическими соединениями RCO2H R'MgX -R'H O RCO2- 1. R'MgX 2. H3O+ R R' O RCN 1. R'MgX 2. H3O+ O R R 1. R'2CuLi R' + 2. H3O R' O 2+ RCOCl 1. R'MgX /Cd 2. H3O+ R R' 50 R RCO2R" 1. R'MgX 2. H3O+ R' OH R' RCO2NH2 R'MgX -R'H RCO2NH Восстановление производных карбоновых кислот RCO2H [H] RCH2 OH [H] = LiAlH4, H2/катализатор - в жестких условиях NaBH4 - нет [H] RCH2OH + R'OH [H] = LiAlH4, Na/EtOH H2/катализатор - в жестких условиях NaBH4 - нет LiAlH4 RCO2NH2 RCH2NH2 RCO2R' RCOCl [H] RCHO [H] = LiAlH(OR')3, H2 / Pd/BaSO4 51 Общая схема реакции производных карбоновых кислот с нуклеофилами (присоединение-отщепление) O- O Nu- R X R O Nu R -X- Nu X Реакция происходит тем легче, чем лучше уходящая группа. Ряд активности производных карбоновых кислот: галогенангидриды (X = I, Br, Cl) > ангидриды (X = OCOR) > эфиры (X = OR') >> амиды (X = RNHR') >> кислоты (X = OH, депротонирование!) Реакции по альфа-углеродному атому Карбонильные соединения O R нехарактерно, кроме Х = галоген O HOR X X R O R OH H+ Производные карбоновых кислот OH O H+ O X B-H+ O O X X резонансная стабилизация малозначима (мезомерное влияние гетероатома) 52 Реакция Геля-Фольгарда-Зелинского RCH2CO2H Br2 RCHBrCOBr или RCHBrCO2H P Br2 + P PBr3 PBr3 RCH2CO2H -P(OH)3 HO HO Br Br Br O + Br R -H Br RCH2COBr R Br RCH2CO2H R Br -Br- RCHBrCO2H -RCH2COBr При использовании 1/3 моля красного фосфора продуктом реакции является галогензамещенный галогенангидрид, в случае каталитических количеств фосфора – бромзамещённая кислота 53 Конденсация Кляйзена Более низкая СН-кислотность сложных эфиров по сравнению с карбонильными соединениями требует применения более сильного основания - EtO- (NaNH2, NaH, Na) - O O O EtO O OEt RCH2CO2Et EtO R R R метиленовая компонента R карбонильная компонента O O O O O O -EtO- EtO EtO EtOEtO -EtOH R R EtO EtO R R R R все стадии процесса обратимы, равновесие сдвигается в сторону образования продукта за счёт солеобразования на последней стадии 54 Перекрестная конденсация а) эфир + эфир O - RCO2Et + R'CH2CO2Et EtO CO2 Et R б) эфир + кетон R' O O R + R'CH2CO2Et EtO возможно при отсутствии в молекуле карбонильной компоненты атомов водорода у -углеродного атома в составе R O R' R метиленовая карбонильная компонента компонента СН-кислотность кетона заметно выше, чем у сложного эфира (резонансная стабилизация). Поэтому, применение достаточно сильного основания позволяет проводить реакцию таким образом, чтобы кетон преимущественно выступал в качестве метиленовой компоненты. в) эфир + альдегид Такую перекрестную конденсацию осуществить, как правило, не удается – альдегид и более сильная СН-кислота, и значительно более активная карбонильная компонента, чем сложный эфир. Будет происходить конденсация альдегида самого с собой. PhCHO + CH3CO2Et NaH Ph 55 CO2Et такая конденсация в принципе возможна, поскольку альдегид не может быть метиленовой компонентой, а очень сильное основание (и очень слабый нуклеофил!) NaH - может создать большую концентрацию аниона из сложного эфира. Использование в качестве основания более слабого основания и более сильного нуклеофила – алкоголят-аниона приведет к протеканию другой конкурентной реакции –диспропорционированию альдегида (Канниццаро) Конденсация Дикмана Разновидность конденсации Кляйзена, приводящая к образованию циклических продуктов внутримолекулярная конденсация O CO2Et CO2Et OEt EtOO O OEt CO2Et CO2Et реакция подходит для синтеза 5- и 6-членных циклов CO2Et 56 межмолекулярная конденсация O CO2Et - EtO2C OEt EtO 2 CO2Et EtO2 C EtO2C O OEt O OEt EtO2C CO2Et O EtO2C CO2Et EtO2C O OEt O EtO EtO2C O CO2Et O CO2Et EtO CO2 Et Конденсация Перкина O RCHO + O O O H основание AcONa t O R R O O O O O O O R O O R 57 R Ac2O O O O O O -AcO- O O O Ac O AcO- H O R O O O Ac E2 -AcOH -AcO- O R H2 O R CO2H O Ac реакция возможно только для R, не содержащих атомов водорода у -углеродного атома (например, Ph) Ацилоиновая конденсация O CO2Et Na n(H2C) CO2 Et эфир O OEt OEt n(H2C) n(H2C) OEt OEt O O -2OEt- O O Na n(H2C) H2O n(H2C) n(H2C) O O 58 OH ацилоин O реакция пригодна для получения макроциклов Применение бета-кетоэфиров в синтезе CH3CO2Et осуществить реакцию алкилирвания невозможно вследствие низкой СН-кислотности сложного эфира RX EtO- O - CO2Et EtO -EtOH ацетоуксусный эфир сильная СН-кислота O O CO2Et CO2Et RX SN2 резонансная + индуктивная стабилизация карбаниона O O CO2Et R 1. EtO2. R'X CO2Et R R' R, R' - алкил, Х - I, Br, Cl 59 кетонное расщепление O CO2Et O OH H3O+ t O R кетон O H O R' R R' R' -CO2 R' R R кислотное расщепление CO2Et R O O O - HO t R' CO2HO- R HO R' Таким образом: O кислота R R' CO2H -AcOH R R R O R' CO2- CO2H CH3CO2Et R R CO2H R' R' 60 R O H3O+ O H3O+ t O R O R - CO2Et t CO2Et 1. EtO CO2Et CO2Et 2.RX HO- CO2H t CO2H реакция конденсации обратима! O EtO R EtOCO2Et t O R CO2Et R CO2Et CO2Et CO2Et CO2Et R более устойчивый анион OEt O 1. EtO- - -EtO O O H3O+ t O 2.R'X R R' HO- R' EtO2C CO2Et CO2Et 61 R R R t R' R CO2H CO2H O R H3O+ t O O CO2Et EtO2C EtO2C EtO- 1. EtOCO2Et CO2Et O R O R R 2. RX O CO2Et HOt R CO2H CO2H 62 Дикарбоновые кислоты Производные угольной кислоты C COCl2 CO + Cl2 t фосген ROH O RNH2 O O ROH RO OR карбонат Cl CCl4 + SO3 OR Cl O RNH2 RHN NHR хлорформиат NHR мочевина O O ROH Cl RO NHR NHR уретан O CO2 + NH3 t P мочевина (карбамид) H2N H2O (медленно) NH2 O EtO- + CH3CO2Et EtO 63 CO2Et OEt CO2Et перекрестная конденсация Кляйзена, карбонат может выступать только в качестве карбонильной компоненты O O O CH2O H2N NH2 H2N N H O N H N N N H n мочевино-формальдегидные смолы n H N N H OH n O O O O NaNO2 CH3NH2 HCl H2N NH2 H2N N H H3O + HOH2N N NO CH2N2 64 «Настоящие» дикарбоновые кислоты CO2H CO2H CO2H CO2H CO2H Щавелевая CO2H Малоновая янтарная CO2H CO2H CO2H CO2H глутаровая Адипиновая Методы синтеза HCO2Na CO2Na t CO2H + H3 O CO2Na CH3CO2H Cl2 P ClCH2CO2H 1. NaOH 2. NaCN CO2H CN H3O+ CO2H CO2H CO2H H3O+ O + CH3CO2Et EtO OEt EtO- CO2Et CO2Et Br 65 CN CO2H + H 3O NaCN Br CN CO2H O O O2 V2O5 O H2 Pd/C O O O O OH или (CH2 )n n = 1,2 HNO3 (разб.) t (CH2 )n n(H2C) CO2H CO2H [O] (CH2 )n [O] = MnO4/H+, 1. O3; 2. H2O/H2O2 66 Свойства 1. Кислотность CO2H CO2H > CO2H > CO2H CO2H CO2H ~ ~ CO2H CO2H ~ ~ CO2H CO2H Причины: 1. индуктивный эффект карбоксильной группы. 2. Внутримолекулярная водородная связь, стабилизирующая анион. H O O H OO оксалат-анион O O OO малонат-анион легкость окисление щавелевой кислоты CO2H CO2H CO2Et CO2Et KMnO4 CO2 + H2O диэтилоксалат - сложный эфир, не имеющий атомов водорода у -углеродного атома - активная карбонильная компонента в перекрестных конденсациях Кляйзена 67 Дегидратация O C C C P2 O 5 t O CO2H ~ 100o -CO2 CO2H H O OH O Декарбоксилирование HO CH3CO2H O -CO2 CH3CO2H HO O O CO2H P2O5 t O CO2H CO2H CO2H P2O5 t O O n(H2C) CO2H P O 2 5 t CO2H O O O (CH2)n O Синтетические применения малонового (натрмалонового) эфира CO2H CO2Et EtOH H+ EtO2C EtONa Na+ CO2Et CO2H устойчивый анион индуктивное влияние двух акцепторных групп EtO2C CO2H R t R CO2H CO2H H3O+ CO2Et CO2Et CO2Et RX SN2 R CO2Et EtO- 1. 2. R'X CO2Et R R' CO2Et H3O+ t R CO2H R' R, R' = алкил CO2Et CO2Et ClCH2CO2Et EtO2C CO2Et CO2Et + CO2H H3O t CO2H 68 69 Br CO2Et CO2Et 0.5 M CO2Et CO2H H3O+ CO2Et t EtO2C Br CO2H CO2Et Br 0.5 M CO2Et Br EtONa (2 M) CO2Et CO2Et I2 CO2Et CO2Et R CO2Et I2 H3O+ t EtO2C CO2Et EtO2C CO2Et EtO2C CO2Et R R EtO2C CO2Et CO2H CO2H + H3O t CO2H H3O t R CO2H R CO2H + 70 Некоторые свойства ангидридов дикарбоновых кислот O O RO RO- O O O RO O O O O O NBr O моноэфир дикислоты t NH3 O NaOBr 0o NH O сукцинимид CO2H NaOBr HO-, t гидролиз CO2H NaOBr NH2 O р-ция Гофмана NH2 71 Ароматические кислоты CO2H CO2H O2 O2 Co2+ Co2+ фталевые кислоты толуиловые кислоты Br CO2H CONEt2 CO2H 1. Mg / эфир ДЭТА 2. CO2 3. H3O+ O CO2H O2 O V2O5 H3O+ CO2H O фталевая кислота: диэтилфталат (репеллент) O O 72 NH3 O CO2H NaOBr NH t t NH2 O O антраниловая кислота фталимид CO2H CO2H 1. KOH/400o 2. H3O+ HO2C CO2H терефталевая кислота CO2H HO2C H2N HO NH2 O O OH O O O HN NH кевлар n n O лавсан 73 Акцепторно-замещенные алкены (,b-ненасыщенные карбонильные соединения, кислоты и их производные) Синтез O O O NEt3 Br2 Br реакция Манниха CH2O + (CH3)2NH2Cl N N электрофил Cl O O O 1. CH3I CH2O (CH3)2NH2Cl N 2. Ag2O, HO3. t кротоновая конденсация 74 O O H+ Непредельные кислоты и их производные Br EtOCO2H t Br2 CO2H P O HCN HO CN H3O+ t CO2H CO2H акриловая кислота HCN + Cu CN NH3 H3O+ t CO2H O2 O HCN HO CN H3O+ t CO2H метакриловая кислота 75 Свойства (нуклеофильное присоединение) O O HO X X O Nu Nu- + X Nu X 1,2-присоединение + O O O Nu X Присоединению по Михаэлю – X Nu X 1,4-присоединение взаимодействие акцепторно-замещенных алкенов с карбанионами происходит как 1,4-присоединение! 76 O CO2- R O O HOt O CO2Et CO2Et R R O O H3O+ t O O R O O O HO- R t O R O O 77 O R' CO2Et R H3O O + t CO2H R CO2Et CO2Et 1. EtO- O 2. R'X O CO2Et R R' CO2Et R H3O O + CO2H R t CO2Et O 1. EtO- O 2. O R R O H3O+ R R EtO2C t HO2C CO2Et R O 78 EtOR' NO2 R' R' NO2 N очень устойчивый карбанион O R' HOR"CHO + R' O R" NO2 NO2 активированный к нуклеофильному присоединению алкен O O R' NO2 R NO2 R R' CO2Et R' R' R" O2N CO2Et CO2Et R' H3O+ O2N CO2Et R" t O2N CO2H R" 79 Таким образом: R" R" + R R"' R R"' R,R",R"' = CHO, COR1, CO2R1, CN, NO2 О непредельных кислотах CO2CH3 полиметилметакрилат (оргстекло) n CO2CH3 n полиакрилонитрил (орлон, нитрон) CN CN n CO2H полиакриловая кислота n CONH2 полиакриламид 80 стеарин OCOR маргарин H2 Ni OCOR' H3O H2 O HO- OCOR" олифа (Co, Pb, Mn) OH RCO2- + R'CO2- + R"CO2- + OH Na-соли - мыло OH глицериды эфиры насыщенных и ненасыщенных кислот кислоты насыщенные CH3(CH2)14CO2H пальмитиновая CH3(CH2)15CO2H маргариновая CH3(CH2)16CO2H стеариновая кислоты ненасыщенные H3C(H2C)7 (CH2)7CO2H олеиновая (CH2)7CO2H H3C(H2C)7 элаидиновая CH3(CH2)4CH=CHCH2CH=CH(CH2)7CO2H линолевая CH3(CH2CH=CH)3(CH2)7CO2H линоленовая OCOR OCOR' O - O P O 81 OCOR OCOR' O NH3 O кефалины (биологические мембраны, нервная ткань) - O P O N O лецитины (биологические мембраны)