Модуль 4
реклама
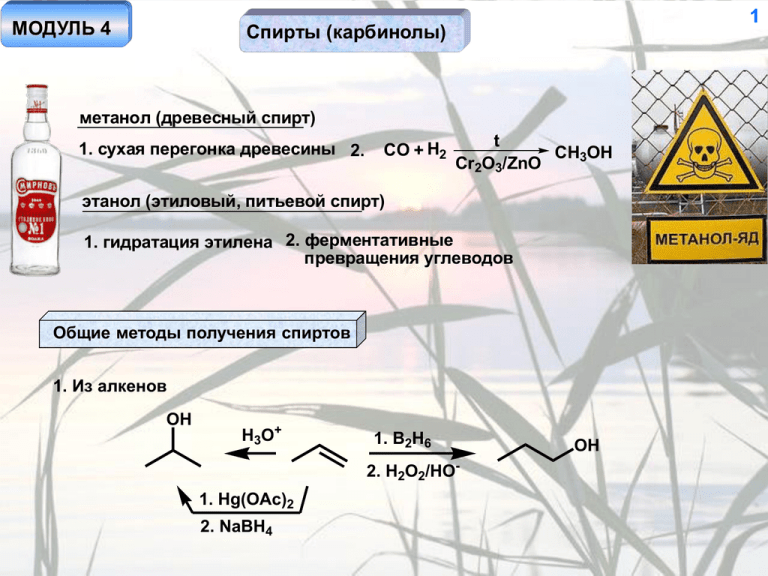
МОДУЛЬ 4 1 Спирты (карбинолы) метанол (древесный спирт) 1. сухая перегонка древесины 2. CO + H2 t CH3OH Cr2O3/ZnO этанол (этиловый, питьевой спирт) 1. гидратация этилена 2. ферментативные превращения углеводов Общие методы получения спиртов 1. Из алкенов OH H3O+ 1. B2H6 2. H2O2/HO- 1. Hg(OAc)2 2. NaBH4 OH 2 2. Из алкилгалогенидов RX HO- SN1 или SN2 ROH 3. С использованием металлоорганических соединений ROH R" O OH R O2 RMgX R" O R' R OH R' 3 4. Восстановление альдегидов и кетонов O R" R' (CH3)2CHOH HO [H] R' R" [H] = NaBH4, LiAlH4, Na/EtOH, H2/катализатор, p, t Al(OCH(CH3)2)3 O-i-Pr i-Pr-O O-i-Pr Al Al O H - (CH3)CO R' HO O-i-Pr (CH3)2CHOH O R' R" O R" -Al(OCH(CH3)2)3 R' R" реакция обратима - восстановление кетонов в спирты - Мейервейна-Пондорфа-Верлея, окисление спиртов в кетоны - Оппенауэра 5. Восстановление сложных эфиров RCO2Et LiAlH4 или Na/EtOH RCH2OH Свойства спиртов 4 1. Наличие подвижного протона – относительно высокая температура кипения, растворимость в воде, кислотность. RO- + H2O Положение равновесия определяется устойчивостью аниона. Алкил - донор по сравнению с протоном, поэтому гидроксиданион устойчивее алкоксид-аниона. Следовательно, вода более сильная кислота, чем спирты, а алкоксид-анионы более сильные основания, чем гидроксид-анион. ROH + HO- Mg (RO)2Mg ROH PX3 Na RONa SOCl2 RCl RX X = Cl, Br Образование сложных эфиров эфиры азотной кислоты - нитраты RONO2 эфиры азотистой RONO кислоты - нитриты H2SO4 HNO3 COCl2 (RO)2CO эфиры угольной кислоты - карбонаты NaNO2 ROH CS2 HOS O ксантогенаты R S - H3O+ R'COCl R'COOR сложные эфиры карбоновых кислот p-TsCl ROTs тозилаты Дегидратация OH H 5 + t Al2O3 300o Реакции окисления а. дегидрирование CuO, t RCH2OH -Cu RCHO Cu, t - H2 RCH2OH реакции пригодны только для простейших спиртов б. химическое окисление OH R Cr R' R' R O R R' альдегиды, кетоны. для альдегидов возможно переокисление в кислоты превращается в Cr3+ O Cr HO H H+ - HOCrO2- H H O 6+ O O сильный акцептор элиминирование Е2 относительно связи С-О RCHO H2O O OH Cr6+ OH HO аналогично H OH X X2 RCH2OH RCO2H Cr O R R 6 O O X2 -X- RCH2O- HO- R - X- RCHO -H2O H X = Cl, Br, I HOX OH H2O R RCHO OH O - X- HO X2 - -X H -H2O R RCO2H HO- EtOH I2 HO- H2O - -HO O O I2 H3C - H HO I3C I3C HCI3 иодоформ - H OH O OH H -HCO2H CI3 Аналогично спирты окисляются в карбонильные соединения: а. KMnO4 / H+ б. CrO3 / H2SO4 (окисление по Джонсу) в. CrO3 / пиридин / CH2Cl2 (окисление по Саррету, для веществ, чувствительных к кислотам). OH O MnO2 H2O PhCH2OH PhCHO Качественные реакции на спирты: спирт K2Cr2O7 - Cr3+ карбонильные соединения наблюдается изменение окраски с оранжевой на зеленую (реакция неспецифична) проба Лукаса спирт ZnCl2, HCl алкилгалогениды H2O наблюдается расслоение раствора, механизм SN1 - реакция происходит быстро в случае образования устойчивого катиона 7 8 Многоатомные спирты OH OH OH OH OH OH этиленгликоль OH OH OH OH OH OH глицерин сорбит Методы синтеза 1. Гидролиз дигалогенидов Cl Cl HO- OH OH HO OH HO пентаэритрит 9 2. Окисление алкенов OH O Cl Cl2 OH 3. Пинаконы O Ca(OH)2 MnO4OH Cl -H+ O O2 / Ag HOHCO2H H2O2 (или RCO3H) O O Mg / I2* OH OH O + OH OH H H3O+ бензол *или Al / Hg, Zn / Hg H3O+ димеризация H + пинакон в отсутствие органической фазы OH +e OH H+ OH H H H восстановление по Клеменсену 10 4. Из ацетилена Cu+ OH (CH2)4 OH H2 CH2O HO OH Ni 5. Реакция Принса O OCH2+ CH2O -H+ H+ O OH OH H3O+ -CH2O OH Синтез глицерина OH Cl Cl2 Cl Cl2 Cl o 300 Cl HO- HO OH OCOR1 OCOR2 OCOR3 11 OH H2O HO HO- + R1CO2- + R2CO2- + R3CO2- OH жиры мыло Синтез пентаэритрита OH CH3CHO CH2O HO HO- OH HO Свойства многоатомных спиртов Все реакции, описанные для одноатомных спиртов, характерны и для многоатомных (высокая растворимость в воде, высокая температура кипения, взаимодействие с щелочными металлами, образование сложных эфиров, реакции окисления) ONO2 ONO2 O2NO ONO2 ONO2 нитроглицерин ONO2 O2NO тетранитрат пентаэритрита 12 Пинаколиновая перегруппировка OH OH OH OH2 + H -H2O HO O HO HO -H+ более устойчивый катион Например: пинаколин OH OH2 ± H+ OH OH -H2O OH неустойчивый катион ± H+ OH2 OH OH -H+ CHO более устойчивый катион изомасляный альдегид OH -H2O устойчивый катион 13 Периодатное окисление OH O HIO4 O O I OH O O OH -HIO3 OsO4 CHO H2O2, HIO4 CHO Образование диоксаланов OH O + ± OH H+ O H2O O диоксалан O 14 Методы получения Простые эфиры Метод Вильямсона RONa + R'X ROR' SN2 или SN1 конкуренция с реакциями элиминирования! PhBr CH3I CH3ONa PhONa жесткие условия, ароматическое нуклеофильное замещение PhOCH3 происходит в мягких условиях CH3ONa OR Cl CH3 ONa CH3I RO NaBH4 HgOAc Из алкенов O ONa OR Hg(OAc)2 ROH ROH H+ HgOAc меркурониевый катион - невозможность перегруппировок карбокатион возможность перегруппировок 15 Из алкинов RONa OR t Простые виниловые эфиры не могут быть получены по методу Вильямсона OR ROH H+, Hg2+ Из спиртов H+ 2 ROH t ROR H - H+ H + OH H OH2 -H2O HO изомеризация! образование катиона - изомеризация + побочные продукты! H O O -H+ 16 OH O H+ диоксан (1,4-диоксан) OH O Свойства простых эфиров: Высокая инертность, низкая температура кипения, хорошая растворяющая способность Гидролиз ROR' HX t HX - очень сильная кислота, анион - хороший нуклеофил! X = Br, I R'OH + RX H+ H O R' SN1 R H O - X + R R' R'OH + R SN2 (реже) XRX R'OH + RX O HBr t Br -CH3OH SN1 OH 17 - Br è òî ëüêî òàê! PhOCH3 HBr t Ph H O PhOH + CH3Br CH3 Br S 2 N HBr O HBr t O H Br- S 2 N HO Br Br t Br Легкость гидролиза виниловых эфиров (образование очень устойчивых катионов на всех стадиях) H2O H+ OR H+ OR OR OH +H2O -H+ OR H OR OH -ROH OR H OH OH -H+ H+ O 18 Эпоксиды Синтез O HO RCO3H Cl2 Ca(OH)2 SN2 O -H+ Cl RCO3H O O RCO3H RCO3H стереоспецифичность реакции O RCO3H O O региоселективность процесса 19 Свойства Эпоксид – циклический простой эфир, содержащий атом кислорода в напряженном малом цикле. Вследствие этого, легко протекает раскрытие этого цикла при взаимодействии с нуклеофильными реагентами (с электрофильным катализом и без). В случае механизма SN2 направление атаки определяется стерической доступностью. O O Nu NuOH OH OH - HO O LiAlH4 OH RO OR - RMgX SN 2 OH R Nu Ýëåêòðî ô èëüí û é êàòàëèç H O OH SN1 NuOH Пример: 20 OH Nu- Nu SN2 региоселективный синтез моноэфиров гликолей O CH3O- OCH3 CH3OH OH OH OH H+ OCH3 Изомеризация алкенов через эпоксиды O RCO3H H H3C транс- O CH3 H H H3 C PPh3 конформация, необходимая для протекания элиминирования O H H3C PPh3 H CH3 -OPPh3 цис- CH3 H PPh3 21 Фенолы Методы получения OH 1. Щелочное плавление арилсульфокислот HOt ArSO3H 2. Из галогенбензолов ArO- H2O ArOH ô åí î ë HO-, Cu PhCl t PhOH 3. Кумольный способ O2 OOH H3O+ 2+ Co Ph Ph 4. Гидролиз солей арилдиазония ArNH2 NaNO2/H3O+ o 0 ArN2+ H3O+ t ArOH PhOH + CH3COCH3 22 Свойства фенолов 1. Повышенная кислотность (фенол - «карболовая кислота») OH O O O O -H+ делокализация заряда Акцепторные заместители (особенно в орто- и пара-положениях) повышают устойчивость фенолят-аниона (кислотность фенола), донорные – понижают. 2. Реакции с электрофильными реагентами E+ OH + E E+ возможные направления электрофильной атаки - неподеленная пара электронов атома кислорода (всегда в первую очередь), орто- и пара-положения кольца (гидроксигруппа - ориентант первого рода, сильный донор электронов по мезомерному эффекту) Реакции по атому кислорода (кинетический контроль) Алкилирование PhOCH3 (CH3O)2SO2 PhOH RX R = CH3 - анизол, R = C2H5 - фенетол PhOR HO- CH2N2 SN2 OH R 200o Ph R O O перегруппировка Кляйзена O R R если орто-положения заняты, идет в пара-положение синхронный процесс Прямое алкилирование фенолов в кольцо не происходит ни в каких условиях! 23 24 Ацилирование OH AlCl3 RCOCl PhOCOR PhOH t или (RCO)2O OH + ROC HO COR перегруппировка Фриса OH O AlCl3 PhOH + O O O O фенолфталеин (пурген) Триарилметановые красители 25 HO HO O OH OH H+ OH ± O CO2- CO2- O HO малиновый цвет ± H+ OH CO2H красный цвет 26 Реакции по бензольному кольцу OH OH OH O2N HNO3 (разб.) + PhOH Br2 Br H2O HNO3 (конц.) H2SO4 NO2 Br Br продукт монозамещения получить невозможно OH O2N NO2 Cl2 CCl3NO2 хлорикрин NO2 пикриновая кислота 27 Гидроксигруппа –сильный донор по мезомерному эффекту, обеспечивающий возможность реакций фенолов со слабыми электрофилами. нитрозирование PhOH O OH OH -H+ NaNO2 H3O+ H H NO O HON NO H NO OH ON нитрозофенол Реймер-Тиман Кольбе-Шмидт OH OH CO2H салициловая кислота CO2 HOt,p PhOH CHCl3 HO- CHO 28 азосочетание PhOH N Ar N ArN2+ азосоединение HO Фенолформальдегидные смолы OH OH OH CH2OH PhOH CH2O H+ OH + OH H2 C H+ CH2OH смола (бакелит) CH2+ PhOH 29 O CrO3 H+ PhOH OH H2 кат. O бензохинон Многоатомные фенолы OH OH OH OH OH пирокатехин резорцин OH OH HO OH OH гидрохинон пирогаллол HO OH флороглюцин 30 Синтез Cl OH - HO OH SO3H Cu+, t OH Cl OH OH HOCu+, t HOt SO3H OH Cl OH Свойства 1. Легкость окисления O OH OH CrO3 HO O OH + Ag O O 31 O O O ±e ±H ±e O O O HO семихинон OH O O O H + HO OH + H O O O хингидрон (КПЗ) ± пара-бензохинон e хингидрон ±e гидрохинон 32 Свойства Таутомерные равновесия OH O OH OH O O O O O H+ ± OH OH OH OH OH H+ атака по атому углерода атака по атому кислорода O O OH OH OH O OH OH 33 Аналогично, O OH HO OH O HO OH O O OH O OH OH HO O O NH2 NH3 реакция Бухерера NaHSO3 OH OH NaHSO3 H3O+ 34 OCH3 OCH3 NH2 OH OH 1. NaNO2 / H3O , 0 1. POCl3 / ДМФА 2. H3O+, t 2. H3O+ + о-анизидин OH o гваякол ("коптильная жидкость") OCH3 OCH3 крезолы ("креозот") вератрол OCH3 CHO ванилин 35 Амины CH3NH2 (CH3)2NH (CH3)3N метиламин (первичный амин) диметиламин (вторичный амин) триметиламин (третичный амин) сравни! C2H5NH2 NH2 NH2 первичные амины C2H5OH OH этанол (первичный спирт) пропанол-2 (вторичный спирт) OH 2,2-диметипропанол (третичный спирт) 36 Алифатические амины Методы получения 1. Алкилирование аммиака RNH3 X- RX + NH3 RNH3 X- NH3 NH3 R2NH + RX R3NH XR3N + RX RNH2 + NH4X R2NH2 X- RNH2 + RX R2NH2 X- SN2 или SN1 R = алкил, Х = Cl, Br, I NH3 R2NH + NH4X R3NH XR3N + NH4X R4N X- По мере накопления алкильных заместителей у атома азота сила нуклеофила увеличивается. Поэтому остановить реакцию на стадии продукта моноалкилирования затруднительно. 37 2. Синтез Габриэля O O N- K+ RX + O O HO- RX - алкилгалогенид HO O- CO2H H R -HO + CO2- RNH2 или N2H4, t RX RNH2 только первичный амин HO- CO2 O HO- CO2- R OH - O HO-H2O фталимидное производное O H N N SN2 HO-, t NHR OO H H NHR ± 38 3. Восстановление нитрилов RCH2 NH2 H2 Pd/C H + LiAlH4 (1экв.)* H3O RCHO R RCN N- *обратный порядок прибавления 1. LiAlH4 (изб.) 2. H2 O RCH2NH2 B2H6 RCH2NH2 не затрагивается NO2, CO2R 4. Восстановительное аминирование O O NH3, H2 NH Ni NH3 HCO2H NH3 NaBH3CN NH2 реакция Лейкарта NH2 N H2 Ni HN 39 4а. Восстановительное аминирование в две стадии O HO RNH2 NHR + H R R N H+ -H2O NaBH4 (LiAlH4) HN вторичный амин имин R'X R R' N X- R NaBH4 (LiAlH4) R' N третичный амин иминиевая соль 5. Восстановление амидов O R RCOCl NH2 NH3 O R NH2 RCOCl дальнейшая реакция не идет - пара электронов на атоме азота находится в сопряжении с карбонильной группой 40 RCOCl NH3 RCOCl R'NH2 RCOCl R'2NH LiAlH4 RCONH2 RCONHR' RCH2NH2 LiAlH4 RCH2NHR' LiAlH4 RCH2NR'2 RCONR'2 6. Реакция Гофмана RCONH2 NaOBr HO- RCONH- Br O - + RCONHBr HO R N N C O Br OH HO- N R O- R изоцианат RNHCO2H карбаминовая кислота -CO2 RNH2 7. Реакция Курциуса RCOCl O NaN3 t R N N N ацилазид N -N2 R C H O, HO 2 O - CO2 RNH2 -Br- 41 8. Реакция Шмидта RCOCl N2H4 O NaNO2 RCONHNH2 RNH2 R + H3O N нитрен O нитреноид X - хорошая уходящая R N группа X Свойства аминов Основность RNH2 + H+ RNH3 Положение равновесия зависит от устойчивости образующегося катиона, его сольватации (жидкая фаза) и доступности пары электронов в исходном амине. Алкильные заместители (доноры по индуктивному эффекту) стабилизируют катион аммония и увеличивают доступность неподеленной пары электронов в исходном амине. 42 Ряд основности газовая фаза: NH3 < CH3NH2 < (CH3)2NH < (CH3)3N жидкая фаза: NH3 < CH3NH2 < (CH3)3N < (CH3)2NH различный порядок связан с плохой сольватацией объемного триметиламмонийного катиона Ароматические амины NH2 NH2 NH2 NH2 NH2 NH3 + H+ В ароматическом амине пара электронов находится в сопряжении с фенильной группой. Протонирование это сопряжение нарушает, что энергетически невыгодно. Поэтому основность ароматических аминов ниже, чем алифатических. Донорные заместители, особенно в орто/пара-положениях, повышают основность, акцепторные – понижают. 43 Кислотность аминов -H+ RNH- RNH2 Ряд кислотности противоположен ряду основности: акцепторные заместители стабилизируют анион, донорные – дестабилизируют. Реакции с электрофильными реагентами 1. Алкилирование RNH2 + RX R2NH RX RX R3N R4N X- реакция неселективная 2. Ацилирование RNH3 R'CO2t R'CO2H O RNH2 R'COCl -HCl R'COCl HN R R'CO2CH3 R' R2NH 44 R'COCl R'CONR2 -HCl O R'COCl R3N R' - NR3 H2O Cl R3NH R'CO2 - молекула содержит очень хорошую уходящую группу и потому неустойчива. При действии хлорид-аниона она превращается в смесь исходных соединений. Присутствие следов воды вызывает мгновеный гидролиз Использование реакции ацилирования (тозилирования) для разделения смеси аминов устойчивый анион (Ts - сильный акцептор) RNH2 + TsCl RNHTs TsCl R2NTs R2NH + TsCl R3N HO , t - -TsO R2NTs обработка разбавленным R NTs 2 раствором кислоты R3NH+X- - RNHTs RNHTs RNH2 HO-, t -TsO- R2NH HO- R3N HO- RNTs растворим в воде HO- нерастворим в воде 45 Нитрозирование NaNO2+ H3O+ = HNO2 = NO+ (электрофил) R = алкил R3N R2NH NaNO2 смесь продуктов (распад связи С-N) H3O+ N NaNO2 H3O+ R2N-NO N R N NO R N H2 -H+ N OH2 -H2O N N N N-нитрозоамины - канцерогены, апротонные диполярные растворители RNH2 NaNO2 H3O+ O O R N N RNHNO R затрудненность вращения вокруг связи N-N R N алифатическая соль диазония - неустойчива! N R+ N -N2 OH H+ превращения карбокатиона 46 Превращение аминов в алкены Cl N(CH3)3 Ag2O (влаж.) N(CH3)3 t > (CH3)3N HO- Cl- Гофман H2O2 N N O t + ~3:2 син-элиминирование, Коуп Диамины NH2 (CH2)4 NH2 кадаверин CN H2 Ni NH3 (изб.) NaCN CN NH2 Cl Cl H2 N(CH2)5NH2 путресцин ("трупный яд") NH2 47 Ароматические амины Методы получения Восстановление нитросоединений [H] PhNH2 PhNO2 [H] = Fe/H3O+; Sn/H3O+; H2/катализатор (Pt, Pd, Ni); N2H4/Ni; H2S (Зинин) NO2 NO2 NaHS NO2 H O 2 NH2 Из галогенбензолов PhCl NaNH2 t PhNH2 Реакция Гофмана CONH2 NH2 NaOBr 48 Свойства 1. Основность (пониженная по сравнению с алифатическими аминами) 2. Взаимодействие с электрофильными реагентами E+ NH2 возможные направления электрофильной атаки - неподеленная E+ пара электронов атома азота (всегда в первую очередь), орто- и пара-положения кольца (аминогруппа - ориентант первого рода, очень сильный донор электронов по мезомерному эффекту) E+ Алкилирование – происходит всегда только по атому азота PhNH2 EtBr PhNH2Et Br- PhNEt3 Br- реакция происходит более селективно, чем в случае адифатических аминов вследствие пониженной реакционой способности (сопряжение неподеленной пары электронов атома азота с бензольным кольцом) + PhNH2 H t Ph2NH PhI Cu Ph3N очень слабое основание 49 Ацилирование PhNH2 RCOCl или (RCO)2O PhNHCOR R = CH3 - ацетанилид R O HN RCOCl HN R R O HN O ацетамидная группа - донор электронов по мезомерному эффекту, но более слабый, чем аминогруппа Сульфирование NH3 HSO4- NH2 NH2 SO3H 100o PhNH3 HSO4спекание 180o олеум t 180o SO3 H метаниловая кислота NH2 HO3S SO3H сульфаниловая кислота 50 NH3 NH2 SO3 SO3H NHCOCH3 PhNHCOCH3 ClSO3H NHCOCH3 H3O+ NH3 O O S Cl O S O NH2 H2N O S O H2N белый стрептоцид первый сульфамидный препарат (антимикробное действие) 51 NH2 Галогенирование PhNH2 X X2 X X = Cl, Br H2O X Нитрозирование N N Ph N NaNO2 HO- + H3O+ -H2O третичный амин H Ph H NO NO NaNO2 N H Ph H3O+ NOH PhNH2 + первичный H3O амин Ph N N NO N NO вторичный амин NaNO2 N N Ph N N соль арилдиазония сравнительно устойчива вследствие нестабильности арильного катиона 52 Реакции солей диазония Реакции с выделением азота Х = Br, Cl (реакция Зандмейера) ArX HX CuX ArNH2 NaNO2 ArN2+ H3O+, 0o HBF4 ArN2+BF4- t ArF реакция Больца-Шимана NaI ArI ArOH ArCN CuCN ArN3 CuNO2 ArNO2 N3 - H3O+ ArN2+ HX Cu ArX Х = Br, Cl (реакция Гаттермана) EtOH (или H3PO2) ArH 53 Синтез несимметричных биарилов HO+ PhN2 X Ph Ar Гомберг-Бахман-Хей ArH t ArH -N2 -X радикальный процесс -H активность субстрата: PhNO2 > PhCl >> PhCH3 > PhH преимущественное направление реакции - пара- и орто- Ph Реакции без выделения азота ArN2+ NaHSO3 ArNHNH2 Азосочетание SO3H N2+ Ph N N N + - азосоставляющая O3S диазосоставляющая N метилоранж (гелиантин) - кислотноосновной индикатор, ранее использовался для крашения шелка азосоединение 54 В качестве азосоставляющей может быть использовано только ароматическое соединение, содержащее сильный донорный заместитель – амино, гидрокси, в некоторых случаях – алкоксигруппу. Реакция происходит почти исключительно в пара-положение; если оно занято, то в орто-положение Метиловый оранжевый – моноазокраситель (одна азогруппа) H2NO2S NH2 Герхард Домагк – нобелевская премия по физиологии и медицине, 1939 г N N пронтозил(красный стрептоцид) моноазокраситель NH2 NH2 N SO3Na N N N NaO3S конго-красный бис-азокраситель H2N 55 Окисление ароматических аминов O H2O2 N Ph Ph N PhNH2 RCO3H PhNO PhNO2 азоксибензол CrO42- или MnO4 - N NH2 Ph N H N N n H Ph "анилиновый черный"