13x828
реклама

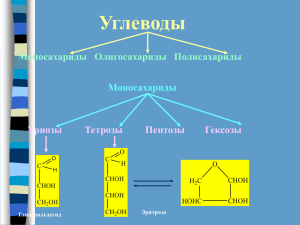
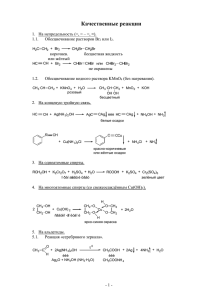
Распознавание веществ ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Распознать вещества набора Б: сорбит, карбонат натрия, глюкоза, мочевина, сульфат аммония, янтарная кислота. № пробирок с известными веществами HCl NaOH, t Реактивы Pb(NO3)2 CuSO4 + NaOH ↑ без запаха ↓белый 5 6 синяя Ярко-синий раствор, при t ↓красный 3 4 Индикаторная бумага Ярко-синий раствор 1 2 Вывод ↑ запах аммиака ↑ запах аммиака Помутнение раствора ↓белый ↓ белый розовая ↓ лазурный розовая Сорбит C6H14O6 карбонат натрия Na2CO3 Глюкоза C6H12H6 Мочевина NH2-CO-NH2 сульфат аммония (NH4)2SO4 янтарная кислота HOOC-CH2-CH2-COOH ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Схема распознавания веществ набора Б 1. Опустили индикаторную бумагу во все пробирки. В пробирке №2 она стала синяя (щелочная среда вследствие гидролиза соли), значит в ней находится карбонат натрия. Na2CO3+ НОН↔NaHCO3 + NaOH pH>7 CO32- +НОН↔HCO3- + OH2. Докажем это, долив к карбонату натрия соляной кислоты – увидим выделение углекислого газа. Na2CO3+2HCl →2NaCl + H2O + CO2 ↑ CO32- + 2H+→ H2O + CO2 ↑ 3. Впробирках №5 и №6 – слабо розовая окраска индикаторной бумаги (кислая среда). Это могут быть янтарная кислота и сульфат аммония (кислая среда вследствие гидролиза соли) HOOC-CH2-CH2-COOH →H++-OOC-CH2-CH2-COO- + H+pH<7 (NH4)2SO4+ НОН →NH4ОН + NH4 НSO4 NH4++НОН →NH4ОН + Н+ pH<7 4. Распознаем эти 2 вещества с помощью реакций с NaOH, Pb(NO3)2 и Cu(OH)2. Янтарная кислота со всеми этими веществами даёт осадки – соли сукцинаты натрия, свинца(II) и меди(II). Кислота в пробирке №6. CH2 – COO HOOC-CH2-CH2-COOH+ Cu(OH)2 → Cu↓ + 2H2O CH2 – COO HOOC-CH2-CH2-COOH + Pb(NO3)2 → CH2 – COO CH2 – COO Pb ↓ + 2HNO3 HOOC-CH2-CH2-COOH + 2NaOH → NaOOC-CH2-CH2-COONa ↓ + 2H2O 5. Сульфат аммония даёт белый осадок только с Pb(NO3)2 . Он в пробирке №5. (NH4)2SO4 + Pb(NO3)2 → PbSO4 ↓ + 2NH4NO3 Pb2+ SO4 2- → PbSO4 ↓ белый При добавлении к этой соли щёлочи и нагревании ощущается запах аммиака. (NH4)2SO4 + 2NaOH t → 2NH3 ↑ + 2H2O + Na2SO4 NH4+ + OH- → NH3 ↑ +2H2O 6. Добавим в 3 оставшиеся пробирки щёлочи и нагреем. В пробирке №4 ощущается запах аммиака (вследствие гидролиза мочевины в щелочной среде). NH2-CO-NH2 + H2O t → 2NH3 ↑ + CO2 ↑ 7. К гидроксиду меди (II) дольём растворы из оставшихся 2-х пробирок. В пробирках №1 и №3 увидели ярко-синюю окраску раствора, что говорит о наличие в них многоатомных спиртов. CH OH – CHO-(CHOH) -CH OH 2 2CH2OH-(CHOH)4-CH2O H + Cu(OH) 2→ сорбит 3 Cu 2 + 2H2O CH2O- CHOH -(CHOH)3-CH2OH CH2OH – CHO - (CHOH)3-COH 2CH2OH-(CHOH)4-COH + Cu(OH)2 → Cu глюкоза как многоатомный спирт + 2 H2O CH2O- CHOH - (CHOH)3-COH 8. Нагреем обе пробирки. В №1 – изменений не наблюдали, в ней – шестиатомный спирт сорбит. В пробирке №3 раствор сначала становиться жёлтым, а затем выпадает красный осадок оксида меди (I), значит в пробирке глюкоза. t CH2OH-(CHOH)4-COH + 2Cu(OH)2 → CH2OH-(CHOH)4-COOH + Cu2O↓ + 2H2O глюкоза как альдегид ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Распознать вещества из набора Б: сорбит карбонат натрия глюкоза Сухие вещества Растворы веществ Схема распознавания веществ: 1. Определить среду растворов – распознать карбонат натрия. 2. Доказать присутствие в растворе карбоната- ионов. 3. Провести качественную реакцию на многоатомные спирты. 4. Отличить сорбит от глюкозы. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 1. Растворили все вещества в воде. Получили бесцветные прозрачные растворы. Опустили в них индикаторную бумагу для определения среды растворов. Пробирка №1 - окраска не изменилась Пробирка №2 - окраска синяя Пробирка №3 - окраска не изменилась 2. В пробирке №2 окраска бумаги синяя (щелочная среда вследствие гидролиза соли), в ней раствор карбоната натрия Na2CO3 + НОН ↔NaHCO3 + NaOH CO32- + НОН ↔HCO3- + OH- pH>7 3. Докажем это, долив к карбонату натрия соляной кислоты – увидим выделение углекислого газа. Na2CO3+2HCl →2NaCl + H2O + CO2 ↑ CO32- + 2H+→ H2O + CO2 ↑ ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 4. Приготовили реактив для распознавания многоатомных спиртов: CuSO4 + 2NaOH→Cu(OH)2↓+ Na2SO4 Cu2++ 2OH-→Cu(OH)2↓ 5. Долили к реактиву растворы глюкозы и сорбита. В обеих пробирках появился ярко-голубой раствор – это качественная реакция на многоатомные спирты. CH2OH – (CHOН )3- CHO -CH2OH 2CH2OH-(CHOH)4-CH2OH + Cu(OH)2 → Cu сорбит CH2OН- (CHOH) 3- CHOH -CH2O CH2OH – CHO - (CHOH)3-COH 2CH2OH-(CHOH)4-COH + Cu(OH)2→ глюкоза как многоатомный спирт Cu + 2 H2O CH2O- CHOH - (CHOH)3-COH + 2H2O ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 6. Нагрели обе пробирки. В пробирке №1 ничего не произошло - в ней находится спирт сорбит, а в пробирке №3 стал сначала жёлтым, а затем красным - в ней глюкоза (качественная реакция на альдегиды). t CH2OH-(CHOH)4-COH + 2Cu(OH)2 → CH2OH-(CHOH)4-COOH + Cu2O↓ + 2H2O глюкоза как альдегид Вывод: №1 – сорбит (C6H12H6) №2 – карбонат натрия (Na2CO3) №3 – глюкоза (C6H12H6 ) ПЕДАГОГИЧЕСКАЯ ЧАСТЬ Тема урока: «Распознавание кислородосодержащих органических веществ» Даны: растворы сорбита и янтарной кислоты (оба бесцветные) Задание: распознать данные вещества с помощью качественных реакций ПЕДАГОГИЧЕСКАЯ ЧАСТЬ План работы: 1. Определить индикаторной бумагой среду растворов (для предположения нахождения янтарной кислоты) 2. Приготовить реактив для распознавания многоатомных спиртов – гидроксид меди(II). 3. Распознать с помощью реактива гидроксид меди(II) выданные вещества. 4. Результаты анализа внести в таблицу. № пробирок с веществами Реактивы Вывод Индикаторная бумага CuSO4 + NaOH 1 Нет изменений Ярко-синий раствор Сорбит 2 Окраска розовая Лазурный осадок Янтарная кислота ПЕДАГОГИЧЕСКАЯ ЧАСТЬ 1. Определили кислоту индикатором (розовая окраска, т.к. кислота слабая). Написали уравнение реакции диссоциации янтарной кислоты. HOOC-CH2-CH2-COOH→ H+ + - OOC-CH2-CH2-COO - + H+ pH<7 2. Получили реактив для распознавания многоатомных спиртов – гидроксида меди (II) CuSO4 + 2NaOH→ Cu(OH)2↓ + Na2SO4 Cu2++ 2OH-→ Cu(OH)2↓ голубой ПЕДАГОГИЧЕСКАЯ ЧАСТЬ 3. Добавили к реактиву исследуемые вещества. В пробирке №1 окраска стала ярко- синяя, следовательно в ней находится многоатомный спирт сорбит (качественная реакция). CH2OH – CHO - (CHOH)3-CH2OH 2CH2OH-(CHOH)4-CH2O H + Cu(OH)2→ Cu + 2H2O CH2O- CHOH - (CHOH)3-CH2OH ярко-синий раствор В пробирке №2 выпал лазурный осадок сукцината меди (II), следовательно в ней находится янтарная кислота. CH2 – COO HOOC-CH2-CH2-COOH+ Cu(OH)2→ Cu↓+ 2H2O CH2–COO лазурный осадок ПЕДАГОГИЧЕСКАЯ ЧАСТЬ Отзыв участников конкурса о проведённом уроке: 1. Проводить эксперимент было интересно. Химия – наука удивительная. Знаний нужно много, чтобы познать все её тайны. Храмова Полина 2. Одноклассники работали на уроке активно. С интересом проводили эксперимент. Труднее было написать уравнения реакций. Понадобилась помощь учителя. Романов Олег 3. Учитель помогал нам составить схему распознавания веществ и исправил наши ошибки в написании уравнении реакций. Думаем, что нашей работой он осталась доволен. Кашигин Юрий 4. Будем участвовать в конкурсе ещё. Аршинова Юля ПЕДАГОГИЧЕСКАЯ ЧАСТЬ «Научись сам и научи другого!» – таков девиз данного урока. Участники конкурса не только сами научились составлять логическую схему распознавания веществ, но и помогли своим одноклассникам сделать это. Урок прошёл оживлённо. Как всегда, наибольший интерес учащихся проявился во время эксперимента. Меня удивил тот факт, что ученики фотографировали результаты опытов. А может быть и нет в этом ничего удивительного, ведь растворы и осадки были такими красивыми! Действительно скажешь: «Химия – область чудес!..» Учитель химии МОУ «Лицей №43» г. Саранска Сысманова Н.Ю.