Гидродлиз солей - Средняя общеобразовательная школа №1
реклама

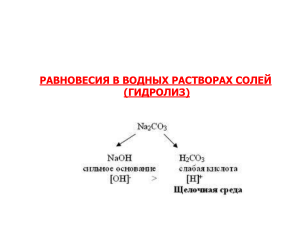
Разработала учитель химии МБОУ «СОШ №1» городского округа Балашиха Калашникова Н. А. Цель урока: сформировать у учащихся понятие гидролиза солей. Задачи урока: Развивать у учащихся умение пользоваться опорными знаниями, закрепить умения и навыки химического эксперимента, умение работать с таблицами, справочными материалами. Развивать мышление, умение делать логические выводы из наблюдений по опыту. Научить составлять ионное уравнение реакции гидролиза солей по первой стадии. Сформировать понимание практического значения гидролиза в природе и жизни человека. I этап урока – подготовка к изучению нового материала, актуализация знаний. Фронтальный опрос в форме беседы. Какие вещества называют электролитами и неэлектролитами? Электролиты – это вещества, растворы которых проводят электрический ток ( растворимые кислоты, основания, соли ). Неэлектролиты – вещества, растворы которых не проводят электрический ток (оксиды, нерастворимые кислоты, основания, соли, некоторые органические вещества ). Что показывает степень электролитической диссоциации? Сильные и слабые электролиты. Степень электролитичес кой диссоциации Сильные L > 30% Основания Кислоты Гидроксиды щелочных и щелочноземель ных металлов LiOH, KOH, NaOH, RbOH, Ca(OH)2, Ba(OH)2, Sr(OH)2. Электролиты средней силы 3% < L < 30% Слабые L < 30% Соли HCI, H2SO4, HNO3, HIO3, HI, HBr, HCIO4, HBrO3, HCIO3. H3PO4, H2SO3 NH4OH и труднораствори мые гидроксиды H2CO3, H2S, HCN, HCIO, H3BO3, H3PO3. H2SiO3, H3AsO4, H2SnO4 Все растворимые соли: хлориды, бромиды, йодиды, сульфаты, сульфиты, сульфиды щелочных металлов и аммония, нитраты всех металлов Как индикаторы меняют свой цвет в кислой и щелочной среде? Изменение окраски индикаторов в зависимости от среды. Название индикатора Окраска индикатора в нейтральной среде Окраска индикатора в щелочной среде Окраска индикатора в кислой среде Красная Лакмус Фиолетовая Синяя Метиловый оранжевый Оранжевая Желтая Фенолфталеин Бесцветная Малиновая Краснорозовая Бесцветная II этап урока – проведение эксперимента, создание и решение проблемной ситуации. Лабораторный опыт. Исследуйте изменение цвета индикаторов в водных растворах солей: хлорида алюминия, карбоната натрия, хлорида натрия. Результаты опыта занести в таблицу и сделать вывод. Формула соли Лакмус Фенолфталеин Среда раствора Какие ионы AICI3 ? ? ? ? Na2CO3 ? ? ? ? NaCI ? ? ? ? Вывод: ? II этап урока – проведение эксперимента, создание и решение проблемной ситуации. Лабораторный опыт. Исследуйте изменение цвета индикаторов в водных растворах солей: хлорида алюминия, карбоната натрия, хлорида натрия. Результаты опыта занести в таблицу и сделать вывод. Формула соли Лакмус Фенолфталеин Среда раствора Какие ионы AICI3 красный - кислая H+ > Na2CO3 синий малиновый щелочная OH- > NaCI фиолетовый - нейтральная H+ = OH- Вывод: вода участвует в гидролизе и дает ионы водорода и гидроксогруппы, избыток которых изменяет цвет индикаторов. III этап урока – самостоятельный поиск информации в таблице, составление схемы гидролиза солей, вывод и определение понятия гидролиза по схеме. AICI3 AI(OH)3 HCI слабое основание сильная кислота [ OH- ] < [ H+ ] Кислая среда раствора Вывод: соль, образованная слабым основанием и сильной кислотой, имеет кислую среду раствора, так как в нем содержится избыток ионов водорода. Na2CO3 H2CO3 NaOH сильное основание [ OH- ] Щелочная среда раствора слабая кислота > [ H+ ] Вывод: соль, образованная сильным основанием и слабой кислотой, имеет щелочную среду раствора, так как в нем избыток гидроксид-ионов. IV этап урока – формирование решения проблемы. Гидролиз – это реакция обмена между ионами солей и воды. Составление ионных уравнений гидролиза. AICI3 ↔ AI 3+ + 3CI- H2O ↔H+ + OHAI3+ + 3CI- + H2O ↔ AIOH2+ + 3CI- + H+ AI3+ + H2O ↔ AIOH2+ + H+ Избыток ионов водорода даёт кислую среду раствора соли, поэтому лакмус становится красным. Na2CO3 ↔ 2Na+ +CO32- H2O ↔ H+ + OH2Na+ + CO32- + H2O ↔ 2Na+ + HCO3- + OHCO32- + H2O ↔ HCO3- + OH- Избыток гидроксид-ионов даёт щелочную среду раствора, поэтому лакмус становится синим, а фенолфталеин – малиновым. V этап урока – закрепление изученного материала. Задание. Какую реакцию будут иметь водные растворы следующих солей: I вариант Нитрат цинка Сульфат калия Сульфид натрия II вариант Карбонат калия Сульфит натрия Нитрат бария Составьте схему гидролиза этих солей. Составьте ионные уравнения гидролиза этих солей. Гидролизу подвергаются всем хорошо известные органические вещества. Происходит это под действием биологических катализаторов – ферментов. В организме человека под действием следующих ферментов происходит гидролиз: Амилаза фермент крахмала Целлюлаза фермент целлюлозы Протеаза фермент белка. Продукты гидролиза жира всасываются ворсинками кишечника, а затем в организме образуется жир, но уже свойственный данному организму. Потоками крови жиры переносятся в другие органы и ткани организма, где накапливаются или снова гидролизуются и постепенно окисляются до углекислого газа и воды. В промышленности гидролизу подвергаются сложные эфиры и жиры обязательно в щелочной среде. Такая реакция называется омылением. На этой реакции основано производство мыла. Продукты гидролиза крахмала широко используются в кондитерской промышленнсти, медицине, для технических целей. Лежа дома на диване И зачем себе на горе Про гидролиз думал Ваня. Люди в отпуск едут к морю? «Сколько в мире, - думал Ваня, - Если долго там купаться, Есть кислот и оснований! Можно без трусов остаться: Например, вода морей – Ткань любую без труда Это ведь раствор солей. Растворяет кислота»… Где-то я читал когда-то: Ванин слушая рассказ, Там хлориды и сульфаты… Целый час смеялся класс. И соляной там и серной Больше Ваню не дразните, Кислоты полно наверно: Ведь сказал ему учитель: Ведь вчера прошли мы в школе «Зря, Иван, поддался страху, - Что в воде идёт гидролиз!.. Лучше б шёл купаться в воду!» Домашнее задание. §16, упр. №5, 6.