Тема урока - Pedsovet.su
advertisement

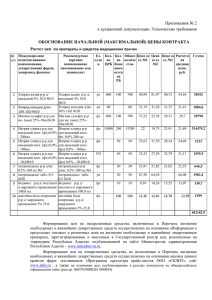
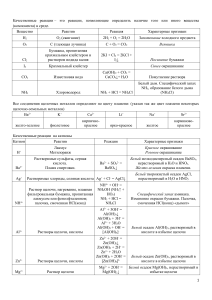
Разработка учителя химии МБОУ СОШ №8 г Краснодара Попович Лидии Ивановны на тему: « Классификация химических реакций» Цель урока: закрепить знания учащихся по пройденной теме «Скорость химических реакций» и обобщить знания по теме «Типы реакций» Опрос. 1. С наибольшей скоростью при комнатной температуре протекает реакция между: а) Al и S ; б) H2 и O2 ; в) Cu и O2 г) NaOH(р-р) и FeCl 2(р-р) 2. С наибольшей скоростью при комнатной температуре протекает реакция между: а) Fe и CuSO4 ; б) NH3(г) и HCl (г) ; в) Al и Cl2 ; г) CuO и Н2 3. С наименьшей скоростью при комнатной температуре протекает реакция между: а) HCl (3%-й р-р) и AgNO3 (1%-й р-р) б) HCl (1%-й р-р) и AgNO3 (3%-й р-р) в) HCl (3%-й р-р) и AgNO3 (3%-й р-р) г) HCl (1%-й р-р) и AgNO3 (1%-й р-р) 4. Реакция, скорость которой зависит от изменения концентрации двух взаимодействующих веществ, -- это: 1. 2. 3. 4. CuO + CO = Cu + CO2 2SO2 + O2 = 2SO3 Zn(OH)2(T) + 2HCl(p-p) = ZnCl2 + 2H2O 4Al + 3O2 = 2 Al2O3 5. Реакция, скорость которой зависит от изменения концентрации только одного из взаимодействующих веществ, -- это: 1. NaOH + HNO3 = NaNO3 + H2 O 2. 2 NO + O2 = 2 NO2 3. CaCO3(T) + 2HCl = CaCl2 + CO2 + H2O 4. Fe + S = FeS Задача. При повышении температуры на каждые 10 градусов скорость реакции увеличивается в 2 раза. Во сколько раз увеличится скорость при повышении температуры от 40 до 80С. Типы химических реакций. По числу исходных и образующихся веществ: 1. Реакции соединения. 2 Mg + O2 = 2MgO 2. Реакции разложения. 2 Fe(OH)3 = Fe2O3 + 3 H2O 3. Реакции замещения. Cl2 + 2KI = I2 + 2KCl 4. Реакции обмена. NaOH + HNO3 = NaNO3 + H2O По изменению степени окисления: 1. Окислительно-восстановительные. Cl2 + 2NaI = I2 + 2NaCl 2.Неокислительно-восстановительные. 2 Fe(OH)3 = Fe2O3 + 3 H2O По направлению протекания реакции. 1. Необратимые реакции. Mg + 2HCl = MgCl2 + H2 2. Обратимые реакции. H2 + Cl2 2 HCl По тепловому эффекту. 1. Экзотермические + Q KOH + HNO3 = KNO3 + H2O 2. Эндотермические - Q CaCO3 = CaO + CO2 - Q По агрегатному состоянию: 1. Гомогенные реакции. 2. Гетерогенные реакции. По присутствию катализаторов: 1. Каталитические реакции. 2. Некаталитические реакции. Закрепление материала. К каким типам можно отнести следующие реакции: CuO + H2 =t Cu + H2O 2 SO2 + O2 2 SO3 + Q Домашнее задание: § 19, упр. 1,2,3