А1. Элемент, атом которого содержит 12 протонов
реклама

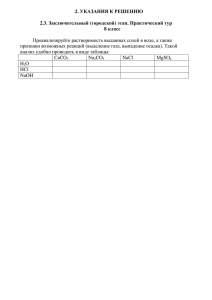
Часть 1 К каждому из заданий A1 – A19 даны 4 варианта ответа, из которых только один правильный. А1. Элемент, атом которого содержит 12 протонов 1) Na 2)C 3) Mg 4) Si А2. Наибольшей восстановительной способностью обладает 1) Si 2) P 3) S 4) CL А3. В каком ряду записаны только соединения с ионной связью? 1) SiO2, CaO, Na2SO4 2) HCLO4, CO2, NaBr 3) MgO, NaI, Cs2O 4) H2O, ALCL3, RbI А4. Степень окисления «-3» фосфор проявляет в соединении 1) P2O3 2) P2O5 3) Ca3P2 4) Ca(H2PO4)2 А5. Двухосновной кислотой является 1) хлорная 2) кремниевая 3) ортофосфорная 4) метафосфорная А6. Признаком реакции между цинком и раствором серной кислоты является 1) образование осадка 2) растворение осадка 3) выделение газа 4) изменение цвета А7. К реакциям обмена относят реакцию, уравнение которой 1) CaO + SO3 = CaSO4 2) 2Na + 2H2O = 2NaOH + H2 3) 2AL(OH)3 = AL2O3 + 3H2O 4) H2S + 2KOH = K2S + 2H2O А8. В водном растворе полностью распадается на ионы 1) H2SiO3 2) Ba(OH)2 3) AL2S3 4) CO2 А9. Наибольшее количество хлорид-ионов образуется при диссоциации 1 моль 1) NaCLO3 2) ALCL3 3) KCLO 4) AgCL 2+ 2– А10. Сокращенное ионное уравнение Ca + CO3 CaCO3 соответствует взаимодействию 1) хлорида кальция и карбоната натрия 2) сульфида кальция и углекислого газа 3) гидроксида кальция и углекислого газа 4) фосфата кальция и карбоната калия А 11. При обычных условиях с наименьшей скоростью протекает реакция между 1) Fe и O2 2) CaCO3 и HCl(р-р) 3) Na и O2 4) Na2SO4(р-р) и BaCl2(р-р) А12. Оксид алюминия реагирует с 1) водой 2) серой 3) оксидом углерода (IV) 4) серной кислотой А13. Выделение газа происходит при взаимодействии серной кислоты с 1) гидроксидом калия 2) карбонатом натрия 3) оксидом калия 4) нитратом свинца А14. Щелочную реакцию среды имеет раствор каждой из двух солей: 1) КCl и Na2S 2) К2SiO3 и Na2CO3 3) FeCl2 и NН4Cl 4) CuSO4 и Na2SO4 А15. В системе 2CO (г) + O2 (г) <=> 2CO2 (г) + Q смещению химического равновесия в сторону исходных веществ будет способствовать 1) увеличение давления 2) уменьшение температуры 3) увеличение концентрации оксида углерода (IV) 4) увеличение концентрации кислорода А16. Ионы бария в растворе можно обнаружить с помощью 1) лакмуса 2) соляной кислоты 3) серной кислоты 4) фенолфталеина А17. Верны ли следующие суждения о работе в химической лаборатории: А. Для фиксации пробирки во время нагревания можно использовать тигельные щипцы Б. Излишек раствора из пробирки можно перелить в ёмкость с исходным раствором 1) верно только А 2) верно только Б 3) верны оба суждения 4) оба суждения неверны А18. Массовая доля азота в нитрате кальция равна 1) 9,3% 2) 17,1% 3) 34,2% 4) 39,4% Часть 2 При выполнении заданий B1 – B3 выберите один или несколько правильных ответов В1. В ряду химических элементов CL – Br – I 1) 2) 3) 4) 5) увеличивается число электронов во внешнем электронном слое уменьшается радиус атомов уменьшается электроотрицательность усиливаются неметаллические свойства увеличивается заряд ядра атомов В2. Цинк может взаимодействовать с 1) фосфором 2) концентрированной H2SO4 3) хлоридом алюминия 4) разбавленной H2SO4 5) раствором хлорида меди (II) HCL + HCLO H2O + CL2 Cu + H2O + N2 + HCL ZnCL2 + H2 MnCL2 + H2O + CL2 При выполнении задания В4 установите соответствие между названием вещества и классом (группой) неорганических соединений, к которому оно принадлежит (буквы могут повторяться) В4. 1) 2) 3) 4) НАЗВАНИЕ ВЕЩЕСТВА гидрокарбонат свинца (II) серная кислота соляная кислота гидроксид бериллия КЛАСС (ГРУППА) СОЕДИНЕНИЙ А) Б) В) Г) Д) Е) AL2(SO4)3 AL(OH)3 + HCL X AgCL C2. Какая масса осадка образуется при взаимодействии избытка раствора нитрата бария с 34,8 г раствора сульфата калия с массовой долей растворённого вещества 5%? В3. Хлор окисляется в реакциях 1) CL2 + H2O 2) HCL + O2 3) CuO + NH4CL 4) HCL + Zn 5) HCL + MnO2 С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: бескислородная кислота щелочь кислородсодержащая кислота амфотерный гидроксид кислая соль