ТРЕХКОМПОНЕНТНЫЙ СИНТЕЗ п
реклама

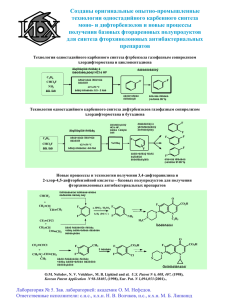
п-ГИДРОКСИФЕНИЛЭТИЛАМИДЫ ДИАЛКИЛАМИНОУКСУСНЫХ КИСЛОТ О. Г. Аушева, В. А. Глушков, Л. В. Аникина, Ю. Б. Вихарев, В. А. Сафин, Ю. В. Шкляев Институт технической химии УрО РАН, г. Пермь; e-mail: [email protected]. Трехкомпонентной конденсацией по типу реакции Риттера синтезирован N[(1-п-гидроксифенил-2-метил)-пропил-2]амид хлоруксусной кислоты (Iа). Показано, что образование Iа происходит путем сольволиза (с диенон-фенольной перегруппировкой) промежуточного 1-хлорметил-3,3-диметил-2-азаспиро[4,5]дека1,6,9-триен-8-она (А). Хлорацетамид Iб описан нами ранее [1]. Хлорацетамиды Iа,б вступают в реакции с алифатическими и ароматическими аминами: _ _ Me + Me + MeO H + ClCH2C Me N O CHO R _ R Cl HO N H Iа,б Me O 1 2 2 HNR R , t Ia N A CH2Cl R o 1 2 H+, H2O _ R 1 2 NR R HO N H - HCl . HNR R O II а-м I а: R = Me, б: 2R = (CH2)5; II а: R = Me, R1 = R2 = Et; б: 2R = (CH2)5, R1 = R2 = Et; в: R = Me, HNR1R2 = морфолин; г: 2R = (CH2)5, R1R2 = (CH2)4; д: R = Me, R1R2 = (CH2)5; е: 2R = R1R2 = (CH2)5; ж: R = Me, HNR1R2 = N-метилпиперазин; з: R = Me, HNR1R2 = N-фенилпиперазин; и: 2R = (CH2)5, HNR1R2 = N-фенилпиперазин; к: 2R = (CH2)5, R1 = H, R2 = Ph; л: 2R = (CH2)5, R1 = H, R2 = 2-MeOC6H4; м: 2R = (CH2)5, R1 = H, R2 = 2-ClC6H4. Выходы IIа-м составляют 36 – 80 %. Строение синтезированных соединений подтверждено данными ИК и ЯМР 1Н спектров. Изучена анальгетическая и противовоспалительная активность амидов II. [1] Аушева О.Г., Глушков В.А., Шуров С.Н., Шкляев Ю.В., Изв. АН, сер. хим., 2001, № 9, 1571.