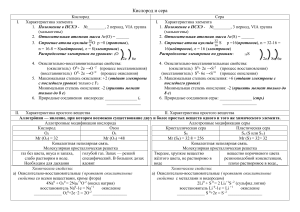
Алгоритм анализа окислительно
реклама

Алгоритм анализа окислительно-восстановительных реакций. Примечание: Электронно-ионное уравнение составляется на один атом. 1. Определить степени окисления элементов в исходных веществах и в продуктах реакции. 2. Подчеркнуть знаки тех элементов, которые изменили свою степень окисления. 3. Составить для всех элементов электронно-ионные уравнения. 4. Свести электронный баланс по числу принятых и отданных электронов. 5. Определить количество частиц (атомов и ионов), участвующих в реакции. 6. Проверить, подходят ли эти числа для расстановки коэффициентов и в случае необходимости ввести поправку (удвоить) 7. расставить коэффициенты в уравнении реакции, начиная с того элемента, который входит в состав меньшего числа веществ. P.S. Если у одного из элементов степень окисления не только изменяется, но и повторяется, то и “проверку» и «расстановку» коэффициентов для этого элемента проводят на основе баланса только для того вещества, в котором элемент находится в неповторяющейся степени окисления. 8. Выравнять все остальные виды атомов, которые не принимали участие в ОВРе. 9. Отметить процессы окисления и восстановления, а также окислитель и восстановитель. Пример Рассмотреть процесс каталитического окисления аммиака. 1. Запишем схему уравнения реакции и определим степень окисления элементов. 2 2 N H 3 O2 N O H 2O 3 1 0 t 0 ,P кат 2. Подчеркнем знаки элементов, изменивших степень окисления и составим для них электронно-ионные уравнения. 2 2 N H 3 O2 N O H 2O 3 1 0 t 0 ,P кат 3 2 0 2 N 5e N O 2e O Сведем электронный баланс и определим число частиц 3 2 N 5e N 10e 2 0 2 5 O 2e O Проверим, подходят ли найденные числа для расстановки коэффициентов, т.е. поделим найденные числа на индекс при данном элементе в соединениях. Оказалось, что для азота число 2 подходит, а для кислорода – не подходит, т.к. 5 – нечетное число и на 2 оно не делится, поэтому следует ввести поправку – в данном случае – удвоить найденные числа, после чего начать расстановку коэффициентов с азота, т.к. он входит в состав меньшего числа веществ. 3 1 0 4 N H 3 5 O2 t 0 ,P кат 2 2 1 2 4 N O 6 H 2 O 3 2 в ль N 5e N 2 4 ое 0 2 10e о ль O 2e O 5 10 в е Осталось отметить процессы окисления и восстановления, а также окислитель и восстановитель Пример 2. 0 1 5 2 1 5 2 1 2 3 1 5 2 8 Na 10 H N O3 8 Na N O3 3 H 2 O N H 4 N O3 0 1 в ль Na 1e Na 8о е 5 3 8e о ль N 8e N 1в е