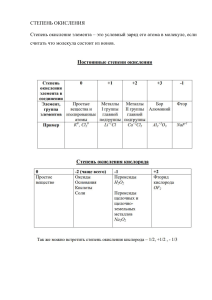
Кислород и сера I. Кислород Характеристика элемента 1. Положение в ПСХЭ - №________, 2 период, VIА группа (халькогены) 2. Относительная атомная масса Аr(О) = ______ 16 3. Строение атома нуклида 8 О р =8 (протонов), n = 16-8 = 8(нейтронов), е = 8(электронов) Распределение электронов по уровням: 8О 2e 6e 4. Окислительно-восстановителььные свойства: (окислитель) О0+ 2e →О -2 (процесс восстановления) (восстановитель) О0- 2e →О+2 (процесс окисления) 5. Максимальная степень окисления: +2 (отдает электроны с последнего уровня) только с F2 Минимальная степень окисления: -2 (принять может только до 8 e) 6. Природные соединения кислорода: _______________ (. ________________ Сера I. Характеристика элемента 1. Положение в ПСХЭ - №________, 3 период, VIА группа (халькогены) 2. Относительная атомная масса Аr(S) = ______ 32 3. Строение атома нуклида 16 S р =16(протонов), n = 32-16 = 16(нейтронов), е = 16 (электронов) Распределение электронов по уровням: 16S 2e 8e 6e 4. Окислительно-восстановителььные свойства: (окислитель) S0+ 2e →S-2 (процесс восстановления) (восстановитель) S0- 6e →S+6 (процесс окисления) 5. Максимальная степень окисления: +6 (отдает электроны с последнего уровня) Минимальная степень окисления: -2 (принять может только до 8 e) 6. Природные соединения серы: _______________ (стр.) ________________ Характеристика простого вещества II. Характеристика простого вещества Аллотро́пия — явление, при котором возможно существование двух и более простых веществ одного и того же химического элемента. Аллотропные модификации кислорода Аллотропные модификации серы Кислород Озон Кристаллическая сера Пластическая сера О2 О3 S8 Sn (S или S∞) Mr (O2) = 32 Mr (O3) =48 Mr (S8) = 32∙8 = 256 Mr (S) = 32= 32 Ковалентная неполярная связь. Ковалентная неполярная связь. Молекулярная кристаллическая решетка Молекулярная кристаллическая решетка газ без цвета, вкуса и запаха, голубой газ. Запах — резкий Твердое, хрупкое вещество вещество коричневого цвета cлабо растворим в воде. специфический. В больших дозах жёлтого цвета, не растворимо в резиноподобной консистенции, Необходим для дыхания ядовит воде плохо растворимое в воде., Химические свойства: Химические свойства: a) Окислительно-восстановительные ( проявляет окислительные a) Окислительно-восстановительные ( проявляет окислительные свойства со всеми веществами, кроме фтора) свойства с металлами и водородом) 4Na0 + О20 = 2Na2+1О-2 (оксид натрия) 2Li0 + S 0 = 2 Li2+1S -2 (сульфид лития) 0 +1 восстановитель Na -1e = Na окисление восстановитель Li 0-1e = Li +1 окисление _____________ О20+2e ∙2 = 2О-2 ________________ _____________ S 0+2e = S -2 ________________ II. Со фтором проявляет восстановительные свойства О20 + 2F20 = 2О+2 F2-1 (фторид кислорода) ____________ О20-2e∙2 = 2О+2 ___________ окислитель F20+1e ∙2 = 2F -1 восстановление б) Качественная реакция - возгорание тлеющей лучинки С + О2 = СО2 Получение А) В природе – процесс фотосинтеза 6 СО2 + 6 Н2О = С6Н12О6 + 6 О2 Б) В промышленности – при перегонке жидкого воздуха В) В лаборатории - реакция разложения сложных веществ 2 KMnO4 = K2MnO4 + MnO2 + O2 2Н2О эл.ток→2Н2 + О2 Применение : (схема после конспекта и стр.98) кислорода________________ озона ______________ ________________ _______________ ( проявляет восстановительные свойства с кислородом) S0 + О20 = S+4О2-2 (оксид серыVI) ________________S0 – 4е = S+4________________ ________________О2 +2е ∙2 =2О-2______________ Получение А) В промышленности – из самородной серы Б) В лаборатории 2H2S + SO2 → 3S + 2H2O Применение : (стр. 103) _____________ _______________