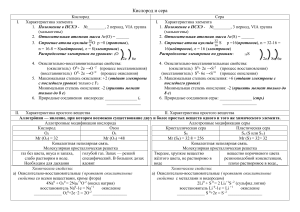
Основные окислители и восстановители Окислители 1
реклама

Основные окислители и восстановители Окислители 1. Неметаллы: F2, Cl2 Br2, I2, O2, водород в степени окисления +1. 2. Ионы металлов в высшей степени окисления, Fe3+ , Cu2+, Hg2+. 3. Кислородсодержащие кислоты: H2SO4, HNO3, HMnO4 и их соли: Na2SO4, KMnO4 , K2CrO7, 4. Кислородсодержащие кислоты галогенов: HClO, HClO3, HBrO3 Восстановители 1. Активные металлы: щелочные, щелочноземельные металлы, Zn, Al, Fe. 2. Бескислородные кислоты: HCl, HBr, HJ, H2S. 3. Гидриды щелочных и щелочно-земельных металлов: NaH, CaH2. 4. Металлы в низшей степени окисления: Sn2+, Fe2+, Cu+ Окислительно-восстановительная двойственность 1. Галогены в щелочной среде (исключая фтор) участвуют в реакции диспропорционирования. Cl20 + 2KOH = KCl+1O + KCl-1 + H2O; 0 Cl2 +2 e 2 Cl-1, процесс восстановления, окислитель; Cl20 -2 e 2Cl+1, процесс окисления, восстановитель. 2. Пероксид водорода H2O2. В присутствии восстановителей может понижать степень окисления до -2, а при взаимодействии с окислителями способен повышать степень окисления. 5H2 +2O2 + J20 = 2HJ+5O3 + 4H2+1 O; H2O2 – окислитель; 3 H2O2 + 2KMnO4 = 2MnO2 + 2KOH + 3ºO2 + 2 H2O , H2O2 – восстановитель. 3. Азотистая кислота и нитриты. 5HNO2 + 2KMnO4 + 3H2SO4 = 5HNO3 + 2MnSO4 + K2SO4 + 3H2O, HNO2 – восстановитель. 2NaNO2 + 2NaJ + 2H2SO4 = 2NO + J2 + 2Na2SO4 + 2H2O, HNO2 – окислитель.