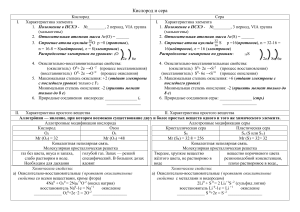
Окислительно-восстановительные реакции Cu(SO4) +2 Na+ (OH
реклама

Окислительно-восстановительные реакции 2− + 2− − Cu(SO 4) +2 Na (OH ) = Cu(OH )2 + Na2 SO4 Окислительно-восстановительные реакции — это такие реакции в которых элементы изменяют свои степени окисления. Правило определения степеней окисления 1. Степень окисления простых веществ равна 0 0 0 0 0 Cu , O2 , N 2 , Fe 2. Степень окисления кислорода в соединениях обычно равна -2, кроме перекиси, пероксидов и соединениях с хлором. 3. Фтор в соединениях всегда -1 4. Степень окисления элементов 1 группы, главной подгруппы, всегда +1 5. Степень окисления элементов 2 группы, главной подгруппы, всегда +2 K +1 Mn +7 O4−2 , +3 −2 − [N O2 ] K 2+1 Mn +6 O4−2 , K 2+1 Cl2+ 6 O7−2 , [N +5 O3−2 ]− , N +4 O2− , Атом, молекула или ион, который отдаёт электроны, называется восстановителем. Атом, молекула или ион, который принимает электроны, называется окислителем. Процесс отдачи электронов называется окислением. Процесс принятия электронов называется восстановлением. Расстановка коэффициентов методом электронного баланса Баланс — количество отданных электронов, должно быть равно количеству принятых. 2K +1 Mn + 7 O4−2 + 16H +1 Cl −1 → 2Mn +2 Cl2−1 + 5Cl20 + 2K +1 Cl −1 + 8H 2+1 O −2 окислитель Mn +7+ 5 ̄e → Mn +2 2 восстановитель 2Cl −1−2 ̄e → Cl 02 5 1K 2+1 Cr2+6 O7−2 +14HCl → 3Cl20+ 2Cr +3 Cl 3−1 +2KCl+7H 2 O +6 +3 окислитель 2 Cr 2 +3 ̄ e → Cr −1 0 восстановитель 2Cl −2 ̄e → Cl 2 3 Чаще всего встречающиеся: окислители: F2 , O2 , HNO3 , KMnO 4 , K 2 Cr 2 O 7 , восстановители: C , H 2 , H 2 S , HI −1 , и др. H 2 SO 4 (конц), и др. Влияние среды на характер протекания ОВР. K Mn O4 → K MnO4 − + − + MnO4 (окислитель) + восстановитель: H + : Mn +2 ( MnSO4 ) H 2 O : MnO2 ↓ − : Mn O2− ( K 2 Mn O 4 ) OH 4 • • • +7 +4 +1 +2 +6 2 K Mn O 4+ 5 Na2 S O3 +3 H 2 SO 4 → 2Mn SO 4 +5Na 2 S O 4+ K 2 SO 4 +3H 2 O ок− ль вос− ль разб. среда окислитель Mn+7 +5 ̄e → Mn +2 2 восстановитель S +4 −2 ̄e → S +6 5 +7 +4 +4 +6 2 K Mn O 4+3 Na2 S O3 +H 2 O → 2 Mn O2 ↓+3Na 2 S O 4 +2KOH ок− ль в− ль окислитель Mn+7 −3 ̄e → Mn+ 4 2 восстановитель S +4 −2 ē → S +6 3 +7 +4 +1 +6 +6 2K Mn O4 + Na2 S O3+ 2KO H → 2K 2 Mn O4 + Na2 S O4 + H 2 O окислитель Mn+7 +1 ̄e → Mn +6 2 восстановитель S +4 −2 ̄e → S +6 1 +7 +1 −1 ок− ль в− ль +2 0 2 K Mn O 4+ 10 K I +8 H 2 SO4 → 2Mn SO4 +5I 2 +6K2 SO4 + 8H2 O среда окислитель Mn+7 +5 ̄e → Mn +2 2 восстановитель 2I−1 −2 ̄e → I 20 5 K 2 Cr2 O7 → 2K + +Cr 2 O2− 7 дихроматкалия 2− 2 6 3+ Cr O + в−ль + H + → Cr 3+ 3+ (Cr 2(SO 4 )3) +3 +3 K 2 Cr 2 O7+ Fe SO4 + H 2 SO 4 → Cr2 ( SO4 )3 + Fe2 (SO 4)3 + K 2 SO 4 + H 2 O +6 +3 окислитель Cr + 3 ̄e → Cr 2 +2 +3 восстановитель 2Fe −2 ̄e → 2 Fe 3