Л11 2014 Файл
реклама

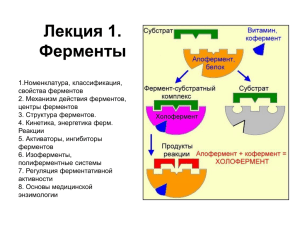
Кинетические методы и ИФА Лекция 11. Применение некаталитических реакций Ферментативные методы анализа Лектор к.х.н., доцент Ю.Ю.Петрова Определение неорганических веществ Реакции окисления-восстановления Анализ анионов (серосодержащие анионы, S2- и SCN-): Для определения сульфида выполняют денситометрические измерения после контакта пробы с фотопластинкой в течение некоторого периода времени. Роданид в концентрации 4·10-5 — 5·10-4 М определяют по ингибирующему действию на реакцию между IO3- и Н2РО3- (выделяется йод, который реагирует с роданидом). Определение неорганических веществ Сочетание реакций окисления-восстановления и комплексообразования: использовали при разработке методик определения таких металлов, как Fe(II), Co, Ni и Pd по реакции окисления гидразона бензил-2-пиридилкетона (R) броматом с образованием флуоресцирующего продукта (P). M + R [MR] R + BrO3- P скорость реакции снижается, что можно связать с концентрацией металла. На этом принципе основана также методика определения 20—150 мкг/мл кобальта (II) в системе КВrО3- /2-пиридилгидразон пиридин-2альдегида. Определение цианида с использованием системы KI/MnO4Выделяющийся иод связывается в ICN, что замедляет образование I2 (последний и детектируют фотометрически при 575 нм по поглощению синего комплекса с крахмалом): 10I- + 2MnO4- + 16H+ = 5I2 + 2Mn2+ + 8H2O I2 + CN- = ICN + I- Определение органических соединений Природа аналитической реакции различна: окисление, если соединение содержит способные окисляться группы; бромирование, если имеются ароматические ядра; конденсация или присоединение в случае аминов и карбонильных соединений; гидролиз и т. п. Определение органических соединений. Реакции окисления Определение алифатических спиртов на уровне нескольких мкг/мл: Этанол определяют в интервале 0,2—2,0 мкг/мл, регистрируя при 400 нм поглощение перманганата, восстанавливающегося до манганата: 2KMnO4 + CH3CH2OH + 2KOH = 2K2MnO4+ CH3CHO + 2H2O Допустимо присутствие метанола в 5-кратном избытке, однако другие алифатические спирты (пропанол-1, пропанол-2, бутанол) мешают определению. Определение органических соединений Реакции окисления Определение алифатических спиртов на уровне нескольких мкг/мл: Измерение индукционного периода окисления трет-бутанола тетраоксидом ксенона позволяет определять спирт при содержании более 22 мкг: (СH3)3COH +XeO4 = CH3COCH3 +CO2 + Xe + 2H2O Индукционный период: 4CH3OH + 3XeO4 = 4CO2 + 3Xe + 8H2O По влиянию cпиртов на индукционный период этой реакции можно определять метанол, этанол и пропанол-2. Определение гидроксилсодержащих органических соединений (фенолы и хлорфенолы) Их определяют по реакции окисления периодатом методом фиксированного времени, регистрируя оптическую плотность при 340 нм (λmax хинонов и хинолов). Диапазон определяемых содержаний — 50—500 мкг/мл. Определение гидроксилсодержащих органических соединений Гликоли с вицинальными гидроксигруппами окисляют периодатом (реакция Малапраде): СН2ОН(СНОН)nСН2ОН + (n + 1)НIO4 = 2НСНО + nНСООН + (n + 1)НIO3 + Н2О Например: СН2(ОН)СН2ОH + НIO4 = НСНО + НСООН + НIO3; СН3СН(ОН)СН2ОН + НIO4 = СН3СНО + НСНО + НIO3 + Н2O Так, этилен-, пропилен- и бутиленгликоли можно определять в интервале концентраций (1,4 —7,0)·10-3 М с погрешностью около 0,7%. Реакции бромирования Субстраты, определяемые бромированием, — это обычно фенолы (R); бром при этом генерируется in situ (ВrО3-/Вr- в кислой среде). (1) BrO3- + 5Br- + 6H+ = Br2 + 3H2O (2) Br2 + R = P1 1 = 2 Br2 + МО = P2 (бесцветный) Время обесцвечивания МО должно быть пропорционально концентрации определяемого соединения. Так определяют крезолы, ксиленолы, этил- и фенилфенолы, парацетамол, салициловую и ацетилсалициловую кислоты (метод фиксированной концентрации, cmin около 1·10-3 М). Ферментативные методы основаны на использовании зависимости скорости катализируемой ферментом химической реакции от концентрации реагирующих веществ и фермента. Использование биологических катализаторов позволяет значительно повысить чувствительность и селективность методов анализа. Области применения ферментативных методов Анализ объектов окружающей среды Использование ферментативных тест-методик для определения токсикантов в объектах окружающей среды Аналит Объект Вода Черного моря (0,650,05) нг/мл Hg(II) Вода р. Обь Подземная вода Почвы (подзолистые, чернозем) глины, Вода Карского моря Почвы (глины, чернозем) Тест-методика Hg(II) Метилртуть Pb(II) Альтернативный метод 0.66 нг/мл (0,210,03) нг/мл 0.19 нг/мл (0,820,02) нг/мл 0.76 нг/мл (2.0 0.5) мг/кг (2.2 0.6) мг/кг (1.8 0.4) г/кг (0.58 0.03) M (14.50.4) мг/кг (15.50.3) мг/кг (2.0 0.7) мг/кг (2 1) мг/кг (2.0 0.5) мкг/кг (0.7 0.2) M (16 5) мг/кг (151) мг/кг Анализ объектов медицины (биологических жидкостей) Результаты определения магния в моче пациентов активирующему действию на щелочную фосфатазу цыпленка (норма - 100-300 мг Mg /сут) Возраст, Содержание магния в моче Найдено В аликвоте, В суточной моче, годы по граф., нг/мл мкг/мл мг/сут 5 6.00 18.00 14.40 15 14.50 17.40 20.88 20 2.50 15.00 21.00 25 по его из кишечника 2.50 15.00 Возможные причины дефицита магния у пациентов Повышенная возбудимость, снижение иммунитета Гипокалорийные диеты для борьбы с лишним весом 27.00 Физическое перенапряжение, хроническая усталость, расстройство сна, общая слабость 30 7.00 8.40 12.60 Желче- и мочекаменная болезнь, повышенная функция щитовидной железы 50 10.00 6.00 10.80 Гипертония, применение диуретических средств Результаты определения Hg(II) с использованием иммобилизованной на ППУ пероксидазы из корней хрена в плазме крови и моче пациентов больницы г. Лыткарино (ПФЗ Hg(II) в крови и моче – (20 – 50) нг/мл) N пациента Концентрация Hg(II), пг/мл Плазма крови Моча 1 1,3 + 0,4 2,6 + 0,2 2 1,5 + 0,2 2,8 + 0,3 3 1,4 + 0,3 2,6 + 0,2 4 1,6 + 0,4 2,4 + 0,3 5 1,2 + 0,2 1,8 + 0,2 6 1,8 + 0,2 2,9 + 0,2 7 1,4 + 0,4 2,4 + 0,2 8 1,2 + 0,4 2,2 + 0,2 Анализ пищевых продуктов Результаты определения Hg(II) и Pb(II) в минеральных водах с использованием иммобилизованных на ППУ пероксидазы из корней хрена и щелочной фосфатазы из кишечника цыпленка Минеральные воды Концентрация Ме(II), нг/мл Hg(II) Pb(II) «Аким» 1,4 + 0,2 75 + 2 «Ранова» 1,0 + 0,3 5+2 «Святой источник» 1,8 + 0,3 50 + 3 «Мантуровская» 20 + 3 5+2 «Благо» 1,1 + 0,3 10 + 2 «Барюм» 30 + 4 50 + 2 Определение ионов металлов в пищевых продуктах с использованием иммобилизованных на ППУ пероксидазы из корней хрена, щелочных фосфатаз из кишечника цыпленка и тонкой кишки тюленя Содержание Ме(II), мг/кг Объект Hg(II) Cd(II) Pb(II) Zn(II) Горох 2,2 + 0,2 0,0062 + 0,0006 0,13 + 0,03 5,5 + 0,2 Виноград 2,4 + 0,4 0,0024 + 0,0008 0,23 + 0,02 1,7 + 0,3 Говядина 1,5 + 0,3 0,19 + 0,02 0,007 + 0,002 9,4 + 0,4 Свинина 7+2 < 0,001 0,09 + 0,02 4,9 + 0,4 Ферментативными методами можно определять: сами ферменты (Е); их субстраты (S); соединения, воздействующие на каталитическую активность ферментов, — их эффекторы, активаторы (A) или ингибиторы (I). Ферменты — катализаторы белковой природы, ускоряющие химические реакции в живых организмах и вне их. Ферменты обладают уникальными свойствами: высокая каталитическая активность (добавка фермента 10-9— 10-7 М ускоряет превращение субстрата в 108—1012 раз); специфичность (избирательность) их действия в отношении структуры субстрата, типа реакции и условий ее проведения. Гипотеза «ключа и замка» 1890 г. Эмиль Фишер Схематическое объяснение причин специфичности действия ферментов Гипотеза Кошланда (1958 г.) о наведенном соответствии («рукаперчатка») Стабилизация переходного состояния Классификация ферментов Класс ферментов Оксидоредуктазы Тип реакций Окислительно-восстановительные Гидролазы Разрыв связей C-O, C-N или C-C с участием молекул Н2О Трансферазы Перенос функциональных групп от донора к акцептору Разрыв связей C-O, C-N или C-C с образованием двойных связей Соединение 2-х молекул субстрата Лиазы Лигазы Изомеразы Геометрические или структурные изменения в молекуле субстрата Субстрат Фермент Мочевина (Urea) Уреаза Пероксид Пероксидаза Липиды Липаза Фосфаты Фосфатаза Щелочная (рН 8,0-10,5) Кислая (рН 3,0-5,8) Пепсин Трипсин Молочная к-та – 2Н+ пировиноградная к-та лактатдегидрогеназа Молочная к-та + О2 уксусная к-та + СО2 + Н2О2 лактатоксидаза Ферменты и их субстраты Название фермента Субстрат Оксидоредуктазы Альдегиддегидрогеназа Бетаинальдегиддегидрогеназа Альдегиды Бензальдегид Бетаинальдегид Алкогольдегидрогеназа Алкогольоксидаза Арилалкогольоксидаза Спирты Алифатические спирты Ароматические спирты Пероксидаза Пероксид водорода Ароматические амины Бензальдегиддегидрогеназа Гидролазы Уреаза Мочевина Щелочная (рН 8,0 – 10,5) Кислая (рН 3,0 – 6,0) фосфатазы Моноэфиры о-фосфорной кислоты Ферменты – сложные белковые молекулы, представляющие собой высокомолекулярные соединения, состоящие из -L-аминокислот, связанных друг с другом пептидными (амидными) связями: NH2 – CH – CO OH + H N – CH – COOH R’ H R’’ Трёхмерные структуры белка на примере триозофосфатизомеразы Слева — «стержневая» модель, с изображением всех атомов и связей между ними; цветами показаны элементы. В середине — мотив укладки. Справа — контактная поверхность белка, построенная с учётом ван-дер-ваальсовых радиусов атомов; цветами показаны особенности активности участков. Строение глобулы пероксидазы Схематическое изображение взаимодействия фермента с субстратом и эффекторами Холофермент = апофермент + кофактор Апофермент – белковая часть фермента может образовывать комплексы с • коферментом – небелковым органическим соединением, слабо связанным с ферментом; • простетической группой – группой органических соединений, прочно связанных с ферментом; • ионом металла (кофактором). Кофактор (cofactor) вещество небелковой природы, необходимое ферменту для осуществления реакции, т.е. проявления каталитической активности (ассоциация с активным центром фермента) Кофакторы ферментов Кофакторы могут быть как неорганическими молекулами (ионы металлов, железо-серные кластеры и др.), так и органическими (например, флавин или гем). Органические кофакторы, прочно связанные с ферментом, называют также простетическими группами. Кофакторы органической природы, способные отделяться от фермента, называют коферментами. Кофакторы ферментов Фермент, который требует наличия кофактора для проявления каталитической активности, но не связан с ним, называется апофермент. Апофермент в комплексе с кофактором носит название холофермента. Есть и такие простетические группы, которые связаны с ферментом ковалентно, например, тиаминпирофосфат в пируватдегидрогеназе. Ферменты в аналитической химии Кофакторы: - Ионы металлов: Zn2+ (алкогольдегидрогеназа), Mn2+ (фосфортрансфераза), Fe2+ (цитохромы); - Коферменты (коэнзимы). кофактор + апофермент = холофермент Коферменты (Р) и простетические группы (П) Структурная формула кофермента никотинамидаденозиндифосфата (НАД+) NH2 N N N N O O O H H OH H OH H P O- O O P N O O O O- H H OH H OH H H2N НАД+ + Н+ + 2е НАДН (переносчик ОН-групп и электронов) Эффекты 1Н ХПЯ в реакции фотоиндуцированного окисления НАДН, катализируемого ПХ: (1) реакционная смесь НАДН и ПХ до облучения; (2) времяразрешенная фотоиндуцированная 1Н ХПЯ. δ, м.д.: 2.75, эмиссия (С-4 протоны НАДН); 4.75 (HDO). H H 5 5H (1) НАДН•+ НАДН → → НАД• → НАД+ O C 4 6 6H H R(adenosine-diphosphoribosyl) 4H NADH Per3+ .+ e— (2) HDO 7 6 NH2 2 N H 2H H 5 Per2+ + НАДH .+ НФ НАДН НФ 4H 4 3 2 1 0 м.д. Одним из эффективных способов стабилизации ферментов является их иммобилизация перевод в водонерастворимое состояние путем связывания с носителем или модифицирование водорастворимыми полимерами с полным или частичным сохранением ферментами каталитической активности. - любое ограничение свободы движения белковых молекул (или их фрагментов) в пространстве (благодаря внутримолекулярной или межмолекулярной «сшивке» белковых молекул низкомолекулярными бифункциональными агентами или присоединением к растворимому полимеру). Способы иммобилизации ферментов Физические (фермент не связан с носителем ковалентными связями) адсорбция на нерастворимых носителях; включение в поры геля или полимера; пространственное отделение фермента от остального объема реакционной системы полупроницаемой перегородкой (мембраной); включение в двухфазную реакционную среду, в которой фермент растворим и может находиться в одной из фаз. Химические (за счет образования ковалентных связей между белком и носителем с участием «сшивающих» агентов) Особенности: обеспечивается высокая прочность образующегося конъюгата, устойчивого к изменениям температуры, рН; фермент не десорбируется с носителя и не загрязняет продукты катализируемой им реакции; возможны существенные изменения свойств ферментов: субстратной специфичности и каталитической активности. Преимущества иммобилизованных ферментов Более высокая стабильность; Легкость отделения от реакционной среды, что дает возможность: остановить реакцию в нужный момент; использовать катализатор многократно. Возможно получать продукт, незагрязненный ферментом; проводить ферментативный процесс непрерывно и регулировать скорость реакций, а также выход продукта путем изменения скорости потока; целенаправленно изменять свойства катализатора: субстратной специфичности, каталитической активности, ее зависимости от рН, ионного состава; регулировать каталитическую активность фермента путем изменения свойств носителя. Носители для иммобилизации ферментов Требования, предъявляемые к носителям высокая химическая и биологическая стойкость; высокая механическая прочность; достаточная проницаемость для фермента и субстрата; большая удельная поверхность, высокая емкость и пористость; возможность получения в виде форм, удобных в технологическом отношении (гранул, порошков, таблеток, пластинок, мембран); легкое переведение в реакционноспособную форму (активация); высокая гидрофильность, позволяющая проводить реакции связывания фермента с носителем в водной среде; невысокая стоимость. Неорганические носители Силикагели, глины, керамика, природные минералы, графитированная сажа, металлы и их оксиды Органические носители Полимерные Природные Полисахариды целлюлоза, хитин, агароза Синтетические Полимеры на основе стирола: акриламид, нейлон Низкомолекулярные Природные Синтетические Липиды ПАВ ВОЗМОЖНОСТИ ФЕРМЕНТАТИВНЫХ МЕТОДОВ АНАЛИЗА Фермент катализирует реакции, в которых участвуют, как правило, один или два субстрата. Простейшая односубстратная реакция описывается обычно схемой Михаэлиса—Ментен: k1 k2 E + S ES P + E k-1 где Е — фермент, S — субстрат, ES — промежуточный комплекс фермента с субстратом (комплекс Михаэлиса-Ментен), Р — продукт. ВОЗМОЖНОСТИ ФЕРМЕНТАТИВНЫХ МЕТОДОВ АНАЛИЗА При [Е] « [S]o начальная стационарная скорость образования продукта описывается уравнением: k кат [ E ][ S ]0 0 = , K m [ S ]0 где 𝒌кат = 𝒌𝟐 , 𝑲𝒎 = (2) 𝒌−𝟏 +𝒌𝟐 𝒌𝟏 Согласно уравнению (2), концентрация субстрата [S]o будет пропорциональна 0 только при условии, когда [S]o « Km. Тогда [S]0 = 0 Km / kкат [E] (3) Кинетические исследования 0 = k кат [ E ][ S ]0 , K m [ S ]0 ВОЗМОЖНОСТИ ФЕРМЕНТАТИВНЫХ МЕТОДОВ АНАЛИЗА (cв, сн и сmin) cв определяемых концентраций субстрата cн определяемых концентраций субстрата ограничена величиной Km. определяется той величиной 0, которая может быть зафиксирована с помощью используемого для наблюдения инструментального метода. Величина 0 тем выше для одного и того же значения [S]0, чем выше kкат и [Е]. Использование высокоактивного фермента (большое значение k кат) и повышение его концентрации в реакционной смеси могут существенно снизить cmin субстрата. Способы измерения скорости ферментативной реакции 1. Измерение «по конечной точке» (end point method) Такой способ называют еще одноточечной кинетикой. Как правило, по истечении указанного отрезка времени t в реакционную смесь добавляют реагент, останавливающий ферментативную реакцию, например щелочь или кислоту. Способы измерения скорости ферментативной реакции 2. Измерение двухточечное (two point metod) При этом способе оптическую плотность определяют на линейном участке кинетической кривой дважды, четко фиксируя интервал времени t между измерениями. Скорость изменения оптической плотности рассчитывают по формуле: ΔА/мин = (А2 – А1)/t. Этот способ используют, например, в современных методах определения активности амилазы на основе блокированных мальтоз и щелочной фосфатазы. Способы измерения скорости ферментативной реакции 3. Измерение многоточечное, или кинетическое (kinetic measurement) При этом способе оптическую плотность на линейном участке кинетической кривой определяют 3–5 и более раз через четко фиксированные равные интервалы времени t. Скорость изменения оптической плотности рассчитывают по формуле: ΔА/мин = ΔĀ/t. Либо для повышения точности измерения применяют МНК. Измерение скорости ферментативной реакции: а – «по конечной точке»; б – двухточечное; в – многоточечное Определение эффекторов ферментов Обратимые неконкурентные ингибиторы, взаимодействуя с ферментом по реакции: KI E + I EI (4) где I - ингибитор, а KI = [ЕI]/([Е][I]), образуют каталитически неактивные комплексы EI. Определение ингибиторов ферментов Можно показать, что в присутствии ингибитора I отношение разности [Е]о - [Е] = [E]/[E]0 записывается выражением: [ E ] K I [I ] [ E ]0 1 K I [ I ] Определение ингибиторов ферментов При малых значениях [I], когда KI[I] « 1, относительное уменьшение активности фермента будет прямо пропорционально концентрации ингибитора. Тогда 1 E 1 E [ I[ ] I ] (6) K [E] I 0 K I [E] 0 При высокой концентрации ингибитора (6), точность ее определения уменьшается и, наконец, при KI[I] » 1 отношение Δ[E]/[E]0 не зависит от концентрации ингибитора. Необратимые ингибиторы или инактиваторы Е + nI kин Eнеакт (7) если значение kин достаточно велико, так что временной зависимостью реакции (7) можно пренебречь, уменьшение активности фермента Δ[E] будет пропорционально концентрации инактиватора: Δ[E] = n [I], где n — число молекул инактиватора или ингибитора, взаимодействующих с одной молекулой фермента. Необратимые ингибиторы или инактиваторы Если же величина kин относительно мала, то при небольшой глубине протекания реакции (Δt мало, а [Е] мало отличается от [Е]0) можно показать, что относительное уменьшение активности фермента Δ[E]/[E]0 = kин Δt [I]n зависит от длительности процесса активации.