02 Строение и свойства ферментов
реклама

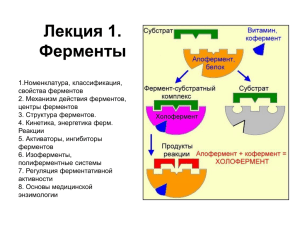
Биохимия как наука: биомолекулы, метаболические пути. Строение и свойства ферментов. Механизм действия ферментов. Изоферменты, классификация ферментов. Кинетика ферментативных реакций Влияние концентрации субстрата на скорость реакции Скорость катализа - При фиксированной концентрации фермента начальная скорость реакции линейно пропорциональна концентрации субстрата - Скорость реакции возростает линейно при увеличении концентрации субстрата и потом останавливается при насыщении фермента субстратом Michaelis і Menten – первыми исследовали кинетику реакций (1913) Во время реакции молекула фермента, E, и молекула субстрата, S, формируют промежуточный ферментсубстратный (ES) комплекс E + S k1 k-1 ES k2 k-2 E + P k1, k-1, k2 – константы скорости – указывают на скорость или эффективность реакции Уравнение Michaelis-Menten Vmax[S] vo = Km + [S] Km – константа Michaelis; Vo – начальная скорость, [S]; Vmax – максимальная скорость Влияние концентрации фермента на скорость реакции При достаточной концентрации субстрата чем више концентрация фермента, тем више скорость реакции Ингибирование ферментов Разные химические агенты (метаболиты, аналоги субстратов, токсины, лекарственные средства, металлы) могут ингибировать активность ферментов Ингибитор – связывается с ферментом и предупреждает формирование комплекса ЕS или его расщепление к E + P Обратимые и необратимые ингибиторы Обратимые (образование FS комплекса) быстро диссоциирует Фермент угнетен только когда связан с ингибитором FS комплекс удерживается с помощью слабых нековалентных связей Три типа обратимого ингибирования: Конкурентное, Неконкурентное, Безконкурентное Обратимое ингибирование Конкурентное торможение •Ингибитор за структурой похожий на субстрат, поэтому связывается с тем же активным центром •Фермент не может распознать ингибитор и субстрат •Присоединение ингибитора к активному центру предупреждает связывание субстрата •Конкурентный ингибитор снижает скорость катализа уменьшая количество молекул фермента, связанных с субстратом •Ингибитор может быть вытеснен из активного центра путем увеличения концентрации субстрата Конкурентное торможение Бензамидин конкурирует с аргинином за связывание с трипсином Неконкурентное торможение • Ингибитор присоединяется не к активному центру, а к другому участку фермента • Ингибитор и субстрат могут связываться с ферментом в одно и то же время •Ингибитор может связываться как с ферментом (ЭИ) , так и с фермент-субстратным комплексом (ЭSИ) •Ингибитор не может быть вытеснен путем увеличения концентрации субстрата Безконкурентное торможение • Ингибитор присоединяется к ЭS комплексу но не к свободному Э • Встречается только в мультисубстратных реакциях Необратимое ингибирование Очень медленная дисоциация ЭИ комплекса Связываются ковалентными связями с ферментом Необратимые ингибиторы •ингибит оры специфические к группам аминокислот ных ост ат ков •аналоги субст рат ов •суицидные ингибит оры Ингибиторы специфические к группам аминокислотных остатков –реагируют со специфическими R группами аминокислот Характеристика активных центров Специфичность (абсолютная, относительная, стереоспецифичность) Маленький трёхмерный участок фермента. Субстрат взаимодействует только с 3-5 аминокислотными остатками. Остатки могут быть далеко один от другого в последовательности аминокислот. Связывает субстрат с помощью нековалентных слабых связей. Различают контактный и каталитический участок Сложный фермент в активном центре содержит кофактор или простетическую группу Активный центр лизоцима состоит из шести аминокислотных остатков Активные центры содержат функциональную группу (-OH, -NH, -COO и т.д.) Субстрат связывается с помощью множественных слабых нековалентных связей Теории механизма действия ферметов Теория Фишера (“ключ-замок”) Активный центр фермента (замок) способный прийнять только субстрат специфической формы (ключ) Теория Кошланда (индуцированной адаптации) Процесс присоединения субстрата индуцирует специфичиские конформации изминения в активном центре Свойства ферментов Специфичность действия 1.Абсолютная – один фермент действует только на один субстрат (уреаза расщепляет только мочевину; аргиназа расщепляет только арганин) 2.Относительная – один фермент действует на разные субстраты с одинаковым типом связи (пепсин расщепляет пептидный тип связи в молекуле белка, который состоит их различных а/к) 3.Стереоспецифичность – некоторые ферменты катализуют превращение только субстратов, которые находятся в геометрической конфигурации, цис- или транс- Зависимость активности от рН Каждый фермент проявляет максимальную активность при оптимальном pH Для большинства ферментов оптимум pH = ~7 (но есть исключения) Термолабильность зависимость активности фермента от температуры -Ферменты инактивируются при температуре выше 45-50oC -Большинство ферментов имеют температурный оптимум при 37o Классификация ферментов Общие названия Образуются добавлением суффикса –аза к названию субстрата Например: - тирозиназа – окисляет тирозин; - мальтаза – гидролизирует мальтозу Общие название не описывает химическую реакцию Тривиальные названия Например: пепсин, каталаза, трипсин. Не дають информации об субстрате, продукте или химизме реакции. Принципы международной класификации Шесть классов соответственно к типу реакции Каждый фермент имеет класcификационный номер,который состоит с четырех цифр: EC: 2.3.4.2 Первая цифра – класс фермента; вторая– подкласс; третья – подподкласс; четвёртая –номер фермента в подподклассе. Шесть классов ферментов 1. Оксидоредуктазы • Катализируют окислительно-восстонавительные реакции -Оксидазы -Пероксидзы -Дегидрогеназы 2. Трансферазы • Катализируют перемещение атомов или групп атомов 3. Гидролазы • Катализируют гидролитические реакции (расщепление с участием воды) - эстеразы - пептидазы - гликозидазы 4. Лиазы • Катализируют расщепление субстратов без участия воды с образованием двойной связи 5. Изомеразы • Катализируют реакции изомеризации 6. Лигазы (синтетазы) • Катализуют реакции синтеза • Нуждаются в энергии АТФ