Современные проблемы безопасности лекарственных средств
реклама

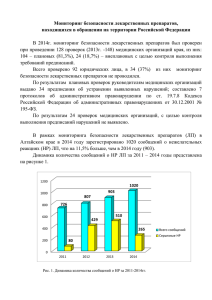
Современное состояние фармаконадзора в Российской Федерации В.К. Лепахин Федеральный Центр мониторинга безопасности лекарственных средств Росздравнадзора Современные лекарства подобны атомной энергии - они могут принести как огромную пользу, так и огромный вред. Сэр Деррик Данлоп Первый председатель Комитета по безопасности лекарств Великобритании статистика В 1994 г. в США серьезные побочные эффекты имели место у 2 216 000 госпитализированных больных. Из них в 106 000 случаях летальный исход. Pomeranz et al, JAMA, 279, 15: 1200 -1217 1998, статистика В США смертность и серьёзные повреждения в результате применения лекарственных средств в первом квартале 2008 года достигли рекордного уровня. В этот период было зарегистрировано: 4 825 смертельных случаев 21000 тяжёлых осложнений Это на 38% больше, чем за 1 квартал в прошлом году. статистика Ежегодно в Великобритании регистрируют около 2000 больных с кровотечениями из ЖКТ и 200 летальных исходов (на 11 млн. назначений) в результате применения НПВС Somerville K. et all Lancet 1996, 1, 462 ФАРМАКОНАДЗОР - это наука и деятельность, направленная на выявление, оценку, понимание и предупреждение неблагоприятных побочных эффектов и/или любых других возможных проблем, связанных с лекарственными средствами.* В настоящее время фармаконадзор включает в себя также мониторинг безопасности лекарственного растительного сырья, биологически активных добавок и вакцин. Определение ВОЗ What prompted their start? Birth of modern pharmacovigilance Thalidomide – Phocomelia 1961 1962год Ассамблея ВОЗ – Резолюция о безопасности лекарств Основные задачи сотрудничающего Центра ВОЗ по мониторингу лекарств сбор, анализ, систематизация сообщений о НПР на международном уровне; формирование международной базы данных о НПР; распространение информации; научно-исследовательская работа (разработка методов и стандартов для оценки риска и пользы и др.) международная гармонизация. Национальные Центры 52 стран мира являются членами Международной программы ВОЗ по мониторингу лекарств. АВСТРАЛИЯ АВСТРИЯ АРГЕНТИНА БЕЛЬГИЯ БОЛГАРИЯ ВЕЛИКОБРИТАНИЯ ВЕНГРИЯ ГЕРМАНИЯ ГРЕЦИЯ ДАНИЯ ИЗРАИЛЬ ИНДИЯ ИНДОНЕЗИЯ ИРЛАНДИЯ ИСЛАНДИЯ ИСПАНИЯ 1968 1991 1994 1997 1975 1968 1990 1968 1990 1968 1973 1998 1975 1968 1990 1984 ИТАЛИЯ КАНАДА КИТАЙ КОРЕЯ КОСТА-РИКА КУБА МАЛАЗИЯ МОРОКО НИДЕРЛАНДЫ НОВАЯ ЗЕЛАНДИЯ НОРВЕГИЯ ОМАН ПОЛЬША РОССИЯ РУМЫНИЯ СИНГАПУР 1975 1968 1997 1992 1991 1994 1990 1992 1968 1968 1971 1995 1972 1997 1976 1993 СЛОВАКИЯ США ТАЙЛАНД ТАНЗАНИЯ ТУНИС ТУРЦИЯ ФИЛЛИПИНЫ ФИНЛЯНДИЯ ФРАНЦИЯ ХОРВАТИЯ ЧЕХИЯ ЧИЛИ ШВЕЙЦАРИЯ ШВЕЦИЯ ЮЖНАЯ АФРИКА ЯПОНИЯ 1993 1968 1984 1993 1993 1987 1995 1974 1986 1992 1992 1996 1991 1968 1992 1972 В банке данных Центра Всемирной Организации Здравоохранения — более 4 млн сообщений о неблагоприятных побочных реакциях (НПР) на лекарственные средства Ежегодно поступает около 200.000 собщений о НПРЛ Пути обмена информацией о неблагоприятных побочных реакциях на лекарственные средства Штаб-квартира ВОЗ Сотрудничающий центр ВОЗ Медицинская практика Национальные Центры Фармацевтические фирмы Становление системы фармаконадзора в СССР и России 1969 год – организован Отдел учета, систематизации и экспресс информации о побочном действии лекарств 1973 год – создан Всесоюзный организационно-методический центр по изучению побочных действий лекарств Минздрава СССР Становление системы фармаконадзора в СССР и России 14 апреля 1997 года – создан Федеральный центр по изучению побочного действия лекарств Минздрава РФ (ФЦПДЛ) на базе кафедры общей и клинической фармакологии РУДН Октябрь 1997 год – организовано более 20 региональных центров контроля безопасности лекарств 2 декабря 1997 года – Россия принята в качестве полноправного члена в Программу ВОЗ по международному мониторингу лекарств ГОСУДАРСТВЕННОЕ РЕГУЛИРОВАНИЕ В Российской Федерации государственную функцию по организации проведения экспертизы качества, эффективности и безопасности ЛС выполняет Федеральная служба по надзору в сфере здравоохранения и социального развития (Росздравнадзор) ГОСУДАРСТВЕННОЕ РЕГУЛИРОВАНИЕ 26 октября 2007 г. Росздравнадзор создал Федеральный Центр мониторинга безопасности ЛС (ФЦМБЛС) на базе ФГУ «Научный центр экспертизы средств медицинского применения» Федеральному Центру делегированы полномочия по проведению мониторинга безопасности препаратов и экспертной оценки фактов и обстоятельств, угрожающих жизни и здоровью людей. 29 января 2008 года Росздравнадзор направил письма руководителям здравоохранения всех субъектов РФ со следующими РЕКОМЕНДАЦИЯМИ : Организовать в субъектах РФ региональные центры мониторинга безопасности лекарств, определив ответственные учреждения и\или подразделения по проблемам изучения НПР на ЛС Привлечь к организации работы по выявлению и регистрации НПР главных специалистов, центры и кафедры клинической фармакологии ВУЗов, а также клинических фармакологов ЛПУ Обеспечить контроль за своевременным представлением информации о НПР в региональные и федеральный центры мониторинга безопасности ЛС Список регионов РФ, где созданы Региональные центры мониторинга безопасности лекарственных средств Архангельская область Астраханская область Карачаево-Черкесская Республика Краснодарский край Курганская область Нижегородская область Омская область Оренбургская область Пермская область Приморский край Республика Башкортостан Республика Бурятия Республика Коми Республика Саха (Якутия) Республика Хакасия Рязанская область Самарская область Санкт-Петербург Саратовская область Ставропольский край Удмуртская Республика Ульяновская область Челябинская область Читинская область Чувашская Республика Список регионов, где создаются центры мониторинга безопасности лекарственных средств Амурская область Владимирская область Волгоградская область Воронежская область Еврейская автономная область Ивановская область Иркутская область Калининградская область Кемеровская область Кировская область Костромская область Липецкая область Новгородская область Орловская область Пензенская область Псковская область Республика Дагестан Республика Карелия Республика Северная Осетия –Алания Республика Татарстан Республика Тыва Тюменская область Хабаровский край Ханты-Мансийский автономный округ – Югра Для эффективного функционирования системы сбора и анализа информации о НПР необходимы: правовая база нормативные документы контроль за выполнением требований нормативных документов мотивация работников практического здравоохранения обучение субъектов обращения лекарственных средств кадровое, материальное и финансовое обеспечение работы Федерального и региональных центров МБЛ Федеральный закон «О лекарственных средствах» Статья 41. Обязанность субъектов обращения лекарственных средств сообщать о случаях побочных действий и об особенностях взаимодействия лекарственных средств с другими лекарственными средствами. п.1. Декларирует обязанность сообщать о побочных действиях, которые не соответствуют сведениям, содержащимся в инструкции п.2. Предусматривает дисциплинарную, административную или уголовную ответственность за несообщение или сокрытие сведений, предусмотренных п. 1. «Золотой стандарт» системы спонтанных сообщений 250 –300 сообщений/ 1 млн. жителей не менее 10 % врачей присылают сообщения о НПР Согласно «Золотому стандарту» фармаконадзора, в Российской Федерации, с населением 142 млн. чел. должно поступать 40-60 тысяч сообщений о НПР в год В 2007 году поступило 192 сообщения о НПР В 2008 году поступило 1040 сообщений о НПР Деятельность ФЦМБЛС Росздравнадзора Осуществляется практическая и научнометодическая работа с целью совершенствования выявления, оценки и профилактики нежелательных последствий применения лекарственных средств За период с января по декабрь 2008 г ФЦ МБЛС получено: Более 50 000 сообщений о НПР, из которых 1040 зарегистрированы на территории РФ. 709 поступило из РЦ и непосредственно от российских специалистов. 331 от зарубежных производителей ЛС. В 38 случаях выявлена неэффективность препаратов. Информация ФЦ МБЛС 860 сообщений о НПР, зарегистрированных на территории зарубежных стран, подвергнуты анализу с целью выявления летальных исходов и неблагоприятных исходов беременности. 34 Всего получено 617 сообщений о НПР, приведших к летальному исходу. Информация ФЦМБЛС Проанализировано 18 сообщений о неблагоприятном влиянии препаратов на исходы беременности. В 7 из них сообщалось о тератогенных эффектах пароксетина (3 случая), ламотриджина, варфарина и такролимуса. Информация ФЦ МБЛС Проведён анализ 316 Периодических отчетов по безопасности ЛС, полученных от зарубежных производителей ЛС, и подготовлена соответствующая информация для Росздравнадзора и региональных центров. Федеральная служба по надзору в сфере здравоохранения и социального развития Одобрено Учёным советом Научного центра экспертизы средств Медицинского применения 19 июня 2008 года МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО СОЗДАНИЮ И РАБОТЕ РЕГИОНАЛЬНЫХ ЦЕНТРОВ МОНИТОРИНГА БЕЗОПАСНОСТИ ЛЕКАРСТВЕННЫХ СРЕДСТВ Москва 2008 Федеральная служба по надзору в сфере здравоохранения и социального развития Одобрено Учёным советом Научного центра экспертизы средств Медицинского применения 19 июня 2008 года УТВЕРЖДАЮ Руководитель Федеральной службы по Надзору в сфере здравоохранения и социального развития МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ОПРЕДЕЛЕНИЮ СТЕПЕНИ ДОСТОВЕРНОСТИ ПРИЧИННО-СЛЕДСТВЕННОЙ СВЯЗИ «НЕБЛАГОПРИЯТНАЯ ПОБОЧНАЯ РЕАКЦИЯЛЕКАРСТВО» (классификация и методы) Москва 2008 Письмо Росздравнадзора от 02.12.2008 Руководителям медицинских учреждений организовать представление в Росздравнадзор информации о НПР или неэффективности лекарственных средств : - назначить ответственных лиц за осуществление мониторинга безопасности лекарственных средств в медицинских учреждениях, - - Обеспечить возможность регистрации НПР (заполнение электронной формы карты-извещения) на сайте - www.roszdravnadzor.ru в разделе «Фармаконадзор». - Для получения персонифицированного доступа (логина и пароля) медицинским учреждениям необходимо направить запрос в Росздравнадзор по электронной почте [email protected] Писльмо Росздравнадзора от 02.12.2008 В случае невозможности использования сети Internet Росздравнадзор предлагает руководителям медицинских учреждений : - ввести учётную форму «Извещение о неблагоприятной реакции на лекарственное српедство» в каждую историю болезни и в каждую амбулаторную карту, которая должна быть заполнена независимо от наличия или отсутствия НПР. - при развитии серьёзных НПР, а также неожиданных реакций, не отражённых в инструкции по применению ЛС, направлять информацию в Региональный центр мониторинга безопасности лекарств, а при отсутствии в регионе такого центра – в территориальное управление Росздравнадзора; - возложить на ответственных лиц контроль за своевременным информированием обо всех случаях развития НПР или неэффективности лекарственных средств. Письмо Росздравнадзора от 26.11.2008 Компаниям производителям или держателям регистрационных удостоверений предлагается организовать представление в Росздравнадзор информации о НПР на лекарственные средства: - назначить уполномоченного по фармаконадзору, - Обеспечить заполнение электронной карты-извещения о НПР на сайте www/roszdravnadzor.ru в разделе «Фармаконадзор». Для получения персонифицированного доступа (логина и пароля) Фармацевтическим компаниям необходимо направить запрос в Росздравнадзор и представить информацию согласно приложению Проблемы предоставления информации о НПР Экспресс-сообщения низкий уровень активности российских медицинских работников низкое качество присылаемых сообщений информацию предоставляют только некоторые крупные зарубежные компании отечественные производители ЛС полностью игнорируют работу по фармаконадзору Периодические отчеты о безопасности ЛС предоставляют только крупные западные фирмы Практическая деятельность ФЦМБЛС в рамках фармаконадзора Ведение базы данных по сообщениям о НПР на ЛС Анализ и систематизация полученных сообщений Представление информации о НПР региональным центрам и медицинским работникам Представление Росздравнадзору данных о НПР на ЛС, зарегистрированные в РФ Подготовка предложений по принятию соответствующих административных мер по предупреждению лекарственных осложнений. Информационная и образовательная работа ФЦ МБЛС Подготовлены 2 номера журнала «Безопасность лекарств и фармаконадзор». Информация о фармаконадзоре представлена на конференциях во Владивостоке, в Москве, Красноярске, Новосибирске, Рязани, Саратове, СанктПетербурге Информационная и консультативная работа ФЦМБЛС Постоянно проводится консультативная работа по вопросам безопасности лекарств с региональными центрами, ЛПУ, медицинскими и фармацевтическими работниками, фармацевтическим компаниями и населением. Примеры представления в Росздравнадзор информации о серьезных НПР Темпалгин табл. («Софарма», Болгария), серия 4350108 Анафилактический шок За месяц было зафиксировано 5 случаев вызова скорой помощи по аналогичной причине после приема табл. «Темпалгин». Смерть больного во Пентоксифиллин («Новосибхимфарм»), серия 791007 время инфузии: (инфузия 2% - 5мл в 0,9 % р-ре NaCl) Уважаемые коллеги! В ФЦМБ ЛС в марте 2008 г. из Омского регионального центра МБ ЛС поступило 16 сообщений о НПР на гепарин системного действия производства Московского эндокринного завода, применявшегося для снижения свертывания крови во время процедуры гемодиализа в дозах от 1250 до 10000 ЕД. В связи с этим просим Вас сообщать о всех побочных эффектах гепаринов с указанием производителя препарата и, по возможности, серии. Заранее благодарны. С уважением, ФЦ МБЛС Уважаемые коллеги! Посылаем Вам сообщение о НПР на р-р глюкозы пр-ва ОАО «Дальхимфарм». Просим Вас проявлять особую бдительность к НПР на препараты российского производства и сообщать обо всех НПР на эти препараты. Ваши сообщения - единственный источник информации о профиле и частоте НПР на отечественные препараты в медицинской практике, так как мы не получаем никакой информации по безопасности от российских производителей. С уважением, руководитель ФЦ МБЛС член-корр. РАМН, профессор В.К. Лепахин Уважаемые коллеги! В I квартале 2008 г. в Федеральный центр мониторинга безопасности ЛС (ФЦ МБЛС) поступило 3 сообщения о неэффективности противосудорожных средств, описание которых приводится в приложении. Если Ваши врачи наблюдали случаи неэффективности противосудорожных средств, особенно при переключении с одного препарата на другой, содержащий то же действующее вещество, убедительная просьба сообщать о них в ФЦ МБЛС. С уважением, ФЦ МБЛС ПЕРВОСТЕПЕННЫЕ ЗАДАЧИ НА БЛИЖАЙШЕЕ БУДУЩЕЕ Утверждение карты- извещения о НПР в качестве учётной формы Укрепление существующих и создание новых региональных центров Утверждение нормативно-правовых актов, регламентирующих работу фармаконадзора Срочно необходимо: Повышение ответственности производителей (особенно отечественных) за мониторинг безопасности лекарственных средств; активизация российских медицинских работников по сбору информации о НПР. Безопасность больных – это вопрос не только денег и технологий Ни деньги, ни технологии, ни приказы и даже законы не решат проблем безопасности лекарств. Центральное значение имеют политическая воля руководства (административная и финансовая поддержка системы фармаконадзора) и профессиональная и гражданская ответственность работников здравоохранения. Осложнения лекарственной терапии можно уменьшить!! Вы можете облегчить страдания и спасти жизнь тысячам пациентов, своевременно сообщив о подозреваемой неблагоприятной побочной реакции (НПР), в региональный или федеральный центр мониторинга безопасности лекарственных средств. Мы только в начале пути Новые возможности Новые перспективы Мы открыты для сотрудничества Федеральный центр мониторинга безопасности лекарственных средств Официальный адрес (для корреспонденции): Москва, 127051, Петровский бульвар, д.8. Фактический адрес: Москва, 123182, ул. Щукинская, д.6. Телефон: 8 (495) 234-61-04 * 3086, * 3093,*3091 Факс: 8 (499) 190-34-61 Сайт в интернете: www.regmed.ru (раздел «Фармаконадзор») Адрес электронной почты для сообщений о НПР: [email protected] Безопасность больных – это не только важная медицинская, социальная и экономическая проблема, это важная составная часть национальной безопасности страны ВАРИАНТЫ ФАЛЬСИФИКАЦИИ ЛЕКАРСТВ препарат не содержит действующего вещества, указанного на этикетке; препарат содержит действующее вещество указанное на этикетке, но в других количествах (больших или меньших); препарат содержит действующее вещество, которое не указано на этикетке; препарат содержит действующее вещество в указанных количествах, фальсификация касается производителя лекарств.