H 2 + Cl 2 = 2HCl (на свету) - Всероссийский фестиваль
реклама

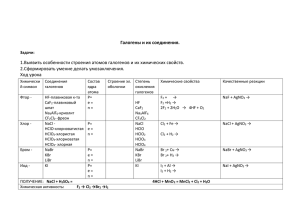
ВСЕРОССИЙСКИЙ ФЕСТИВАЛЬ ПЕДАГОГИЧЕСКОГО ТВОРЧЕСТВА 2015-2016 уч. года Номинация: Педагогические идеи и технологии Название работы: «Галогены» Автор проекта: Е.Г.Курбатова, учитель химии МБОУ СОШ № 70 г. Воронеж ОБЩАЯ ХАРАКТЕРИСТИКА • К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат At • Общее название - галогены (греч. «солеобразующие») большинство их соединений с металлами представляют собой типичные соли (KCl, NaCl и т.д.). )) 2 7 Хлор Cl ))) +17 3s23p5 2 8 7 Бром Br )))) +35 4s24p5 2 8 18 7 Иод I +53 ))))) 2 8 18 18 7 5s25p5 Неметаллические свойства +9 Окислительные свойства F 2s22р5 Радиус атома Фтор Электроотрицательность СТРОЕНИЕ АТОМА СТЕПЕНЬ ОКИСЛЕНИЯ 0 -1 НCL +1 CL2 Низшая степень окисления CL2O +3 CL2O3 +5 +7 CL2O5 И восстановители, и окислители CL2O7 Высшая степень окисления F – только окислитель, С.О. -1 СТРОЕНИЕ МОЛЕКУЛ • Молекулы галогенов состоят из двух атомов Cl + Cl → Cl Cl • Связь – ковалентная неполярная В твердом состоянии фтор, хлор, бром, йод имеют молекулярные кристаллические решётки Простые вещества - галогены Галоген Агрегатное состояние цвет запах F2 газ Светло-жёлтый Резкий. раздражающий CL2 газ Жёлто-зелёный Резкий удушающий Сильный зловонный резкий Br2 Жидкость Красно-бурый I2 Твёрдое , способное к возгонке Тёмно-серый, с металлическим блеском ХИМИЧЕСКИЕ СВОЙСТВА 1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании): -1 2Na + Cl2 2NaCl 2Fe + 3Cl2 2FeCl3 -1 2. Взаимодействие с неметаллами C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды. 5Cl2 + 2P -1 2PCl5 3. Взаимодействие с водородом H2 + F2 = 2HF (со взрывом) H2 + Cl2 = 2HCl (на свету) H2 + Br2 = 2HBr (при нагревании) H2 + I2 = 2HI (при нагревании, обратимая реакция) 4. Взаимодействие с водой с образованием смеси кислот 0 -1 Cl2 + H2О +1 HCl + HClO соляная хлорноватистая 5. Взаимодействие с солями других галогенов более активные галогены вытесняют менее активные из растворов их солей 0 -1 -1 0 Cl2 + 2NaBr 2NaCl + Br2 6. Взаимодействие с растворами щелочей с образованием солей 2NaOH + Cl2 6NaOH + 3Cl2 NaCl + NaClO + H2O холодный раствор гипохлорит натрия t 5NaCl + NaClO3 + 3H2O горячий раствор хлорат натрия ПОЛУЧЕНИЕ ХЛОРОВОДОРОДА 1) В промышленности: синтезом из водорода и хлора: H2 + Cl2 = 2HCl 2) В лаборатории: NaCl (крист.) + H2SO4 (конц.) t = HCl↑ + NaHSO4 Соляная кислота Физические свойства: бесцветная, дымящая на воздухе жидкость, тяжелее воды Химические свойства: Типичная кислота С какими веществами взаимодействуют кислоты? Качественные реакции на галогенид-ионы Вещество, при реакции с которым HCl даст осадок 1. CuSO4 4.Ba(NO3)2 2. NaOH 3.AgNO3 HCl + AgNO3 → HNO3 + AgCl↓ HBr + AgNO3 → HNO3 + AgBr↓ HI + AgNO3 → HNO3 + AgI↓ HF ??? CaF2↓ К А Ч Е С Т В Е Н Н Ы Е Р Е А К Ц И И Распространенность в природе Плавиковый шпат - флюорит CaF2 галит NaCl сильвин KCl сильвинит KCl•NaCl Получение галогенов: F2 и Cl2 в промышленности получают электролизом расплавов или растворов их солей: ток 2NaCl эл. 2Na + Cl2 расплав ток H2 + Cl2 + 2NaOH 2NaCl + 2H2O эл. раствор Cl2 в лаборатории получают: MnO2 + 4HCl = MnCl2 + Cl2 + H2O Спасибо за внимание!