17_Лекция
реклама

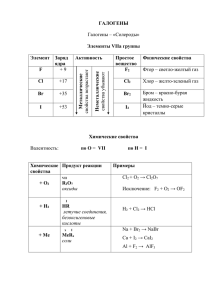
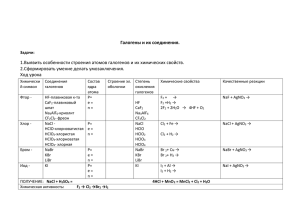
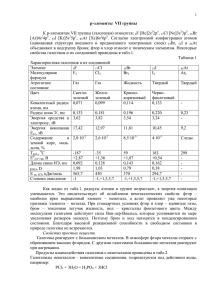
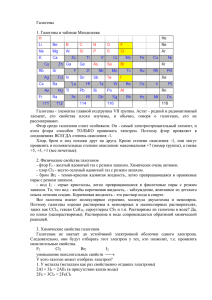
р-элементы VІІА группы. Галогены. р-элементы VІІІА группы. Благородные газы. F – флуор, Cl – хлор, Br – бром, I – йод, At – астат Химия фтора 2s 2р H 1s1 F 1s22s22p5 Cl 1s22s22p63s23p5 Br 3s23p63d104s24p5 I 4s24p64d105s25p5 At 4s24p64d105s25p65d106s26p5 История открытия галогенов 1774 г. Cl К. Шееле «Хлорос» – желто2 зеленый 1811 I2 Куртуа «Иодэс» г. фиолетовый 1826 г. Br2 Балар «Бромос» – зловонный 1866 г. F2 Анри Муассан «Фторос» разрушающий Открытие галогенов Хлор открыт шведским химиком К.Шееле в 1774 г. Йод получен в 1811 г. французским учёным Б.Куртуа. Фтор в свободном виде Бром открыт в 1826 г. французским химиком А.Баларом. получил впервые в 1886 г. французский химик Анри Муассан. Названия галогенов 1.Фтор от греческого «фторос» означает разрушающий 2.Хлор назван от греческого «хлорин» – светложелтый 3.Бром от греческого «бромос» - зловоние 4.Иод назван от греческого «иоэйдэс» – цвет фиалки, фиолетовый Строение атомов галогенов F Cl Br I At На R -1, 0 атома внешне м +7, энергет +5, ическо +3, м уровне +1, 0,-1 7 электро нов Только окисли тель Окислит ельные свойств Электронные формулы Фтор F 2s22p5 Хлор Cl Бром Br Йод I 3s23p5 4s24p5 5s25p5 Ряд активности галогенов F Cl Br Электроотрицательность в ряду убывает I F-I Степени окисления галогенов Периоды Периодическая система химических элементов Д.И.Менделеева Группы элементов 1 2 3 4 5 6 35,5 0 Cl2 +17 К.Шееле Характеристика элемента 1. Радиус атома F > Cl > Br 2. p – неметалл 1s22s22p63s23p64s24p5 Окислительные свойства: S < Cl > R2O5 RO3 BrR2O7 RO4 Лебедева Л.В. 12 RH3 H HR 4.2R Cтепень 3. 7 Высшие оксиды ЛВС R2 O R 2 O5 RO 09.05.2016 R2O3 RO2 RH4 Г.Деви Галогены – простые вещества Cl2 F2 I2 Br2 Простые вещества и их свойства Хлор жёлто– зелёный газ Бром красно – бурая жидкость СТРОЕНИЕ ГАЛОГЕНОВ – ПРОСТЫХ ВЕЩЕСТВ Hal2, ns2np5 Е Электронная диаграмма иона Hal: ns np Графическая формула молекулы: Hal – Hal. Электронная формула молекулы: •• : Hal • Hal •• В ряду F2, Cl2, Br2, I2 - rков, I, A, , Есв, lсв. Ковалентная неполярная связь, ТКР – молекулярная. Схема образования химической связи Cl – Cl ковалентная неполярная Физические свойства галогенов Веществ о Агрегатное состояние при обычных условиях Цвет Фтор Газ, не сжижается при обычной температуре Хлор Запах Температура плавления, °С Темпера тура кипения, °С Светло-жёлтый Резкий, раздражающи й -220 -188 Газ, сжижающийся при обычной температуре под давлением Жёлтозелёный Резкий, удушливый -101 -34 Бром Жидкость Буроватокоричневый Резкий, зловонный -7 +58 Иод Твёрдое вещество Чёрнофиолетовый с Резкий +114 +186 Химические свойства галогенов + Н2 Hal2 +неМе +Ме +1 -1 HHal +n -1 неМеHaln +n -1 МеHaln Взаимодействие с F2 + H2 = водородом 2HF фтороводород Cl2 + H2 = 2HCl хлороводород Br2+ H2 = 2HBr бромоводород I2+ H2 = 2HI йодоводород Vр уменьшается Взаимодействие с Галоген + металл = соль металлами 2Fe + 3Cl2 = 2FeCl3 Хлорид железа (III) 2Al + 3I2 = 2AlI3 Иодид алюминия Сu + Br2 = Cu Br2 Zn + F2 = ZnF2 ? ? Взаимодействие с водой • При взаимодействии с водой образуется смесь кислот • Cl2 + H2O = HCl + HOCl • I2 + H2O Взаимодействие с растворами щелочей • При взаимодействии с растворами щелочей образуется смесь солей На холоде • Cl2 + 2KOH = KCl + KOCl + H2O • I2 + KOH При нагревании • 3Cl2+KOH = 5KCl+KClO3+3H2O • 3I2+6KOH = 5KI+KIO3+H2O Качественная реакция на анионы • Серебро Ag осаждает галогены • Ag+ + Cl- = AgCl • Ag+ + Br- = AgBr • Ag+ + I- = AgI Белый осадок Желтоватый осадок Желтый осадок Галогены в природе Природные соединения фтора Плавиковый шпат (флюорит) CaF2 Природные соединения фтора Криолит Na3AlF6 Природные соединения хлора Каменная соль (галит) NaCl Применение галогенов производство соляной кислоты получение лекарственных препаратов дезинфекция воды красители и цветная фотография отбеливание фториды хлор ПРИМЕНЕНИЕ фтор фтор иод ГАЛОГЕНОВ – ПРОСТЫХ ВЕЩЕСТВ тефлон лекарственные препараты бром лекарственные вещества ингибиторы воспламенения ветеринарные препараты Допишите уравнения химических реакций, которые практически осуществимы a ) NaCI CI 2 б)NaI CI 2 в ) NaF F2 г)? AgNO 3 AgBr HNO3 д)NaBr ? NaCI ? е)KI ? AgI ? Химические свойства фтора SiO2 + 2F2 = SiF4 + O2; 2H2O + 2F2 = 4HF + O2. S + 3F2 = SF6, H0298 = - 1207 кДж/моль; 2P + 5F2 = 2PF5, H0298 = - 3166 кДж/моль. Xe + 2F2 = XeF4, H0298 = - 252 кДж/моль. Хлор – активный окислитель: 1/2Cl2(г) + 1e Cl-(г), G= -240 кДж/моль 1/2Cl2(г) + 1e Cl-(р), G= -131 кДж/моль Cl2 + NaOH NaClO + NaCl + H2O 3Cl2 + 6NaOH 5NaCl + NaClO3 + 3H2O 3Cl2 + 6KOH 5KCl + KСlO3 + 3H2O. С металлами: 2Fe + 3Cl2 = 2FeCl3; Cu + Cl2 = CuCl2. С неметаллами: H2 + Cl2 = 2HCl 2S + Cl2 = S2Cl2 Si + 2Cl2 = SiCl4 2P + 5Cl2 = 2PCl5. С O2, N2, C хлор не реагирует. 2FeCl2 = Cl2 = 2FeCl3 H2SO3 + Cl2 + H2O = H2SO4 + 2HCl Получение хлора MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O 2KMnO4 + 16HCl = 2KCl + 2MnCl2 + Cl2 + 8H2O. KClO3 + 6HCl = KCl + 3Cl2 + 3H2O K(-) 2Na+ + 2e = 2Na A(+) 2Cl- -2e = Cl2 H2 + Cl2 = 2HCl NaCl + H2SO4 = NaHSO4 + HCl 2NaCl + H2SO4 = Na2SO4 = 2HCl Кислородсодержащие соединения хлора He – гелий, Ne – неон, Ar – аргон, Kr – криптон, Xe – ксенон, Rn – радон Благородные газы Фториды Xe 1. (Бартлетт, 1962) Xe + PtF6 = Xe[PtF6] 2. Фториди Xe –Xe: XeF2 XeF4 XeF6 Гидролиз: 2XeF2 + 2H2O = 2Xe + 4HF + O2 медленно 6XeF4 + 12H2O = 2XeO3 + 4Xe + 24HF + 3O2 XeF6 + 3H2O = XeO3 + 6HF Фторирующие агенты, окислители XeF6 > XeF4 > XeF2 S + 3XeF2 = SF6 + 3Xe 2Ir + 5XeF2 = 2IrF5 + 5Xe 2XeF6 + SiO2 = 2XeOF4 + SiF4 5XeF2 + 2MnSO4 + 2H2O = 5Xe + 2HMnO4 + 10HF + 2H2SO4 Кислородсодержащие соединения Xe Оксиды Xe: XeO3 XeO4 Получение: XeF6 + 3H2O = XeO3 + 6HF Na4XeO6 + 4H2SO4 (конц) = XeO4 + 4NaHSO4 + 2H2O Свойства: XeO3 + KOH = K[HXeO4] 2K[HXeO4] + 2KOH (к) = Xe + O2 + K4XeO6 + H2O K4XeO6 + 2Na2SO4 + 8H2O = Na4XeO6·8H2O↓ + 2K2SO4 Окислители:5XeO3 + 6MnSO4 + 9H2O = 5Xe + 6HMnO4 + 6H2SO4 K4XeO6 + 4MnO2 + 4KOH = 4K2MnO4 + Xe + 2H2O Другие соединения Xe 1. Соли Xe2+: [XeF]ClO4 + HClO4 (конц) = Xe(ClO4)2 + HF XeF2 + HSO3F = Xe(SO3F)2 2. Xe–Cl, Xe–N: XeF2 + NaCl + 2SbF5 = [XeCl][Sb2F11] + NaF XeF2 + HN(SO2F)2 = FXeN(SO2F)2 + HF Соединения Kr, Rn Kr + F2 = KrF2 KrF2 + MnF2 = MnF4 + Kr 7KrF2 + Au = 2[KrF][AuF6] + 5Kr KrF2 + SbF5 = [KrF][Sb2F11] + [Kr2F3][SbF6] 3Rn + 2ClF3 = 3RnF2 + 2Cl2