ПРОВЕРЬ СЕБЯ
реклама

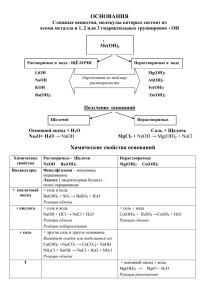
ПРОВЕРЬ СЕБЯ 1.Формула кислоты это: а) NaOH в) CuCL2 б) HCL г) SO3 2. Лакмус в растворе сернистой кислоты имеет цвет: а) синий в) фиолетовый б) красный г) малиновый 3. С раствором серной кислоты взаимодействует: а) оксид магния в) оксид фосфора б) оксид углерода г) сера 4. Соляная кислота не взаимодействует с металлом: а) алюминием в) серебром б) железом г) цинком 5. Пара ионов, которая может одновременно находится в растворе: а) H+ и SiO3 в) Н+ и SO42б) Cu 2+ и ОНг) Ag+ и CL6. Пара веществ взаимодействующих друг с другом: а) H2SO4 u SiO2 в) Сu u H3PO4 б) CuO u Na2O г) НСL u NaOH ОТВЕТЫ 1. 2. 3. 4. 5. 6. Б Б А В В Г Основанияэлектролиты, при диссоциации которых образуются катионы металла и гидроксид анионы Классификация оснований основания ОДНОКИСЛОТНЫЕ LiOH ДВУХКИСЛОТНЫЕ Mg(OH)2 СИЛЬНЫЕ Ba(OH)2 СЛАБЫЕ NH4OH РАСТВОРИМЫЕ NaOH НЕРАСТВОРИМЫЕ Cu(OH)2 Типичные реакции оснований I. Диссоциация + NaOH → Na +OH Ca(OH)2 → + 2 Ca +2OH II Кислота + основание = соль + вода • растворимые H2SO4 +2NaOH → Na2SO4 + 2H2O 2H+ +SO42- + 2Na ++ 2OH- → 2Na ++ SO42- + 2H2O H+ +OH- → H2O • нерастворимые Mg(OH)2 + 2 HCL → MgCL2 + 2H2O Mg(OH)2 + 2H+ +2Cl- → 2H2O + Mg2++ 2ClMg(OH)2 + 2H+ → 2H2O + Mg2+ III Основание + оксид неметалла = соль + вода СO2 + 2NaOH → Na2CO3 + H2O СO2 + 2Na+ +2OH- → H2O + 2Na+ +CO32СO2 + 2OH- → H2O + CO32SO3 + Ca(OH)2 → CaSO4 + H2O SO3 + Ca2+ +2OH- → H2O + Ca2+ SO42SO3 + 2OH- → H2O +SO42- IV Основание + соль = новое основание + новая соль Условия: - в результате реакции должны получиться газ, осадок. 1. Образование осадка MgCL2 + 2NaOH → 2NaCl + Mg(OH)2 Mg2+ +2Cl- + 2Na+ +2OH- →Mg(OH)2 + 2Na+ +2Cl- Mg2+ + 2OH- → Mg(OH)2 IV Основание + соль = новое основание + новая соль 2. Образование газа NH4Cl+KOH → KCl + NH3 + H2O NH4+ + Cl- +K+ +OH- → K+ +Cl- + NH3 + H2O NH4+ +OH- → NH3 + H2O V нерастворимые основания разлагаются t Cu(OH)2 → СuO + H2O Домашнее задание: • § 39 упр 1,2. привести свои примеры на каждое химическое свойство оснований.