Лекция 11. Электрохимия
реклама

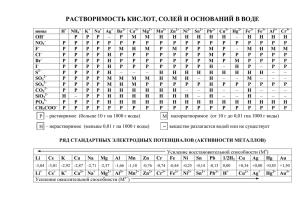
ОСНОВЫ ЭЛЕКТРОХИМИИ Электрохимические процессы Электрохимия - это наука, которая изучает процессы, либо протекающие с возникновением электрического тока, либо вызванные электрическим током. Второй способ проведения ОВР Гальванический элемент Якоби- Даниэля электродные процессы: _ e Zn (-) A: Zn0 – 2e Cu (+) K: Cu2+(р-р) + 2e Zn2+(р-р) Cu0 Zn + Cu2+ = Zn2+ + Cu Zn + CuSO4 = ZnSO4 + Cu ZnSO4 CuSO4 Краткая схема Г.Э.: (-) А: Zn| ZnSO4|| CuSO4|Cu (+)K Электродвижущая сила (ЭДС) E ок ль в ль Возникновение электродного потенциала Mez+(металл) Mez+(раствор) Cu Zn +φ +φ ∆ φ = φ+ ∆ φ = φ– электродный потенциал –φ –φ При изучении потенциалов различных электродных процессов установлено, что их величины зависят от трех факторов: 1) от природы веществ - участников электродного процесса, 2) от соотношения между концентрациями этих веществ и 3) от температуры системы. Эту зав-сть выражает (В. Нернст, 1889 г.): RT Ox 2 ,3 lg nF Re d 0 0 ,059 Ox lg Re d n 0 Me n Me 0 0 ,059 lg Me n n 0 Водородный электрод Для построения численной шкалы электродных потенциалов нужно потенциал какого-либо электродного процесса принять равным нулю. В качестве эталона для создания такой шкалы принят электродный процесс 2Н+ + 2е- = Н2. Изменение энергии Гиббса в этой полуреакции при стандартных условиях, принимается равным нулю. Стандартный потенциал данного электродного процесса принят также 0 равным нулю. H Рис. 3. Водородный электрод. Ho 2 0 φ = φ° + 0,059 lg[H+] - 0,030 lgpH2 φ = φ° + 0,059 lg[H+] = 0,059 lg[H+]. учитывая, что lg[H+] = - рН, получаем: φ = - 0,059 рН. Pt, H2 | H2SO4 || H2SO4 | H2, Pt φ1 = - 0,059 рН1 φ2 = - 0,059 рН2 E 0 ,059 pH е– К: 2Н2 + ОН– + 4е– = 4Н2О А: О2 + 2Н2О = 4ОН–+ 4е– Н2O Н2 ОН– КОН + ΔЕтеор = 1,229 В О2 ΔЕпракт = 0,7 – 0,9 В Задача 1. Определить знаки электродов в гальван. эл-те Co|CoCI2||AICI3|AI, указать анод и катод, объяснить механизм возникновения тока в данном элементе. Решение: 0 Co 0 ,27 B 2 / Co0 0Al 3 / Al 0 1,66 B е– А(-) (+)К Возникновение эл.тока в данном ГЭ связано с разной поляризацией электродов и протеканием ОВР. Задача 2. Составьте схему гальван. эл-та, в основе к-рого лежит рция: Mg+SnCI2MgCI2+Sn. Напишите электронные ур-ния анодного и катодного процессов. Вычислите ЭДС этого элемента, если Mg2+=0,01моль/л, Sn2+=0,0001моль/л. Решение: A(_) (+)K 0 Mg 2 ,38 B 2 / Mg0 А: Mg – 2е– = Mg2+ 0 Sn 0 ,136 B 2 / Sn0 К: Sn2+ + 2е– = Sn E 0 Sn 2 0 ,059 2 0 lg Sn Mg 2 Sn0 2 0 ,059 2 lg Mg Mg0 2 =(-0,136) + 0,059/2(lg0,0001) – (-2,38) – 0,059/2(lg0,01)= 2,244 – 0,059 = +2,185 B E 0 Sn 2 Sn0 0 ,059 0 lg Sn2 Mg 2 2 Mg0 0 ,059 0 ,059 ( 0 ,136 ) lg 0 ,0001 ( 2 ,38 ) lg 0 ,01 2 2 2 ,244 0 ,059 2 ,185 B lg 10n n 0 ,059 lg Mg 2 2 lg 104 4 Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd →Co→Ni→Pb→H→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au lg 10n n RT Re d 1 Ox 2 E E ln nF Ox1 Re d 2 0