23_Äèô. Ñêàí.Ìèêð
реклама

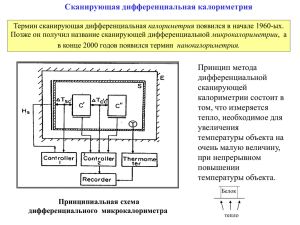
Сканирующая дифференциальная калориметрия Термин сканирующая дифференциальная калориметрия появился в начале 1960-ых. Позже он получил название сканирующей дифференциальной микрокалориметрии, а в конце 2000 годов появился термин нанокалориметрия. Принцип метода дифференциальной сканирующей калориметрии состоит в том, что измеряется тепло, необходимое для увеличения температуры объекта на очень малую величину, при непрерывном повышении температуры объекта. Белок Принципиальная схема дифференциального микрокалориметра тепло тепло Простейшие фазовые переходы: плавление, льда, кипение воды пар вода 100% кооперативность лед T При плавлении 1 г льда надо затратить ~ 80 кал; при испарении 1 г воды ~ 540 кал; Денатурация небольшого глобулярного . белка Принципиальные отличия денатурации белков от плавления льда или испарения воды Плавление однодоменного глобулярного белка (лизоцим). Базовая линия получена от заполнения обеих кювете растворителем. Измеряемые параметры: 1) Масса белка в ячейке М, вычисляемая из концентрации белка C в г/см3 и объема ячейки V в см3 Площадь А Полуширина ΔТ 2) Нормированная площадь под кривой А (в кал) 3) Полуширина перехода ΔТ ΔСp 3) Температура в точке перехода Tд. 4) Разность теплоемкостей до и после перехода Cp Температура в точке перехода Тд Вант Гоффовская (эффективная) энтальпия рассчитывается исходя из предположения, что все молекулы перешли из одного состояния в другое, или как говорят переход происходит по принципу «все или ничего» ΔHэфф. = 4RTd2/ΔT ΔHрасч = 4RTd2/ΔT ΔHэкспер = f (C, М, A, ΔТ, Td) Hv’tH = Htr Hv’tH = 0.5 Htr Когда калориметрическая энтальпия и энтальпия Вант Гоффа равны, тогда вся молекула представляет собой один кооперативный домен, и переход происходит по принципу «все или ничего Соотношение калориметрической (экспериментальной) и вант Гоффовской (расчетной) теплот денатурации ΔHэкспер = f (C, М, A, ΔТ, Td) ΔHрасч = 4RTd2/ΔT Hv’tH = Htr Когда кооперативно плавящийся термодинамический домен распространяется на целую молекулу, то тогда ван Гоффовская и калориметрическая теплоты совпадают . Hv’tH = 0.5 Htr Когда кооперативно плавящийся термодинамический домен распространяется только на часть молекулы, тогда ван Гоффовская и теплота меньше чем калориметрическая. Hv’tH = 2 Htr + + Когда ван Гоффовская теплота больше чем калориметрическая, то это означает, что кооперативный домен больше целой молекулы. Последнее означает, что молекула плавится из димерного состояния. Разворачивание белка в растворителе Внутренние белковые контакты разрушаются при разворачивании и заменяются на контакты с растворителем. Изменения энтальпии и энтропии при разворачивании могут быть положительными и отрицательными. Выигрыш в конфигурационной энтропии цепи может компенсироваться потерей конфигурационной свободы молекулами растворителя Эффект pH Кривые плавления растворов белка (барназа) при различных значениях pH (указаны над каждой кривой). Стабильность мутантов Кривые плавления раствора белка (T4 лизоцим) при разных pH (2.8, 3.0, 3.5, 3.7 , слева направо). Кружками показаны данные для его мутанта (S44A при pH 4.0) Сложные белки: Миозин HMM S-1 TR 3 5 2 1 LF-3 6 4 HMM S-3 LF-2 HMM S-2 LF-5 LMM HMM LMM trypsin LMM pepsin LF-3 TR Кривые плавления миозиновых фрагментов в 0.5 M KCl, 25 мM натрий фосфатный буфер, pH 6.5. Hexameric glutamate dehydrogenases from the hyperthermophilies Pyrococcus furiosus (100oC) and Thermococcus litoralis (88oC) Relative heat capacity of glutamate dehydrogenases (GluDHs) between 90oC and 130oC. (Vetrani et al., 1998)