СТРОЕНИЕ АТОМА ОСНОВЫ ХИМИИ. ЛЕКЦИЯ 2
реклама

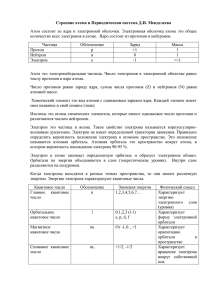
СТРОЕНИЕ АТОМА ОСНОВЫ ХИМИИ. ЛЕКЦИЯ 2 МОДЕЛЬ СТРОЕНИЯ АТОМА 1911 г. Эрнест Резерфорд (Ernest Rutherford) вещества, состоящая из положительно заряженного ядра и вращающихся вокруг него отрицательно заряженных электронов Планетарная модель атома Атом - мельчайшая частица 1913 г. Нильс Бор (Niels Bohr) Теоретически обосновал эту модель и выдвинул первую квантовую теорию атома Диаметр ядра атома 10-14 ÷ 10-15 м Модель Резерфорда-Бора -9 -11 Диаметр атома 10 ÷ 10 м В ядре сосредоточено 99,97% всей массы атома Плотность ядра атома 1014 г/см3 ЭЛЕМЕНТАРНЫЕ ЧАСТИЦЫ Атом состоит из субатомных (элементарных) частиц - протонов, нейтронов, электронов ЭЛЕМЕНТАРНАЯ ЧАСТИЦА ОТНОСИТЕЛЬНАЯ МАССА ОТНОСИТЕЛЬНЫЙ ЗАРЯД ДЕЙСТВИТЕЛЬНАЯ МАССА (кг) ДЕЙСТВИТЕЛЬНЫЙ ЗАРЯД (кл) Протон p 1 +1 1,672×10-27 + 1,6×10-19 Нейтрон n 1 0 1,672×10-27 0 Электрон ē 0 -1 9,11×10-31 - 1,6×10-19 Атомное ядро состоит из нуклонов: протонов и нейтронов Нуклоны – ядерные частицы. Общее число нуклонов равно массовому числу А A=Z+N Z - число протонов = порядковому номеру элемента N – число нейтронов Число ē = числу протонов = Z МОДЕЛЬ АТОМА РЕЗЕРФОРДА Противоречия модели Резерфорда: Не могла объяснить устойчивость атома Основные черты этой модели - наличие в атоме положительно заряженного тяжелого ядра, окруженного электронами (электрон, вращающийся вокруг ядра должен испускать электромагнитную энергию в виде световых волн и, следовательно, терять часть своей энергии, и двигаясь по спирали (для восстановления равновесия, перемещаясь ближе к ядру), падать на ядро, в результате чего атом прекратит своё существование) Не могла объяснить наличия у атомов линейчатых спектров АТОМНЫЕ СПЕКТРЫ - ВИДЕО http://www.youtube.com/watch?v=qly4Qb5xgfk&feature=related http://www.youtube.com/watch?v=w1gSjzc3m7U&feature=related АТОМНЫЕ СПЕКТРЫ Атомные спектры – спектры, получающиеся при излучении свободными или слабо связанными атомами (в газах или парах) Раскаленные твердые или жидкие тела дают сплошной или непрерывный спектр Излучение, испускаемое раскаленными газами и парами, содержит только определенные длины волн (дискретный или линейчатый спектр) Спектр атома азота Спектр атома водорода КВАНТЫ В 1900 году немецкий физик Макс Планк показал, что вещества поглощают и испускают лучистую энергию не непрерывно, а отдельными (дискретными) порциями - квантами. Энергия кванта Е связана с частотой излучения соотношением, получившим название уравнения Планка: E = ħ E - энергия кванта, Дж ħ - постоянная Планка ħ = 6,6256·10-34 Дж – частота излучения, = с/λ, где с - скорость света, м/с λ - длина волны, м Max Planck (1858-1947) СТРОЕНИЕ АТОМА ВОДОРОДА ПО БОРУ В своей теории Н. Бор исходил из: модели атома Э. Резерфорда положений квантовой теории света ПОСТУЛАТЫ* БОРА (1) ПЕРВЫЙ ПОСТУЛАТ Электрон вращается вокруг ядра только по стационарным круговым орбитам, находящимся на строго определенных расстояниях от ядра. На каждой такой орбите электрон обладает определенной энергией. Чем дальше от ядра расположена орбита, тем большей энергией обладает находящийся на ней электрон. Момент количества движения (момент импульса) электрона, вращающегося вокруг ядра: m -масса электрона, кг v - скорость движения электрона, м2/с r - радиус орбиты, м n - главное квантовое число (номер орбиты) ħ - постоянная Планка Радиус первой орбиты 0,53·10-10 м *Постулат – утверждение, принимаемое без доказательств Орбиты, удовлетворяющие уравнению Бора, называют стационарными или дозволенными орбитами ПОСТУЛАТЫ БОРА (2) Атом тем более устойчив, чем ниже его энергия Атом водорода обладает минимальной энергией, когда электрон находится на первой орбите (n=1) Устойчивое состояние атома с минимальной энергией называется основным или нормальным В основном состоянии атом может находиться как угодно долго При переходе электрона на более высокие орбиты (более отдаленные от ядра) требуется затратить энергию. Атом при этом переходит в возбужденное состояние Возбужденное состояние атома неустойчиво (для атома водорода при n=2,… 3, … и т. д.) ПОСТУЛАТЫ БОРА (3) ВТОРОЙ ПОСТУЛАТ При движении на стационарной орбите электрон не излучает электромагнитной энергии ТРЕТИЙ ПОСТУЛАТ При переходе электрона с одной стационарной орбиты на другую электрон поглощает или излучает квант энергии Екванта = W2 – W1 ПОСТУЛАТЫ БОРА (4) Теория Бора: •не смогла объяснить поведение электрона в магнитном поле • не смогла объяснить все атомные спектральные линии (мультиплеты – близко расположенные друг к другу линии) •оказалась непригодной для многоэлектронных атомов Niels Henrik David Bohr 1885 -1962 КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА Двойственная природа электрона (корпускулярно-волновой дуализм): электрон является частицей (корпускулой) электрон является волной mē = 9,1·10-31 кг vē = 106 м/с ħ = 6,63·10-34 Дж Луи де Бройль, 1924 г. длина волны движущегося электрона λ=10-10 м (1 Å) КВАНТОВО-МЕХАНИЧЕСКАЯ МОДЕЛЬ АТОМА Ervin Schrödinger 1887–1961 Уравнение Шрёдингерауравнение движения квантовой частицы Учитывает обе формы движения электрона ОРБИТАЛИ (1) Электронное облако или орбиталь – область пространства вблизи ядра атома, для которой вероятность нахождения электрона составляет не менее 0,95 http://www.youtube.com/watch?v=OUrFJE60ggo&feature=related ОРБИТАЛИ (2) Формы орбиталей: http://www.youtube.com/watch?v=K-jNgq16jEY&feature=related КВАНТОВЫЕ ЧИСЛА ЭЛЕКТРОНА (1) Атомные орбитали электрона, их энергия и направление в пространстве зависят от четырех параметров – квантовых чисел: 1. Главное квантовое число n Орбитальное квантовое число l Магнитное квантовое число ml Спиновое квантовое число ms 2. 3. 4. КВАНТОВЫЕ ЧИСЛА ЭЛЕКТРОНА (2) Главное квантовое число n определяет энергию электрона и размеры электронных орбиталей. Характеризует общий запас энергии или энергетический уровень. Принимает значения от 1 до ∞. Главное квантовое число n 1 2 3 4 5 6 7 Обозначение энергетического уровня K L M N O P Q КВАНТОВЫЕ ЧИСЛА ЭЛЕКТРОНА (3) Орбитальное квантовое число ℓ определяет форму атомной орбитали, характеризует энергетические подуровни. ℓ = 0 … (n-1) Орбитальное квантовое число ℓ 0 1 2 3 4 Подуровень s p d f g КВАНТОВЫЕ ЧИСЛА ЭЛЕКТРОНА (4) Различным значениям n отвечает разное число возможных значений ℓ n Обозначение орбиталей ℓ 1 0 1s 2 0,1 2s, 2p 3 0,1,2 3s, 3p, 3d 4 0,1,2,3 4s, 4p, 4d, 4f 5 0,1,2,3,4 5s, 5p, 5d,5f, 5g При помощи главного и орбитального квантовых чисел можно точно определить, на каком энергетическом уровне и на орбитали какого типа расположен электрон КВАНТОВЫЕ ЧИСЛА ЭЛЕКТРОНА (5) Магнитное квантовое число ml Характеризует ориентацию орбитали в пространстве Под воздействием внешнего магнитного поля происходит расщепление подуровней ml = - ℓ … 0 … + ℓ КВАНТОВЫЕ ЧИСЛА ЭЛЕКТРОНА (6) Спиновое квантовое число ms Характеризует собственный момент движения электрона У спина может быть лишь две ориентации во внешнем поле – по полю или против поля ms = +1/2 и -1/2 Квантовые числа - видео http://www.youtube.com/watch?NR=1&v=rCS-MNyf_x0&feature=endscreen Строение атома - видео http://www.youtube.com/watch?v=Td8j04jm8sw&feature=related http://www.youtube.com/watch?v=RWQqL1pTaS4&feature=relmfu http://www.youtube.com/watch?v=joz2vm6hxTM&feature=relmfu