Текст по стоению атомаи ПС 2
реклама
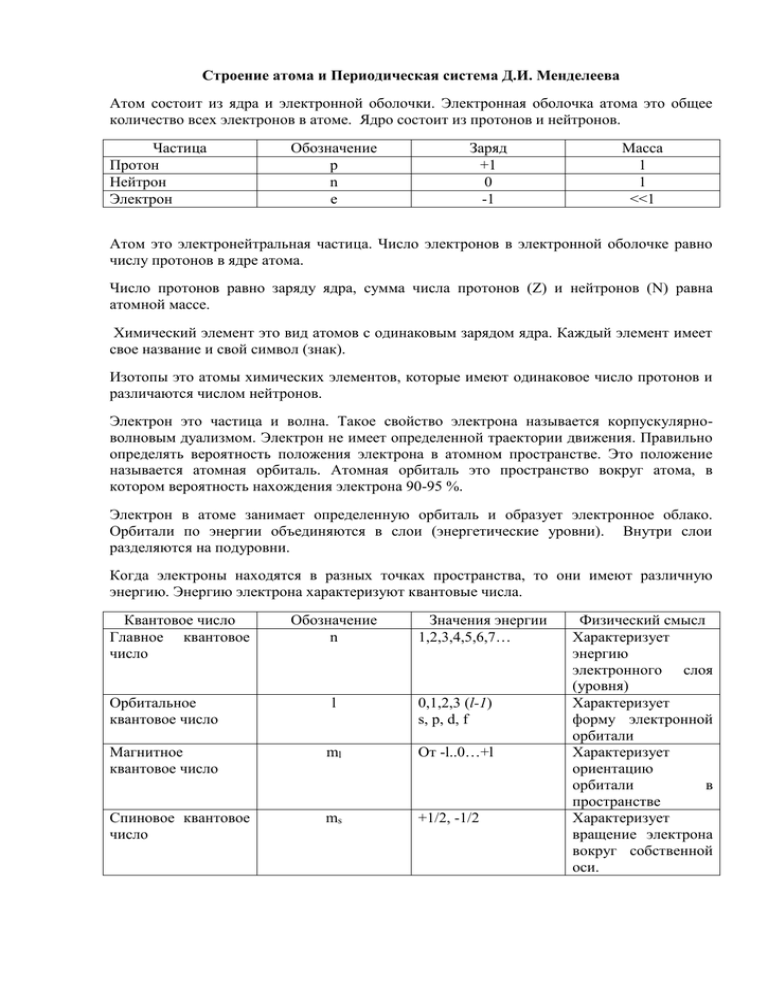
Строение атома и Периодическая система Д.И. Менделеева Атом состоит из ядра и электронной оболочки. Электронная оболочка атома это общее количество всех электронов в атоме. Ядро состоит из протонов и нейтронов. Частица Протон Нейтрон Электрон Обозначение p n e Заряд +1 0 -1 Масса 1 1 <<1 Атом это электронейтральная частица. Число электронов в электронной оболочке равно числу протонов в ядре атома. Число протонов равно заряду ядра, сумма числа протонов (Z) и нейтронов (N) равна атомной массе. Химический элемент это вид атомов с одинаковым зарядом ядра. Каждый элемент имеет свое название и свой символ (знак). Изотопы это атомы химических элементов, которые имеют одинаковое число протонов и различаются числом нейтронов. Электрон это частица и волна. Такое свойство электрона называется корпускулярноволновым дуализмом. Электрон не имеет определенной траектории движения. Правильно определять вероятность положения электрона в атомном пространстве. Это положение называется атомная орбиталь. Атомная орбиталь это пространство вокруг атома, в котором вероятность нахождения электрона 90-95 %. Электрон в атоме занимает определенную орбиталь и образует электронное облако. Орбитали по энергии объединяются в слои (энергетические уровни). Внутри слои разделяются на подуровни. Когда электроны находятся в разных точках пространства, то они имеют различную энергию. Энергию электрона характеризуют квантовые числа. Квантовое число Главное квантовое число Обозначение n Значения энергии 1,2,3,4,5,6,7… Орбитальное квантовое число l 0,1,2,3 (l-1) s, p, d, f Магнитное квантовое число ml От -l..0…+l Спиновое квантовое число ms +1/2, -1/2 Физический смысл Характеризует энергию электронного слоя (уровня) Характеризует форму электронной орбитали Характеризует ориентацию орбитали в пространстве Характеризует вращение электрона вокруг собственной оси. Все химические элементы расположены в Периодической системе Д.И. Менделеева. Периодическая система состоит из восьми групп и семи периодов. Периоды первый, второй, третий состоят из одного ряда. Эти периоды называются малыми. Четвертый, пятый, шестой и седьмой периоды состоят из двух рядов. Эти периоды называются большими. Группы делятся на подгруппы. В каждой группе есть главная и побочная подгруппы. Главная подгруппа состоит из элементов малых и больших периодов. Побочная подгруппа состоит из элементов больших периодов. Каждый структурный элемент периодической системы имеет физический смысл. Элемент структуры Порядковый номер Физический смысл Равен заряду ядра. Равен общему числу электронов в атоме. Показывает число протонов в ядре. Номер периода Показывает число электронных слоев в атоме. Номер группы Показывает число валентных электронов. Показывает высшую степень окисления, показывает высшую валентность. В периодической системе есть общие закономерности. Характеристика По периоду (слева направо) В группе (сверху вниз) Заряд ядра возрастает возрастает Радиус атома убывает возрастает Сродство к электрону возрастает убывает Энергия ионизации возрастает убывает Электроотрицательность возрастает убывает Металлические свойства ослабевают (уменьшаются) усиливаются (увеличиваются) Неметаллические свойства усиливаются (увеличиваются) ослабевают (уменьшаются) По периоду происходит В группе происходит переход от типичного усиление металлических металла через амфотерный свойств и ослабление элемент к типичному неметаллических неметаллу.











