"СЕРИНОВЫЕ ПРОТЕАЗЫ" (904 Kbytes)
реклама

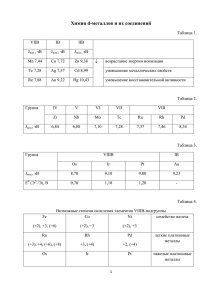
Сериновые протеазы Ковалентный катализ Сериновые протеазы • В активном центре остаток Ser • Система переноса заряда Ser …His …Asp • Ковалентный механизм катализа, нуклеофил — O боковой цепи Ser • Необратимо ингибируются: - диизопропилфторфосфатом (DFP) - фенилметансульфонилфторидом (PMSF) - хлорметилкетонами Каталитическая триада • • • • • His-Asp-Ser Химотрипсин Asp-His-Ser Субтилизин Ser-Asp-His Карбоксипептидаза Y Ser-His-Asp Clp-протеаза «нестандартные» сериновые протеазы Ser-Lys Ser-His-Glu Ser-His Трехмерная структура • «Внешний вид» α-химотрипсина Трехмерная структура • Схема трехмерной структуры α-химотрипсина • Выделены остатки каталитической триады Ser195 His57 Asp102 • и фрагмент пептидного субстрата Каталитическая триада + + ++ оксианионная впадина Субстрат-связывающий участок: карман S1 • Трипсин: Asp189, Gly216,Gly226 • Химотрипсин: Ser189 • Эластаза: Val216, Thr226 • Гранзим B Arg226 Активация профермента • Отрезается 15 остатков с N-конца • «Домен активации»: 142-152 184-193 216-223 меняет форму • Образуется солевой мостик Ile16…Asp194 • Формируется субстрат-связывающий участок Активация профермента • Отрезается 15 остатков с N-конца • «Домен активации»: 142-152 184-193 216-223 меняет форму • Образуется солевой мостик Ile16…Asp194 • Формируется субстрат-связывающий участок Механизм ковалентного катализа первый тетраэдрический аддукт второй тетраэдрический аддукт ацил-фермент Каталитический акт: накануне Тетраэдрический аддукт ацил-фермент • Нуклеофил — молекула воды Второй тетраэдрический аддукт • Расщепляется с образованием продуктов реакции Ацил-фермент можно наблюдать экспериментально • Светлый контур – pH 2 • Розовый контур – pH 10