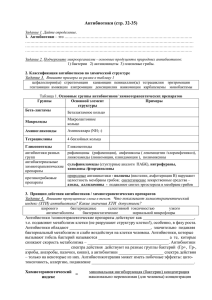
Препараты получаемые методами биотехнологии Антибиотики
реклама

Препараты получаемые методами биотехнологии Антибиотики Витамины Стероиды Антибиотики низкомолекулярные эффекторы изначально природного происхождения, способные подавлять рост живых клеток. В мире ежегодно производится антибиотиков на 20 млрд долларов. Антибиотики: противомикробные противоопухолевые препараты. Открытие антибиотиков произвело переворот в лечении инфекционных заболеваний. Ушли в прошлое представления о неизлечимости бактериальных инфекций (туберкулез, сепсис, сифилис и др.). Области применения антибиотиков: растениеводство, животноводство, ветеринария, пищевая промышленность и др.(используются более широко, чем в медицине). Организация крупномасштабного производства антибиотиков сыграла решающую роль в становлении промышленной биотехнологии.(биотехнический период) История вопроса 1871 А. Г. Полотебнов русский дерматолог впервые описал лечебные свойства этой плесени. 1928 А. Флемминг – установил способность нитчатого гриба зеленой плесени Penicillium notatum вызывать гибель микроорганизмов Количество открываемых антибиотиков постоянно растет. 1940 г. известно всего 6 антибиотиков, в настоящее время описано более 12 000 аналогичных соединений в том числе, около 200 препаратов применяют в клинике. 97% известных антибиотиков токсичны, поэтому в практике не используются. Примеры применения биотехнологии при создании лекарственных веществ Получение пенициллина С началом Второй мировой войны возникла острая потребность в антибактериальных средствах. В 1941 г. пенициллин впервые опробовали для лечения человека, страдающего от стафилококковой инфекции. Несмотря на наступившее в начале лечения кратковременное улучшение, пациент умер. У врачей было всего 3 г пенициллина. Этого для лечения оказалось недостаточно. Для получения пенициллина в количестве, достаточном Флеминг (Fleming) для излечения одного больного, требовалось переработать Александр (06.08.1881 около 1 000 л «грибного бульона». 11.03.1955), Нобелевская Надо было найти более активный продуцент, научиться премия по физиологии и культивировать его в огромных количествах и разработать медицине 1945 г. (совместно способ выделения пенициллина и получения его в чистом с Х. Флори и Э. Чейном) за виде. Эту задачу решили в 1943 г. в США: культуру гриба открытие пенициллина облучали рентгеновскими лучами и отбирали наилучших продуцентов. После повторения такой процедуры более 20 раз был получен подходящий штамм продуцента. И в настоящее время продолжают отбирать наиболее перспективные штаммы этого гриба. Продуктивность лучших из них составляет около 50 г пенициллина на 1 л питательного раствора. Ваксман Зельман Абрахам (1888 - 1973, Хайенис, США) микробиолог. Нобелевская премия 1952 по медицине и физиологии за создание стрептомицина Получение стрептомицина Для некоторых бактерий пенициллин безвреден. К таким бактериям относится и возбудитель туберкулеза – микобактерия. Однако уже в 1941 г. американский микробиолог З.Ваксман выделил из почвы микроорганизмы стрептомицеты. Эти организмы продуцируют вещество стрептомицин – чрезвычайно активный антибиотик, действующий в том числе и на возбудителя туберкулеза. Ваксман предложил называть антибиотиками (от греч. анти и биос – против жизни) все вещества, образуемые микроорганизмами и способные подавлять, повреждать или убивать других микробов. К настоящему времени выявлено около 5 тыс. различных антибиотиков, из которых в медицине применяется лишь около 100. Основная (химическая) классификация 1. β-Лактамные (пенициллины, цефалоспорины) составляют более 50% рынка антибиотиков. 2. Тетрациклины (тетрациклин, морфоциклин, метациклин). 3. Макролиды (эритромицин, олеандомицин). 4. Аминогликозиды (гентамицин, амикацин). 5. Гликопептиды (ванкомицин, ристомицин). 6. Амфениколы (левомицетин). 7. Линкосамиды (линкомицин). 8. Полиеновые [противогрибковые (нистатин, леворин)]. 9. Противоопухолевые (блеомицин) и др. Другие классификации По типу действия: 1. бактерицидные (лактамные, аминогликозиды), вызывающие гибель микроорганизмов, 2. бактериостатические (макролиды, тетрациклины, левомицетин), нарушающие способность микроорганизмов делиться. По спектру действия: узкого широкого действия. (тетрациклины, макролиды, аминогликозиды), «+» в случае неидентифицирова нных возбудителей По характеру воздействия на бактериальную болезни, клетку : «-» при длительном бактериостатические (бактерии живы, но не применении вызывают у в состоянии размножаться), пациентов бактерициды (бактерии умертвляются, но дисбактериоз физически продолжают присутствовать в среде), бактериолитические (бактерии умертвляются, и бактериальные клеточные стенки разрушаются). Механизмы действия 1) нарушение биосинтеза пептидогликанов клеточной стенки (пенициллины, ванкомицин, цефалоспорины); 2) нарушение отдельных этапов процессов трансляции (амфениколы, аминогликозиды, тетрациклины, макролиды, линкосамиды); 3) повреждения цитоплазматической мембраны (грамицидин, полимиксины); 4) нарушение биосинтеза нуклеиновых кислот (рифамицины, актиномицин D, противоопухолевые антибиотики); 5) нарушение энергетического обмена (олигомицин, хлоргексидин). Основные этапы микробиологического синтеза антибиотиков Культивирование микроорганизма - продуцента Отделение биомассы (центрифугирование, сепарирование, фильтрование) Биомасса Разрушение клеток (дезинтеграция, ферментативный лизис) Экстракция Отделение экстракта от разрушенных клеток (центрифугирование, мембранная фильтрация) Культуральная жидкость Концентрирование (ультрафильтрация, ИОХ и т.д.) Очистка целевого продукта (экстракция, ИОХ и т.д.) Приготовление ЛФ Производство антибиотиков этапы последовательных исследований 1. изыскание микроорганизмов (МО)-антагонистов в природе и выделение их в чистую культуру; 2. изучение спектра действия и определение антибиотической активности выделенных МО антагонистов: 3. подбор условий культивирования продуцентов антибиотиков; 4. первичная идентификация антибиотика на ранних этапах изучения: выделение и химическая очистка активно действующего начала из культуральной жидкости и клеток, сравнение полученного антибиотика по биологическим и химическим показателям с уже известными препаратами для выявления новых свойств полученных веществ; 5. изучение механизма действия и испытание токсических и лечебных качеств антибиотиков на животных; 6. разработка технологии получения антибиотика в лаборатории и внедрение ее в промышленное производство; 7. получение из исходных штаммов новых генотипов МО, обладающих повышенной активностью, путем мутаций и рекомбинаций методами генетической и клеточной инженерии. Альтернативные методические подходы к получению новых антибиотиков 1. химическая или биохимическая модификация молекулы исходного антибиотика для получения препарата с новыми свойствами; 2. направленная биохимическая модификация структуры, полученной химическим методом; 3. химический синтез с использованием природных структур в качестве шаблонов; 4. Мутасинтез: получение идиотрофов (мутантов - требующих для образования антибиотика определенный фрагмент его молекулы (предшественник); получение мутасинтона (аналога предшественника) химическими методами; культивирование идиотрофа на среде, содержащей мутасинтон. При этом идиотроф включает мутасинтон в молекулу продуцируемого им антибиотика. В результате получаются новые мутасинтетические структуры; 5. гибридизация (продуцент -генетический гибрид); гибридный антибиотик может содержать структуры двух различных метаболитов - продукт комбинации генов. Основные этапы получения гибридных антибиотиков: 1. выбор продуцента, образующего известный антибиотик; 2. изыскание нового МО для гибридизации; 3. исследование биохимических путей синтеза антибиотика, интермедиатов и ферментов; 4. определение генов, контролирующих образование ферментов биосинтеза и его регуляторов; 5. получение рекомбинантной ДНК, содержащей комбинацию генов, благоприятную для процесса биосинтеза; 6. клонирование новой генетической структуры в культуре реципиента; 7. химическое, микробиологическое и фармакологическое исследование нового антибиотика. способы управления процессами метаболизма продуцента Цель биотехнологии - на базе понимания физиологических и генетических свойств продуцента получить максимальный выход конечного продукта. 1. изменение состава питательной среды; 2. изменение условий внешней среды (температура, рН, аэрация); 3. конструкция биореактора (ферментера); 4. регламентирование введения дополнительного субстрата; 5. фиксация физиологического состояния культуры применением метода непрерывного культивирования; 6. использование генетически модифицированных штаммов продуцента. Продуценты антибиотиков Источники антибактериальных веществ: актиномицеты, плесневые грибы; бактерии, высшие растения; ткани животных и рыб. пенициллин - некоторые штаммы Penicillium notatum и P. chrysogenum, стрептомицин - определенный штамм Streptomyces griseus, - другие штаммы тех же видов либо вообще не вырабатывают антибиотики, либо вырабатывают, но другие. -Некоторые микроорганизмы выделяют не один, а несколько антибиотиков. Pseudomonas aeruginosa - пиоцианаза, пиоцианин, пиолипоевая кислота и др пиосоединения; Bacillus brevis - грамицидин и тироцидин; P. notatum - пенициллин и пенатин; Streptomyces rimosus - окситетрациклин и римоцидин; Streptomyces aureofaciens - хлортетрациклин и тетрациклин. -Один и тот же антибиотик может продуцироваться микроорганизмами разного рода. Глиотоксин - виды Gliocladium и Trichoderma, Aspergillus fumigatus и др. -Разные микроорганизмы или их штаммы могут вырабатывать разные химические формы одного и того же антибиотика, например разные пенициллины или различные формы стрептомицина. Неспорообразующие бактерии Bacillus pyocyaneus или Pseudomonas aeruginosa – пиоцианин, пиоцианаза, пиолипоевая кислота. различные штаммы кишечной палочки (Escherichia coli) - колицины, Спорообразующие бактерии. Аэробные спорообразующие грамположительные бактерии (бациллы) относятся к собственно бактериям. Как и все бактерии: не имеют ядра, геном более прост, т.е. содержит меньшее, чем у актиномицетов количество генов, не имеют митохондрий, клеточная стенка состоит из петидогликана. Жизненный цикл бактерий около полутора суток. штаммы Bacillus subtilis производят бацитрацин, субтилин и др.; B. Brevis – грамицидин С, тироцидин (тиротрицин); B. polimixa (B. aerosporus) — полимиксин (аэроспорин). B. mycoides, B. mesentericus и B. simplex выделены разнообразные, еще недостаточно изученные соединения: бациллин, колистатин и др. Многие из них препятствуют росту грибков. актиномицеты прокариоты, геном не заключен в ядро, а представляет кольцевую хромосому, не отделенную от цитоплазмы ядерной мембраной, не содержат митохондрий, клеточная стенка из гетерополимера – пептидогликана. Все это сближает актиномицеты с бактериями, но в отличие от «истинных» бактерий (эубактерий) – многоклеточные организмы со сложным циклом развития, 5-6 сут. образуют спороносцы и споры. Мицетин (Красильников и Кореняко, 1939 г). стрептомицин, тетрациклины, эритромицин, новобиоцин, неомицин и др. Aspergillus flavus - пенициллин и аспергиловую кислоту; A.Fumigatus - фумигатин, спинулозин, фумигацин (гельволевую кислоту) и глитоксин; Streptomyces rimosus - окситетрациклин и римоцидин; S.aurofaciens-хлортетрациклин и тетрациклин. Один и тот же а/б может продуцироваться микроорганизмами разного рода. Плесневые грибы –многоклеточные микроорганизмы со сложным циклом развития, формируют разные виды мицелия, спороносцы со спорами и др. морфологические образования. продуценты беталактамов: Penicillium chrysogenum - бензилпенициллин P.notatum - пенициллин и пенатин; Acremonium chrysogenum - цефалоспорин С Fusidium coccineum - фузидиевая кислота (антибиотик стероидной структуры) наиболее значимые – гризеофульвин, микофеноловая кислота, глиотоксин, клавацин, аспергилловая кислота и мн.др. Основная часть грибных антибиотиков не нашла еще практического применения главным образом в силу своей высокой токсичности. Водоросли. Многие водоросли способны вырабатывать вещества, обладающие антибиотическими свойствами, но пока ни одно из них не нашло клинического применения. Лишайники - лихенин и усниновая кислота. Высшие растения - Продуцируют антибактериальные вещества, сходные по своим свойствам с истинными антибиотиками - фитонциды — аллицин, томатин и др. Аллицин - из чеснока (Allium sativum), (Каваллито, 1944 г) экстрагируют органическими растворителями и очищают перегонкой с водяным паром. В чесноке содержится аллиин (не имеет запаха чеснока и не обладает антибиотическими свойствами) переходит в аллицин под влиянием фермента аллинназы, содержащегося в соке чеснока. Аллицин подавляет развитие грам+ и грам- бактерий, туберкулезной палочки. Аллицин обладает относительно высокой токсичностью. Летальная доза его при внутривенном введении мышам составляет 60 мг/кг, при подкожном — 120 мг/кг. Высокая токсичность аллицина и неустойчивость препарата делают невозможным его применение в медицине. Водные экстракты семян редиса (Raphanus sativum) содержат антибиотик рафанин; корни и листья редиса не содержат антибиотика. Рафанин был выделен в 1947 г. Из 1 кг семян можно получить до 3 г чистого антибиотика. Рафанин, подобно аллицину, содержится в семенах не как свободное соединение, а в виде проантибиотика; превращается в рафанин под действием энзима, содержащегося в семенах редиса. Рафанин подавляет грам+ и грам- бактерии в концентрации 40-200 мкг/мл. Невысокие концентрации антибиотика задерживают прорастание семян многих растений, кроме семян редиса. Животные Лизоцим обнаружен в белке куриного яйца, селезенке, сердце, печени, легком, в различных секреторных выделениях (слеза, слизи носа: слюна и др.), в соках некоторых растений, у микроорганизмов и бактериофагов. Более полно изучен лизоцим, выделенный из белка куриного яйца. В настоящее время кристаллический лизоцим получают непосредственно из яичного белка путем адсорбции на бентонитной глине. С глины лизоцим элюируют 5%-ным водным пиридином при рН 5, затем фермент осаждают сернокислым аммонием, подвергают диализу и лиофильно сушат. Лизоцим белка куриного яйца активен в отношении грам+ бактерий (Bacillus, Micrococcus, Streptococcus, Sarcina). Менее чувствительны к лизоциму грамбактерии. При действии лизоцима на микроорганизмы происходит лизис чувствительных к нему клеток, что связано прежде всего с действием этого вещества на клеточные стенки, которые под влиянием антибиотика разрушаются и при этом происходит «излияние» цитоплазматического содержимого клеток. Лизоцим не проявляет токсических свойств в отношении организма человека или животных, наоборот, он, подобно биостимулятору, активирует защитные свойства макроорганнзма. В организме животных лизоцим выполняет защитную функцию в отношении проникновения сапрофитных и патогенных микроорганизмов. Лизоцим изучался и продолжает изучаться как лечебный фактор, применяемый при инфекционных болезнях, в дерматологии, офтальмологии, хирургии и при действии на злокачественные опухоли. Из тканей животных и рыб (эритрин, эктерицид). Биологическая роль антибиотиков способность синтезировать антибиотики — полезное для вида приспособление, выработавшееся и закрепленное в процессе эволюции организмов. Продуцирование антибиотиков — один из факторов, дающий определенные преимущества микроорганизму-антагонисту в борьбе за существование в сложных естественных микробных ассоциациях один из механизмов адаптации. Антагонизм микробов может обусловливаться и другими веществами и приспособительными механизмами, не связанными с образованием химических соединений. Все это также может способствовать широкому распространению микробов, у которых не выявлена способность синтезировать антибиотики. в лабораторных условиях, при изолированном выращивании актиномицет (вне естественного биоценоза) на искусственных питательных средах, не всегда удается выявить способность к синтезу антибиотика. То есть неактивные в лабораторных условиях штаммы актиномицетов способны к биосинтезу антибиотиков. антибиотические вещества, образуемые микроорганизмами, носят случайный характер, зависящий лишь от условий культивирования (З.Ваксман, X.Лешевалье) поскольку антибиотики образуются не всеми широко распространенными микробами и антибиотики быстро инактивируются в почве. в литературе имеются многочисленные данные, о наличии антагонизма между микробами в почве, обусловленного выделением антибиотиков. В микрозонах, где присутствует антибиотик (в почве), он безусловно воздействует на микробы, контактирующие с ним. Действительно, в почве происходит процесс разрушения антибиотиков под влиянием различных физико-химических факторов (рН, наличие коллоидов и др.), и инактивацией специфическими ферментами, образуемыми микробами. Но это не доказывает отсутствия действия антибиотиков на микробы в почве. Инактивация антибиотиков микроорганизмами - естественная реакция живого организма на вредное воздействие среды. В ответ на воздействие антибиотиков микроорганизмы вырабатывают различные формы защиты. В любом случае окончательный результат этого взаимодействия будет определяться: скоростью размножения, интенсивностью синтеза антибиотиков и инактивирующих веществ, способностью полнее использовать вещества окружающей среды для жизнедеятельности, степенью устойчивости к неблагоприятным физико-химическим условиям обитания и т. д. Методы выделения и отбора. Выделение продуцентов антибиотиков может производиться из самых разнообразных субстратов: почвы, гниющих растительных и животных остатков, илов, воды озер и рек, воздуха и из других источников. Наиболее же богата микроорганизмами, продуцирующими антибиотики, почва. Из нее большей частью и выделяют организмы-продуценты антибиотических веществ. Для выделения микроорганизмов — продуцентов антибиотиков из естественных мест их обитания применяется большое число разнообразных методов: По мнению некоторых микробиологов, к настоящему времени выделено и изучено не более 10 процентов всех имеющихся в природе микроорганизмов. Поэтому необходимо изучать и разрабатывать новые приемы выделения микробов, которые бы способствовали максимальному обнаружению их в природе. Высев почвенной взвеси в воде на поверхность агаровой пластинки Определенная навеска почвы, тшательно растертая в ступке с небольшим объемом воды, количественно переносится в колбу со стерильной водой. Содержимое колбы встряхивается в течение 5 мни, а затем из водной суспензии делается ряд последовательных разведений, которые высеваются на соответствующую агаризированную среду. Для получения в дальнейшем чистых культур отдельные колонии после инкубации в термостате при нужной температуре пересеваются в пробирки со скошенным питательным агаром. Каждая чистая культура микроорганизма пересевается на различные по составу среды и после достаточно хорошего развития проверяются ее антибиотические свойства. Высев почвы на питательный агар, предварительно засеянный тесторганизмом Поверхность питательного агара засевается тест-культурой необходимого организма, после чего на агаровую пластинку раскладывают небольшие, не более просяного зерна, комочки почвы или же почву наносят в виде пыли, распределяя ее по всей поверхности пластинки. Затем чашки помещают в термостат и через определенный промежуток времени (24-48 ч, а иногда и более) просматривают кусочки почвы или отдельные ее участки, вокруг которых образовались зоны задержки роста тест-организма. Из этих участков выделяют чистые культуры организмов и подвергают их дальнейшему изучению. Метод обогащения почвы Почву, из которой предполагают выделить антагонистов, обогащают организмами тех видов, по отношению к которым хотят получить антагонист. С этой целью к образцам почвы, помешенным в стеклянные сосуды, систематически добавляют отмытую суспензию нужных микроорганизмов. Затем через определенные промежутки времени такая почва высевается в виде отдельных комочков на агаровые пластинки в чашках Петри, предварительно засеянные тем же самым организмом, который использовался для обогащения почвы. Метод центрифугирования почвенной сусп Для выделения актиномицетов из почв и особенно из почв в весеннее время, когда в ней развивается большое число грибов и бактерий, применяется метод центрифугирования почвенной взвеси. Метод основан на различии скорости оседания отдельных видов микроорганизмов в центробежном поле. При 3000 об/мин в течение 20 мин частицы, соответствующие по размерам спорам плесеней или клеткам бактерий типа Вас. mesentericus, Вас. mycoides, Вас. subtilis, осаждаются на дно пробирки. Частицы же, соответствующие по размерам спорам актиномицетов, оказываются при данной скорости центрифугирования в поверхностном слое жидкости. Высевая надосадочную жидкость, удается в большинстве случаев (до 92%) получить на пластинках питательного агара только колонии актиномицетов. Метод замораживания-оттаивания почвы. Отобранный для выделения актиномицетов образец почвы помещается в испаритель бытового холодильника при температуре -8°. Через час образец извлекается из холодильника и выдерживается при комнатной температуре до полного оттаивания. Процедуру замораживания-оттаивания повторяют дважды. Затем навеску почвы помещают в стерильную водопроводную воду, взбалтывают суспензию в течение 15 мин на круговой качалке при 230 об/мин, после чего различные разведения суспензии высевают на питательную агаровую пластинку в чашках Петри. Метод замораживания-оттаивания образцов почвы позволяет обнаружить в них в 1,2-3,6 раза больше актиномицетов, чем в тех же образцах без замораживания. Это, по-видимому, связано с повышением десорбции актиномицетов с поверхности почвенных частиц. Применение питательных сред, содержащих антибиотики При высеве почвенной суспензии на агаровые пластинки создаются трудности для развития редко встречающихся видов актиномицетов в результате быстрого развития бактерий и широко распространенных в почвах видов актиномицетов. Поэтому для целей направленного выделения определенных групп микроорганизмов в среды для высева почвенной суспезии добавляют различные антибиотики. При добавлении антибиотиков к среде для культивирования микроорганизмов происходит подавление обычной микрофлоры, создаются условия для развития устойчивых к этим антибиотикам форм микробов; последние могут оказаться новыми или редкими видами, способными образовывать и новые антибиотики. Для выделения актиномицетов применяют среды, содержащие в своем составе такие антибиотики, как тетрациклины, неомицин, нистатин, стрептомицин, хлорамфеникол, пенициллин и др. При выделении продуцентов новых антибиотических веществ используют среды, содержащие стрептомицин в концентрациях от 25 до 100 мкг/мл и рубомицин — от 5 до 20 мкг/мл. Основная задача первых этапов выделения антибиотического вещества — концентрирование биологически активного соединения и очистка от сопутствующих балластных веществ. Основными методами выделения антибиотиков из нативных растворов (культуральная жидкость, освобожденная от биологической массы продуцента) можно назвать следующие: осаждение антибиотика, методы экстракции антибиотиков ограническими растворителями, сорбционные методы с использованием поверхностно-активных веществ (активированный уголь, активированная окись алюминия и др.) или ионообменных материалов (ионообменные смолы). Антибиотик, выделенный одним из указанных способов, представляет собой лишь технически чистый препарат, который не может еще использоваться в медицинской практике. Дальнейшая очистка препарата осуществляется или путем повторной сорбции, перекристаллизации, растворением антибиотика в органических растворителях, или иными методами. После того как антибиотическое вещество с помощью того или иного метода выделено и хорошо очищено, проверяют его биологическую активность по отношению к широкому ряду микроорганизмов (антимикробный спектр). Кроме того, антибиотик исследуют на стерильность, токсичность, пирогенность, испытывают в отношении действия на лейкоциты крови и определяют другие показатели. Цель выяснения стерильности готового препарата — установление отсутствия в нем спор микроорганизмов и, прежде всего, патогенных. Для этого необходимо, если это возможно, инактивировать антибиотические вещества, а затем произвести посев его на разнообразные по составу питательные среды (мясопептонный бульон, печеночный бульон, кровяной агар и т. п.). Общее строение бактерий Грам-микроорганизмы (Escherichia coli – окраска по Граму) Грам+ микроорганизмы (Staphylococcus aureus – окраска по Граму) У грам+ клеточная стенка содержит мукопептиды, полисахариды, тейхоевые кислоты (состоят из сахаров, спиртов, аминокислот и фосфорной кислоты). Полисахариды и тейхоевые кислоты связаны с каркасом стенок — муреином. С помощью электронных фотографий тонких срезов (слоистости) в стенках грамположительных бактерий не обнаружено. У грам- клеточная стенка более сложная, содержит значительные количества липидов (жиров), связанных с белками и сахарами в сложные комплексы — липопротеиды и липополисахариды. Муреина в клеточных стенках грам- бактерий в целом меньше, чем у грам+ бактерий. С помощью электронного микроскопа было установлено, что стенки этих бактерий многослойные Пенициллин широко применяется в лечении стафилококковых инфекций – остеомиелита, инфекционного артрита, пневмонии, бронхита, эмпиемы, эндокардита, фурункулеза, ларинготрахеита, мастита, менингита, воспаления среднего уха, перитонита, инфицированных ран и ожогов, септицемии, синусита, тонзиллита и многих других заболеваний. Его с успехом используют при различных инфекциях, вызываемых гемолитическими и анаэробными стрептококками, пневмококками, гонококками, менингококками, анаэробными клостридиями (возбудителями газовой гангрены), дифтерийными палочками, возбудителями сибирской язвы, спирохетами и многими другими бактериями. Однако при смешанных инфекциях, вызываемых грамотрицательными бактериями, а также при малярии, туберкулезе, вирусных инфекциях, грибковых и некоторых других заболеваниях пенициллин неэффективен. Токсическое действие пенициллина проявляется главным образом в виде аллергических реакций (даже на минимальные дозы) и судорожных припадков (при введении очень больших доз). Цефалоспорины по химической структуре близки к пенициллину, но устойчивы к бета-лактамазам. Поэтому высокоактивны по отношению к бактериям кишечной группы (грамотрицательным палочковидным бактериям типа Escherichia coli).В настоящее время получено большое число цефалоспоринов, среди них – применяемые в клинике цефалотин, цефазолин, цефалексин, цефамандол, дефокситин и цефтриаксон. Стрептомицин применяется при многих инфекциях. Это эффективное средство лечения менингита, эндокардита, ларинготрахеита, а также заболеваний мочевых путей и легких, вызываемых бациллой Пфейфера (Hemophilus influenzae). Лечению стрептомицином поддаются также менингит, пневмония и инфекции мочевых путей, если причиной этих заболеваний служат чувствительные к нему штаммы Escherichia coli, Proteus vulgaris, Klebsiella pneumoniae (бацилла Фридлендера), Aerobacter aerogenes и Pseudomonas. Хлорамфеникол и тетрациклины. Они эффективны при приеме внутрь (перорально) и широко применяются при многочисленных инфекционных заболеваниях, вызываемых бактериями и некоторыми крупными вирусами. К таким заболеваниям относятся брюшной тиф, различные формы сыпного тифа, пятнистая лихорадка, гонококковые инфекции, сифилис, бруцеллез, инфекции мочевых путей, венерическая лимфогранулема и многие другие. Эти антибиотики эффективны также при большинстве заболеваний, для лечения которых показан пенициллин, и их часто назначают при устойчивых к пенициллину инфекциях, а также в тех случаях, когда предпочитают пероральную терапию. Эритромицин и новобиоцин. Эритромицин и другие антибиотики (например, карбомицин, олеандомицин), имеющие особую (макролидную) химическую структуру, а также новобиоцин характеризуются широким спектром действия – примерно таким же, как у пенициллина, но охватывающим и некоторые грамотрицательные бактерии. Их преимущества заключаются в возможности приема внутрь и низкой токсичности; они относительно редко вызывают желудочно-кишечные расстройства.