Двухосновные карбоновые кислоты
реклама
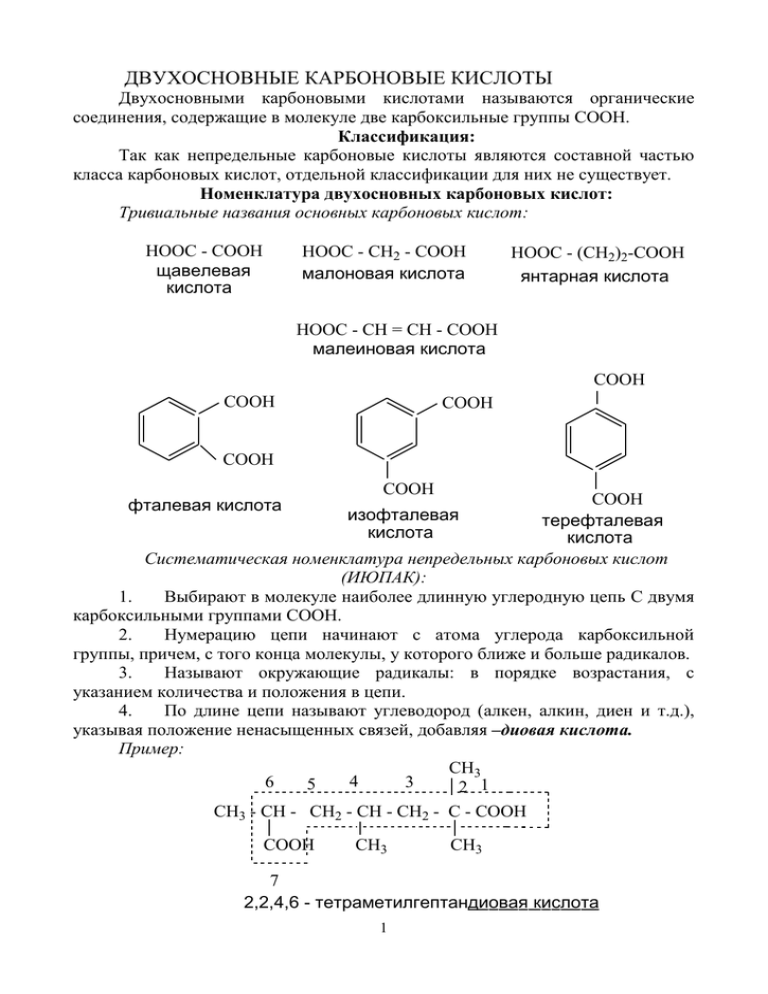
ДВУХОСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ Двухосновными карбоновыми кислотами называются органические соединения, содержащие в молекуле две карбоксильные группы СООН. Классификация: Так как непредельные карбоновые кислоты являются составной частью класса карбоновых кислот, отдельной классификации для них не существует. Номенклатура двухосновных карбоновых кислот: Тривиальные названия основных карбоновых кислот: HOOC - COOH щавелевая кислота HOOC - CH2 - COOH малоновая кислота HOOC - (CH2)2-COOH янтарная кислота HOOC - CH = CH - COOH малеиновая кислота COOH COOH COOH COOH фталевая кислота COOH COOH изофталевая терефталевая кислота кислота Систематическая номенклатура непредельных карбоновых кислот (ИЮПАК): 1. Выбирают в молекуле наиболее длинную углеродную цепь С двумя карбоксильными группами СООН. 2. Нумерацию цепи начинают с атома углерода карбоксильной группы, причем, с того конца молекулы, у которого ближе и больше радикалов. 3. Называют окружающие радикалы: в порядке возрастания, с указанием количества и положения в цепи. 4. По длине цепи называют углеводород (алкен, алкин, диен и т.д.), указывая положение ненасыщенных связей, добавляя –диовая кислота. Пример: CH3 4 6 3 5 2 1 CH3 - CH - CH2 - CH - CH2 - C - COOH COOH CH3 CH3 7 2,2,4,6 - тетраметилгептандиовая кислота 1 Изомерия Для двухосновных карбоновых кислот характерна структурная изомерия, связанная со строением углеводородного радикала и положением ненасыщенных связей. Структурная изомерия, связанная со строением углеводородного радикала: Пример: HOOC - CH2 - CH2 - COOH бутандиовая кислота HOOC - CH - COOH CH3 2-метилпропандиовая кислота Структурная изомерия, связанная с положением ненасыщенных связей: Пример: HOOC - CH = CH - CH2 - CH2 - COOH HOOC - CH2 - CH = CH - CH2 - COOH 3-гексендиовая кислота 2-гексендиовая кислота Физические свойства № 1 2 3 4 5 Название Агрегатное t- пл., t- кип., 0 0 кислоты состояние С С щавелевая твердое 189,5 малоновая твердое 135,6 янтарная твердое 185,0 300 малеиновая твердое 130,5 фталевая твердое 200,0 - рКа Относительная 250С плотность, d420 1,27 1,900 2,86 1,619 4,21 1,563 1,92 2,58 Способы получения двухосновных карбоновых кислот Способы получения двухосновных кислот повторяют способы получения одноосновных, с той разницей, что получают одновременно или последовательно две карбоксильные группы. Ниже приведены некоторые возможные примеры получения. Подробно способы получения описаны в теме «Одноосновные карбоновые кислоты». Пример 1: 2 Cl 2KCN 2Cl2 CH3 - CH2 - CH3 hv, t - 2HCl пропан CN CH3 - C - CH3 CH3 - C - CH3 -2KCl Cl 2,2-дихлорпропан CN динитрил 2,2-диметилпропандиовой кислоты 4H2O H+ -2NH4+ COOH CH3 - C - CH3 COOH 2,2-диметилпропандиовая кислота Пример2: O CH2 - CH2-COOH OH -H2O 3-оксипропановая кислота CH - CH2 - COOH O 3-оксопропановая кислота Ag(NH3)2OH HOOC-CH2-COOH -Ag -H2O -NH3 пропандиовая кислота Химические свойства. Для кислот характерны следующие типы реакций: 1. Электрофильное замещение (SE по одной или двум карбоксильным группам). 2. Нуклеофильное замещение (SN по одной или двум карбоксильным группам). 3. Реакция отщепления (по одной или двум карбоксильным группам). 1. Реакции электрофильного замещения (SE). 1. Благодаря наличию в молекуле двухосновных карбоновых кислот 3 двух функциональных групп СООН, увеличиваются кислотные свойства соединения по сравнению с одноосновными карбоновыми кислотами аналогичного строения. Формула рКа, 25 0С CH3COOH 4,76 НООС - СООН 1,23 CH3CH2COOH 4,87 НООС – СН2 - СООН 2,83 HOOC - COOH CH3 - COOH Чем ближе карбоксильные группы, тем выше кислотные свойства соединения. 2. HOOC - COOH HOOC-CH2-COOH Объяснение следующее: + - + O = C C = O H O O - H 1. При диссоциации двухосновной карбоновой кислоты концентрация протонов в растворе выше, чем при аналогичном процессе, протекающем с одноосновной кислотой. А чем выше концентрация протонов, тем выше кислотные свойства. 2. Одна из карбоксильных групп по отношению к другой является акцептором, а акцепоторы увеличивают кислотные свойства соединения. 3. По мере удаления карбоксильных групп друг от друга, снижается их взаимное влияние и, как следствие, кислотные свойства. Данная группа реакций подробно рассмотрена в теме «Одноосновные карбоновые кислоты». В качестве примера приводится реакция солеобразования с содой. При недостатке реагента процесс идет по одной карбоксильной группе с образованием кислой соли (так как вторая карбоксильная группа в реакции не участвует и проявляет кислотные свойства). При избытке реагента процесс идет по двум карбоксильным группам, с образованием средней соли. Пример: 4 NaHCO3 HOOC - CH2 - COOH -CO2 - H2O HOOC - CH2 - COOH 2NaHCO3 -2CO2 - 2H2O HOOC - CH2 - COONa кислая натриевая соль пропандиовой кислоты NaOOC - CH2 - COONa средняя натриевая соль пропандиовой кислоты 2. Реакции нуклеофильного замещения (SN). Данная группа реакций позволяет получить производные двухосновных карбоновых кислот. Происходит замещение групп ОН в карбоксильных группах на нуклеофильную частицу. Данная группа реакций подробно рассмотрена в теме «Одноосновные карбоновые кислоты». В качестве примера приводится реакция этерификации со спиртом. При недостатке реагента процесс идет по одной карбоксильной группе с образованием неполного эфира (так как вторая карбоксильная группа в реакции не участвует и проявляет кислотные свойства). При избытке реагента процесс идет по двум карбоксильным группам, с образованием полного эфира. CH3OH HOOC - CH2 - COOCH3 HOOC - CH2 - COOH t, H2SO4 -H2O HOOC - CH2 - COOH 2CH3OH t, -H2SO4 -2H2O неполный метиловый эфир пропандиовой кислоты CH3OOC - CH2 - COOCH3 полный диметиловый эфир пропандиовой кислоты 3. Реакция отщепления (по одной или двум карбоксильным группам). Данная реакция позволяет различить двухосновные карбоновые кислоты с различным количеством атомов углерода в главной цепи. Это реакция нагревания. 3.1. Если в главной цепи до трех атомов углерода включительно, то 5 при нагревании выделяется углекислый газ (СО2), с образованием одноосновной карбоновой кислоты. R R t HOOC - CH2 HOOC - CH - COOH -CO2 одноосновная карбоновая кислота Пример1: t HCOOH HOOC - COOH -CO2 метановая кислота этандиовая кислота Пример2: CH3 CH3 t CH2 - COOH HOOC - CH - COOH -CO2 пропановая кислота метилпропандиовая кислота 3.2. Если в главной цепи три-четыре атома углерода включительно, то при нагревании выделяется углекислый вода (Н2О), с образованием ангидрида карбоновой кислоты. t HOOC - CH2 - CH - COOH R -H2O O=C-O-C=O CH2 - CH R ангидрид Пример 1: 6 t HOOC - CH2 - CH - COOH -H2O CH3 O=C-O-C=O CH2 - CH CH3 2-метилбутандиовая кислота ангидрид 2-метилбутандиовой кислотв Пример 2: HOOC - CH = CH - COOH O=C-O-C=O t -H2O 2-бутендиовая кислота ( малеиновая кислота) CH = CH ангидрид 2-бутендиовой кислоты ( малеиновый ангидрид) Пример 3: COOH t COOH -H2O C =O O C =O фталевый ангидрид фталевая кислота 7





