превращения хинопимаровой кислоты по карбоксильной группе
реклама
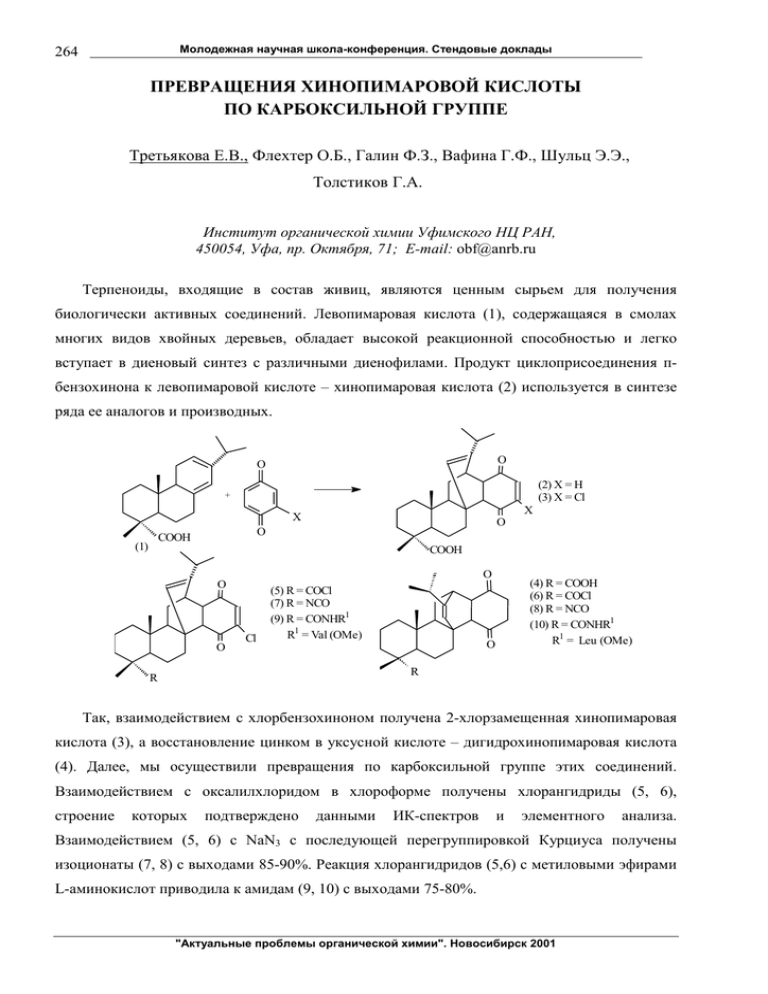
Молодежная научная школа-конференция. Стендовые доклады 264 ПРЕВРАЩЕНИЯ ХИНОПИМАРОВОЙ КИСЛОТЫ ПО КАРБОКСИЛЬНОЙ ГРУППЕ Третьякова Е.В., Флехтер О.Б., Галин Ф.З., Вафина Г.Ф., Шульц Э.Э., Толстиков Г.А. Институт органической химии Уфимского НЦ РАН, 450054, Уфа, пр. Октября, 71; Е-mail: [email protected] Терпеноиды, входящие в состав живиц, являются ценным сырьем для получения биологически активных соединений. Левопимаровая кислота (1), содержащаяся в смолах многих видов хвойных деревьев, обладает высокой реакционной способностью и легко вступает в диеновый синтез с различными диенофилами. Продукт циклоприсоединения пбензохинона к левопимаровой кислоте – хинопимаровая кислота (2) используется в синтезе ряда ее аналогов и производных. O O (2) X = H (3) X = Cl + X O COOH (1) O X COOH O O O Cl (5) R = COCl (7) R = NCO (9) R = CONHR1 R1 = Val (OMe) (4) R = COOH (6) R = COCl (8) R = NCO (10) R = CONHR1 R1 = Leu (OMe) O R R Так, взаимодействием с хлорбензохиноном получена 2-хлорзамещенная хинопимаровая кислота (3), а восстановление цинком в уксусной кислоте – дигидрохинопимаровая кислота (4). Далее, мы осуществили превращения по карбоксильной группе этих соединений. Взаимодействием с оксалилхлоридом в хлороформе получены хлорангидриды (5, 6), строение которых подтверждено данными ИК-спектров и элементного анализа. Взаимодействием (5, 6) с NaN3 с последующей перегруппировкой Курциуса получены изоционаты (7, 8) с выходами 85-90%. Реакция хлорангидридов (5,6) с метиловыми эфирами L-аминокислот приводила к амидам (9, 10) с выходами 75-80%. "Актуальные проблемы органической химии". Новосибирск 2001











