Органическая химия Занятия № 6
реклама

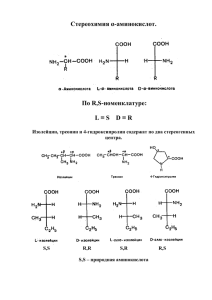
Органическая химия Занятия № 6-9 Тема: Аминокислоты. Пептиды. Белки. Изучение темы разделено на 4 занятия, два из которых практические (ПЗ), второе и третье лабораторно-практические (ЛПЗ) с лабораторными работами и контрольной работой на последнем занятии темы. В лабораторных тетрадях необходимо сделать записи к каждому занятию по плану: • Дата • Номер занятия • Тема занятия • Основные вопросы темы. Занятие № 6 (ПЗ). Тема: Аминокислоты. Классификация и строение. Цель: Сформировать знания строения важнейших α – аминокислот, являющихся структурными компонентами белковых молекул для понимания их метаболических превращений в биологических системах. Учебные вопросы занятия: 1. Аминокислоты, входящие в состав белков. Определение аминокислот и их классификация с учетом различных критериев: по химической природе радикала; количеству амино- и карбоксильных групп и содержащихся в структуре аминокислот других заместителей; расположению аминогруппы по отношению к карбоксильной группе; по кислотно-основным свойствам. 2. Биологическая классификация (заменимые и незаменимые α-аминокислоты). Медикобиологическое значение α-аминокислот. 3. Стереоизомерия α-аминокислот. Пары энантиомеров с одним и с двумя центрами хиральности. Способы разделения оптических изомеров. 4. Реакционные центры α-аминокислот как гетерофункциональных соединений. Биполярная структура, образование биполярных ионов. Нейтральные, кислые и основные α-аминокислоты. По учебным вопросам занятия в лабораторных тетрадях написать конспект! Заключительная часть учебного занятия. Преподаватель дает задание на дом, подписывает тетради. Уважаемые студенты! Выслушайте преподавателя по оценке ваших знаний. Поблагодарите и попрощайтесь с преподавателем. Рекомендованная литература: 1. Н.А.Тюкавкина, Ю.И.Бауков. Биологическая химия. Учебник для студентов медвузов, М., Медицина, 2008. 2. И.А.Братцева, В.И.Гончаров. Биологическая химия. Учебное пособие г.Ставрополь, 2008. 3. Руководство к лабораторным занятиям по биологической химии под ред. Н.А.Тюкавкиной. М. Медицина, 2009. 4. Лекционный материал. Занятие № 7 (ЛПЗ). Тема: Аминокислоты. Химические свойства. Цель: Сформировать знания свойств важнейших α – аминокислот, являющихся структурными компонентами белковых молекул для понимания их метаболических превращений в биологических системах. Учебные вопросы занятия: 1. Химические свойства аминокислот: 1.1. Кислотно-основные свойства α-аминокислот (амфотерность). Образование внутрикомплексных солей. Реакции этерификации и ацилирования. 2. Специфические реакции α-, β- и γ-аминокислот (образование пептидов, ненасыщенных кислот, лактамов, . 3. Биологически важные реакции α-аминокислот. 3.1.Реакции дезаминирования (внутримолекулярного и окислительного). 3.2.Реакции гидроксилирования. 3.3.Биосинтетические пути образования аминокислот из кетонокислот: реакции восстановительного аминирования и реакции трансаминирования. Взаимопревращения аминокислот: фенилаланин → тирозин; цистеин → цистин; пролин → гидроксипролин. 3.4. Декарбоксилирование α-аминокислот – путь к образованию биогенных аминов и биорегуляторов (коламин, гистамин, триптамин, серотонин, кадаверин, β-аланин, γаминомасляная кислота – ГАМК). 4. Реакции аминокислот с формальдегидом (формольное титрование) и азотистой кислотой (реакция Ван-Слайка). Какое практическое применение имеют эти реакции? 4.1 Качественные реакции на аминокислоты: нингидридная, биуретовая, ксантопротеиновая. По учебным вопросам занятия в лабораторных тетрадях написать конспект! Лабораторные работы. Опыт №1. – Реакция глицина с нингидрином. В пробирку поместите 4 капли 1% раствора глицина и 2 капли 0,1% раствора нингидрина. Содержимое пробирки осторожно нагрейте до появления сине-красной окраски. Опыт №2. – Реакция глицина с формальдегидом. В пробирку поместите 5 капель 1% раствора глицина и добавьте 1 каплю индикатора метилового красного. Раствор окрашивается в желтый цвет (нейтральная среда). К полученной смеси добавьте равный объем формалина. Отметьте появление красной окраски (кислая среда). Данная реакция под названием «формольное титрование» используется для количественного определения карбоксильных групп в α-аминокислотах. Опыт №3. – Реакция глицина с азотистой кислотой. В пробирку поместите 5 капель 1% раствора глицина и равный объем 5% раствора нитрита натрия. Добавьте 2 капли концентрированной уксусной кислоты и осторожно взболтайте смесь. Наблюдается выделение газа. Реакция используется для количественного определения аминогрупп в аминокислотах. Опыт №4. – Образование комплексной соли меди глицина. В пробирку поместите 1 мл 1% раствора глицина. Добавьте на кончике лопаточки сухой карбонат меди (II) и смесь нагрейте. Раствор окрашивается в синий цвет. Опыт №5. – Амфотерные свойства α-аланина. В первую пробирку поместите 5 капель 1% раствора α-аланина и добавьте по каплям 0,1% раствор хлороводородной кислоты, подкрашенной индикатором Конго в синий цвет (на общем столе), до появления розово-красной окраски. Во вторую пробирку поместите 5 капель 1% раствора α-аланина и по каплям добавьте 0,1% раствор гидроксида натрия, подкрашенный фенолфталеином, до исчезновения окраски. Вопросы по лабораторной работе: 1. Какими внешними признаками характеризуется реакция α-аминокислот с нингидрином? 2. Какое практическое применение имеет реакция α-аминокислот с нингидрином? 3. Напишите уравнение реакции взаимодействия глицина с формальдегидом. Каковы причины изменения окраски индикатора? 4. Какое практическое применение имеет реакция α-аминокислот с формальдегидом? 5. Напишите схему взаимодействия глицина с азотистой кислотой. Назовите образовавшиеся соединения. 6. Какое практическое применение имеет реакция аминокислот с азотистой кислотой? 7. Напишите реакцию взаимодействия глицина с карбонатом меди (II). 8. Какой цвет характерен для растворов комплексных солей меди? 9. Напишите уравнение реакции взаимодействия α-аланина с гидроксидом натрия. Почему изменяется окраска индикатора в ходе реакции? 10. Напишите уравнение реакции взаимодействия α-аланина с хлороводородной кислотой. Почему изменяется окраска индикатора в ходе реакции? 11. Почему α-аминокислоты способны взаимодействовать с кислотами и щелочами? Заключительная часть учебного занятия. Преподаватель дает задание на дом, подписывает тетради. Уважаемые студенты! Выслушайте преподавателя по оценке ваших знаний. Поблагодарите и попрощайтесь с преподавателем. Рекомендованная литература: 1. Н.А.Тюкавкина, Ю.И.Бауков. Биологическая химия. Учебник для студентов медвузов, М., Медицина, 2008. 2. И.А.Братцева, В.И.Гончаров. Биологическая химия. Учебное пособие г.Ставрополь, 2008. 3. Руководство к лабораторным занятиям по биологической химии под ред. Н.А.Тюкавкиной. М. Медицина, 2009. 4. Лекционный материал. Занятие № 8(ЛПЗ). Тема: Пептиды, белки. Качественные реакции. Классификация. Уровни структурной организации. Цель: Сформировать знания химических основ структурной организации белковых молекул для дальнейшего изучения биологических функций белков на молекулярном уровне. Учебные вопросы занятия: 1. Белки – основа жизни. Многообразие белков и выполняемых ими функций. Установление аминокислотного состава белков с помощью физико – химических методов. 2. Классификация белков с учетом различных признаков: по отношению к гидролизу и степени сложности; по растворимости; по кислотно – основным свойствам; по пространственной структуре. Изоэлектрическая точка белков. 3. Уровни структурной организации белков: первичный, вторичный, третичный, четвертичный. 3.1.Типы связи, поддерживающие нативную структуру белков. Строение пептидной группы. Частичный и полный гидролиз белков (кислотный, щелочный, ферментативный). Высаливание. Денатурация. Качественные реакции на белки – цветные и осадочные. 4.Понятие о сложных белках. Гликопротеины, липопротеины, нуклеопротеины, фосфопротеины. По учебным вопросам занятия в лабораторных тетрадях написать конспект! Лабораторные работы Опыт 1. Ксантопротеиновая реакция белков В пробирку поместите 10 капель раствора яичного белка (на общем столе) и 2 капли концентрированной азотной кислоты (на общем столе). Содержимое пробирки осторожно нагрейте, все время встряхивая. Раствор и осадок окрашиваются в желтый цвет. Охладив пробирку, осторожно добавьте 1-3 капли 10% раствора гидроксида натрия (2) до появления ярко- оранжевой окраски. Вопросы: 1. Какие α -аминокислоты в составе белка можно открыть с помощью ксантопротеиновой реакции? Опыт 2. Реакция на присутствие серусодержащих α -аминокислот В пробирку поместите 10 капель раствора яичного (на общем столе) и вдвое больший объем 10% раствора гидроксида натрия (2). Содержимое пробирки перемешайте, нагрейте до кипения (1-2 мин). К полученному щелочному раствору добавьте 5 капель 10% ацетата свинца (II) и вновь прокипятите. Отметьте появление серо-черного осадка. Вопросы: 1. Напишите в общем виде схему реакции белка с ацетатом свинца(II) 2. Какие α-аминокислоты в составе белка можно открыть данной качественной реакцией? Опыт 3. Осадочная реакция на белок с концентрированной азотной кислотой (проба Геллера). К 5 каплям концентрированной HNO3 приливают 5 капель белка осторожно по стенке пробирки, наклонив ее под углом 450 так, чтобы обе жидкости не смешивались. На границе двух жидкостей образуется осадок в виде небольшого белого кольца денатурированного белка. Эта реакция широко используется в клинике для открытия белка в моче и лежит в основе количественного определения белка по методу РобертсаСтольникова Вопросы: 1. Какой процесс происходит при добавлении к раствору белка концентрированной азотной кислоты? 2. Каковы внешние признаки процесса денатурации белков? 3. Чем отличаются между собой по механизму процессы высаливания и денатурации белков? Лабораторные работы должны быть описаны в тетради с выводами и химическими реакциями. Иметь представление о понятиях: 1. Содержание белков в плазме крови в норме. 2. Знать, что такое гиперпротеинемия. 3. Знать, что такое гипопротеинемия. 4. Знать, что такое протеинурия. Заключительная часть учебного занятия. Преподаватель дает задание на дом, подписывает тетради. Уважаемые студенты! Выслушайте преподавателя по Поблагодарите и попрощайтесь с преподавателем. оценке ваших знаний. Рекомендованная литература: 1. Н.А. Тюкавкина, Ю.И. Бауков. Биоорганическая химия. Учебник для студентов медвузов, М., Медичина, 2008. 2. И.А. Братцева, В.И. Гончаров. Биоорганическая химия. Учебное пособие г.Ставрополь, 2008. 3. Руководство к лабораторным занятиям по биоорганической химии под ред. Н.А. Тюкавкиной. М. Медицина, 2009. 4. Лекционный материал. Занятие № 9 ( ПЗ) Контрольная работа №2 по теме « Аминокислоты.Белки» Рекомендованная литература: 1. Н.А. Тюкавкина, Ю.И. Бауков. Биологическая химия. Учебник для студентов медвузов, М., Медицина, 2008. 2. И.А. Братцева, В.И. Гончаров. Биологическая химия. Учебное пособие г. Ставрополь, 2008 . 3. Руководство к лабораторным занятиям по биологической химии под ред. Н.А. Тюкавкиной. М. Медицина, 2009. 4. Лекционный материал. Приложение Пример билета по тест-контролю по теме: «АМИНОКИСЛОТЫ». БИЛЕТ 1) К моноаминомонокарбоновым относится кислота: а) валин в) орнитин б) лизин г) аспарагиновая 2) Укажите аминокислоту гистидин: â) à) N N H HO HC CH2 CH COOH NH2 H2C CH2 N CH COOH H ã) H2C á) N H CH2 CH COOH NH2 H2C CH2 N CH COOH H 3) Неприродными аминокислотами называют: а) α-аминокислоты L-ряда б) α-аминокислоты D-ряда в) аминокислоты, не содержащие асимметрический центр г) аминокислоты, которые не синтезируются в организме, а поступают только с пищей 4) В результате реакции Ван-Слайка аспарагиновая кислота превращается в: а) гликолевую кислоту в) молочную кислоту б) лимонную кислоту г) яблочную кислоту 5) Под действием какого фермента фенилаланин превращается в тирозин? а) трансаминаза в) гидроксилаза б) дегидрогеназа г) декарбоксилаза Пример билета по тест-контролю по теме: Пептиды. Белки. БИЛЕТ 1) Дайте название дипептиду: O O H2N CH C N CH C OH H CH2 CH H3C CH3 NH à) âàë-òðè á) òðè-âàë â) àëà-ãèñ ã) òðè-àëà 2) Назовите С-концевую кислоту в пептиде: H2N H O C C CH3 H N H O H C C N (CH2)4 NH2 N H O C C CH2 OH NH а) гистидин б) триптофан в) аланин г) лизин 3) Нингидриновая реакция открывает в белках: а) α-аминокислоты б) карбоновые кислоты в) амины г) пептидную связь 4) Выберите одно неверное утверждение, касающееся коллагена: а) коллаген хорошо растворим в воде б) входит в состав соединительной ткани в) нарушение синтеза коллагена ведет к ослаблению костной и зубной тканей г) коллаген имеет широкое применение в медицине 5) В какой среде находится изоэлектрическая точка трипептида вал-лиз-ала? а) рН ≈ 7 в) рН > 7 б) рН < 7 г) рН не зависит от строения пептида