Задание к занятию №25 Тема: Аминокислоты. Белки. Цель
реклама

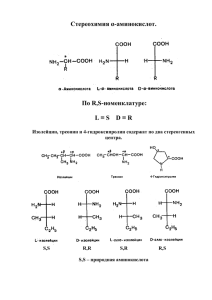
Задание к занятию №25 Тема: Аминокислоты. Белки. Цель: Сформировать знания о строении и свойствах важнейших α-аминокислот, являющихся структурными компонентами белковых молекул, необходимых для понимания их метаболических превращений в биологических системах.: Сделайте запись в рабочей тетради по плану: • Дата • Номер занятия • Тема занятия • Основные вопросы темы – это учебные вопросы занятия • Краткое описание порядка выполнения лабораторных работ Учебные вопросы занятия: 1.Природные α-аминокислоты. 1.1. Определение аминокислот и их классификация с учетом различных критериев. 1.2. Биологическая классификация (заменимые и незаменимые α- аминокислоты). Медико-биологическое значение α-аминокислот. 1.3. Стереоизомерияα-аминокислот. Пары энантиомеров с одним и с двумя центрами хиральности. Способ разделения оптических изомеров. 2.Амфотерность. 2.1. Реакционные центры α-аминокислот как гетерофункциональных соединений.. Биполярная структура, образование биполярных ионов. Нейтральные, кислые и основные α-аминокислоты. 3. Химические свойства аминокислот: 3.1.Кислотно-основные свойства α-аминокислот (амфотерность). Образование внутрикомплексных солей. Реакции этерификации и ацилирования. 3.2.Специфические реакции α-аминокислот, β- и γ-аминокислот (образование пептидов, ненасыщенных кислот, лактамов, дикетопиперазинов). 3.3.Биологически важные реакции α-аминокислот. Реакции дезаминирования (внутримолекулярного и окислительного). Реакции гидроксилирования. Биосинтетические пути образования аминокислот из кетонокислот: реакции восстановительного аминирования и реакции трансаминирования. Взаимопревращения аминокислот: фенилаланин → тирозин; цистеин → цистин; пролин → гидроксипролин. 3.4. Декарбоксилированиеα-аминокислот – путь к образованию биогенных аминов и биорегуляторов (коламин, гистамин, триптамин, серотонин, кадаверин, β-аланин, γаминомасляная кислота – ГАМК). 3.5. Реакции аминокислот с формальдегидом (формольное титрование) и азотистой кислотой (реакция Ван-Слайка). Какое практическое применение имеют эти реакции? 3.6.Качественные реакции на аминокислоты: нингидринная, биуретовая, ксантопротеиновая. 4.Пептиды. Белки. 4.1.Классификация белков с учетом различных признаков: по отношению к гидролизу и степени сложности; по растворимости; по кислотно-основным свойствам; по пространственной структуре (глобулярные, фибриллярные). 4.2.Первичная структура белков: α-аминокислоты – структурные компоненты молекул, связанные пептидной группой. Определяющая и ведущая роль первичной структуры. Пептиды: дипептиды, трипептиды и т.д., химическое строение и название. Реакция поликонденсации. 4.3. Другие уровни структурной организации белков: вторичная, третичная, четвертичная и методы их изучения. Образование связей, поддерживающих различные уровни структурной организации белков: ( водородные, дисульфидные связи, солевые мостики, гидрофобные взаимодействия). Взаимосвязь структуры и функции. Структура коллагена. 4.4. Понятие о простых и сложных белках: альбумины, глобулины, протамины, гистоны, склеропротеины, нуклеопротеины, хромопротеины, липопротеины, фосфопротеины, гликопротеины, металлопротеины. Особенности каждой группы. 4.5..Качественные реакции на белки (цветные и осадочные). Значение определения белков для клиники; понятия: гипопротеинемия, гиперпротеинемия, диспротеинемия, протеинурия. Рекомендованная литература: 1. Н.А. Тюкавкина, Ю.И. Бауков. Биологическая химия. Учебник для студентов медвузов, М., Медицина, 2008. 2. И.А. Братцева, В.И. Гончаров. Биологическая химия. Учебное пособие г. Ставрополь, 2008 . 3. Руководство к лабораторным занятиям по биологической химии под ред. Н.А. Тюкавкиной. М. Медицина, 2009. 4. Лекционный материал. Дополнительная литература: 1. Общая химия. Учебник для медицинских вузов. (В.А. Попков, С.А. Пузанов), М, ГЭОТАР Медия, 2007 г, [1]. 2. Химия. Основы химии живого. Учебник для студентов высших учебных заведений. (В.И. Слесарев), Санкт-Петербург, Химиздат, 2000 г, [5] 3. Базы данных, информационно-справочные и поисковые системы интернет-ресурсов. Лабораторные работы. Опыт №1. – Реакция глицина с нингидрином. В пробирку поместите 4 капли 1% раствора глицина и 2 капли 0,1% раствора нингидрина. Содержимое пробирки осторожно нагрейте до появления сине-красной окраски. Опыт №2. – Реакция глицина с азотистой кислотой. В пробирку поместите 5 капель 1% раствора глицина и равный объем 5% раствора нитрита натрия. Добавьте 2 капли концентрированной уксусной кислоты и осторожно взболтайте смесь. Наблюдается выделение газа. Реакция используется для количественного определения аминогрупп в аминокислотах. Опыт №3. – Амфотерные свойства α-аланина. В первую пробирку поместите 5 капель 1% раствора α-аланина и добавьте по каплям 0,1% раствор хлороводородной кислоты, подкрашенный индикатором Конго в синий цвет (на общем столе), до появления розово-красной окраски. Во вторую пробирку поместите 5 капель 1% раствора α-аланина и по каплям добавьте 0,1% раствор гидроксида натрия, подкрашенный фенолфталеином , до исчезновения окраски. Опыт №4. – Биуретовая реакция на пептидную связь. В пробирку поместите 5-6 капель раствора яичного белка, добавьте равный объем 10% раствора гидроксида натрия и по стенке добавьте 1-2 капли раствора сульфата меди (II). Наблюдается появление красно-фиолетовой окраски. Опыт №5. – Реакция на присутствие серосодержащих α-аминокислот в белке (проба Фоля). В пробирку поместите 10 капель раствора яичного белка и вдвое больший объем 10% раствора гидроксида натрия. Содержимое пробирки перемешайте, нагрейте до кипения (12 мин). К полученному щелочному раствору добавьте 5 капель 10% ацетата свинца (II) и вновь прокипятите. Отметьте появление серо-черного осадка. Опыт №6. – Осадочная реакция на белок с концентрированной азотной кислотой (проба Геллера). К 5 каплям концентрированной HNO3 приливают 5 капель белка осторожно по стенке пробирки, наклонив ее под углом 45° так, чтобы обе жидкости не смешивались. На границе двух жидкостей образуется осадок в виде небольшого белого кольца денатурированного белка. Эта реакция широко используется в клинике для открытия белка в моче и лежит в основе количественного определения белка по методу РобертсаСтольникова.