Полифункциональные соединения
реклама
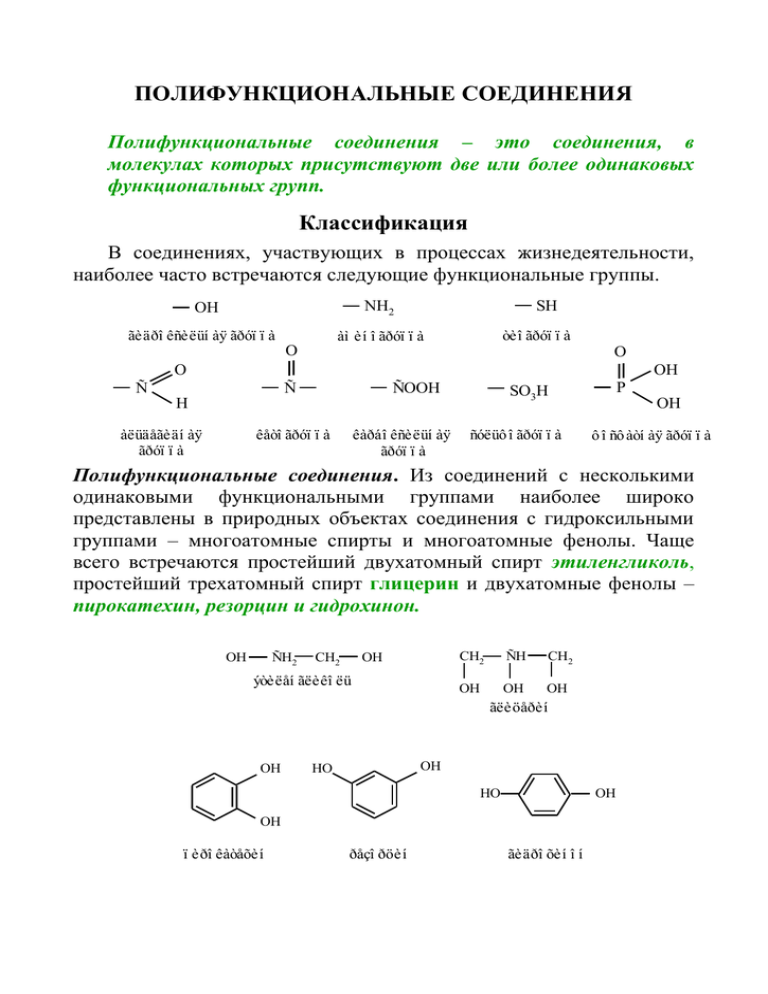
ПОЛИФУНКЦИОНАЛЬНЫЕ СОЕДИНЕНИЯ Полифункциональные соединения – это соединения, в молекулах которых присутствуют две или более одинаковых функциональных групп. Классификация В соединениях, участвующих в процессах жизнедеятельности, наиболее часто встречаются следующие функциональные группы. NH2 OH ãèäðî êñèëüí àÿ ãðóï ï à SH òèî ãðóï ï à àì èí î ãðóï ï à O O O OH Ñ Ñ ÑOOH àëüäåãèäí àÿ ãðóï ï à êåòî ãðóï ï à êàðáî êñèëüí àÿ ãðóï ï à P SO3H H ñóëüô î ãðóï ï à OH ô î ñô àòí àÿ ãðóï ï à Полифункциональные соединения. Из соединений с несколькими одинаковыми функциональными группами наиболее широко представлены в природных объектах соединения с гидроксильными группами – многоатомные спирты и многоатомные фенолы. Чаще всего встречаются простейший двухатомный спирт этиленгликоль, простейший трехатомный спирт глицерин и двухатомные фенолы – пирокатехин, резорцин и гидрохинон. OH ÑH2 CH2 OH ýòèëåí ãëèêî ëü CH2 ÑH CH2 OH OH OH ãëèöåðèí OH OH HO HO OH OH ï èðî êàòåõèí ðåçî ðöèí ãèäðî õèí î í Двухатомные фенолы – пирокатехин, резорцин, гидрохинон – входят в состав многих природных соединений. Все они дают характерное окрашивание с хлоридом железа (III). Примерами многоатомных спиртов высшей атомности служат пентиты и гекситы, спирты с открытой цепью. Накопление гидроксильных групп в молекуле ведет к появлению сладкого вкуса. Представители пентитов и гекситов – ксилит и сорбит – заменители сахара для больных диабетом. Примерами циклических спиртов служат шестиатомные спирты циклогексанового ряда. – OH OH OH HO OH HO инозиты HO HO OH OH OH OH ì åçî èí î çèò èí î çèòû Мезоинозит относится к витаминоподобным соединениям (витамины группы В) и является структурным компонентом сложных эфиров. Соединения с несколькими аминогруппами встречаются гораздо реже. Их простейший представитель – этилендиамин H2NCH2CH2NH2. Тетраметилендиамин, или путресцин H2NCH2CH2CH2CH2NH2 и пентаметилендиамин, или H2NCH2CH2CH2CH2CH2NH2 длительное время считали трупными ядами, т.е. соединениями, обуславливающими ядовитость гниющих белков. В настоящее время выяснено, что ядовитые свойства белкам при гниении придают другие вещества. К поликарбонильным относится ряд классов соединений, поскольку карбонильная группа входит в состав альдегидов, кетонов, карбоновых кислот и других соединений. Наиболее распространены дикарбонильные соединения. Ниже приведены простейшие алифатические дикарбонильные соединения – глиоксаль 1 (этандиаль), диацетил (бутандион), ацетилацетон (пентандион-2,4), щавелевая (этандиовая) кислота. O O O O O Ñ C H CH3C O CH3CCH2CCH3 CCH3 HOOC COOH H ãëèî êñàëü äèàöåòèë öåòèëàöåòî í ù àâåëåâàÿ êèñëî òà Гетерофункциональные соединения. Из соединений с двумя различными функциональными группами в природных объектах широко представлены аминоспирты, гидрокси-, амино- и оксокислоты. CH3 H2NCH2CH2OH Ñ COOH HOCH2COOH O коламин гликолевая кислота пировиноградная кислота В ароматическом ряду основу важных природных биологически активных соединений и синтетических лекарственных средств составляют п-аминофенол, п-аминобензойная кислота, салициловая кислота и сульфаниловая кислота. COOH H2N OH H2N COOH H2N SO3H OH n-àì èí î ô åí î ë n-àì èí î áåí çî éí àÿ êèñëî òà ñàëèöèëî âàÿ êèñëî òà ñóëüô àí èëî âàÿ êèñëî òà Поли- и гетерофункциональные соединения могут проявлять свойства, присущие монофункциональным соединениям, т.е. способность вступать в реакции по каждой функциональной группе. Однако одновременное наличие нескольких функциональных групп в молекуле ведет к появлению определенных различий в свойствах моно-, поли- и гетерофункциональных соединений. Вопервых, в поли- и гетерофункциональных соединениях может наблюдаться усиление или, наоборот, ослабление некоторых свойств, характерных для монофункциональных соединений. Во-вторых, в 2 поли- и гетерофункциональных соединениях могут появляться специфические химические свойства, которые наиболее важны для обеспечения биологических функций, выполняемых этими веществами. О-Ацилирование. В результате этой реакции спирты образуют сложные эфиры. В качестве ацилирующих реагентов могут использоваться как неорганические , так и органические кислоты и их функциональные производные. ÑH2 ÎH ÑH ÎH ÑH2 ÎH 3HNO3(H2SO4) -3H2O ãëèöåðèí ÑH2 O NO2 ÑH O NO2 ÑH2 O NO2 òðèí èòðàò ãëèöåðèí à В виде 1%-го раствора в этаноле или в виде таблеток тринитрат глицерина применяют в медицине при стенокардии. O ÑH2 2ÑH ÑH2 ÎH ÎH ÑH2 H3PO4 -H2O ÎH ãëèöåðèí ÑH O P + OH ãëèöåðî ô î ñô àò OH O OH OH ÑH2 ÑH2 OH ÑH ÑH2 O P OH OH OH ãëèöåðî ô î ñô àò Дегидратация. Нагревание этиленгликоля с разбавленной серной кислотой приводит к межмолекулярному отщеплению воды и образованию диоксана. 3 ÑH2 OH HO CH2 HO CH2 + ÑH2 OH ýòèëåí ãëèêî ëü O H2SO4 -2H2O O 1,4-äèî êñàí ýòèëåí ãëèêî ëü (äèî êñàí ) Глицерин при нагревании образует ненасыщенный альдегид – акролеин. ÑH2 OH ÑH2 O t ÑH ÑH2 OH Ñ -2H2O ÎH ÑH2 H ÑH CH C H O àêðî ëåèí ãëèöåðèí Окисление. Окисление полиолов является многофакторным процессом и редко приводит к индивидуальным продуктам. Так, действие азотной кислоты или триоксида хрома на этиленгликоль заключается в двух последовательно протекающих реакциях окисления спиртовых функций через альдегидные в карбоксильные: [O] HOCH2CH2OH HOCH2CH==O [O] [O] HOCH2COOH O==CHCOOH ãëèêî ëåâàÿ êèñëî òà ãëèî êñèëî âàÿ êèñëî òà ãëèêî ëåâû é àëüäåãèä ýòèëåí ãëèêî ëü [O] HOOCCOOH ù àâåëåâàÿ êèñëî òà Перманганат калия в кислой среде, окисляет виц-диолы с разрывом связи С ─ С и образованием максимально окисленных фрагментов. R 2C OH CHR / KMnO4, H+, í àãðåâàí èå R2C==O OH Замещение. 4 + R/COOH Замещение гидроксильной группы на атом галогена в многоатомных спиртах происходит под действием хлоро- или бромоводородной кислоты, газообразных галогеноводородов, галогенидов фосфора или тионилхлорида при нагревании: HOCH2CH2OH + HCl(ã) í àãðåâàí èå ýòèëåí ãëèêî ëü HO(CH2)3OH PCl5 HOCH 2CH2Cl 2-õëî ðî ýòàí î ë + HBr(ã) ï ðî ï àí äèî ë-1,3 1000C HO(CH 2)3Br ClCH 2CH2Cl 1,2-äèõëî ðýòàí HBr(ã), 1450C Br(CH2)3Br 1,3-äèáðî ì î ï ðî ï àí , 75% 3-áðî ì î ï ðî ï àí î ë-1 Хелатообразование. Поли- и гетерофункциональные соединения, содержащие одновалентные функциональные группы, такие, как ОН- или NH2группы, у соседних атомов углерода, при взаимодействии с гидроксидами тяжелых металлов, например гидроксидом меди (II), образуют внутрикомплексные, так называемые хелатные, соединения. Такие соединения обычно хорошо растворимы в воде и интенсивно окрашены, поэтому реакция используется как качественная. Примером может служить образование гликолята меди(II). 2ÑH2 2ÑH ÎH ÎH ÑH2 ÑH2 + Ñu(OH)2 2NaOH -4H2O ÎH ãëèöåðèí O O CH2 O CH HO CH2 Cu 2Na+ ÑH O ÑH2 OH ãëèöåðàò ì åäè (II) (ñèí åå î êðàø èâàí èå) Двухатомные фенолы – пирокатехин, резорцин, гидрохинон – входят в состав многих природных соединений. Все они дают характерное окрашивание с хлоридом железа (III). 5 OH OH HO HO OH OH ï èðî êàòåõèí ðåçî ðöèí ãèäðî õèí î í Дикарбоновые кислоты Дикарбоновые кислоты. К ним относят соединения с двумя карбоксильными группами. Это белые кристаллические вещества, обладающие более кислым характером, чем монокарбоновые кислоты. Некоторые дикарбоновые кислоты и их названия Формула Тривиальное название кислоты Название солей HOOC─COOH Щавелевая Оксолаты HOOC─CH2─COOH Малоновая Малонаты HOOC─(CH2)2─COOH Янтарная Сукцинаты HOOC─(CH2)3─COOH Глутаровая Глутараты Кислотные свойства этих кислот, особенно первых представителей, значительно выше, чем монокарбоновых кислот. Дикарбоновые кислоты способны образовывать два вида функциональных производных: неполные, т.е. по одной карбоксильной группе, и полные – по обеим карбоксильным группам. Кальциевые соли щавелевой кислоты малорастворимы, и поэтому они являются причиной образования оксалатных камней в почках и мочевом пузыре. Специфические свойства дикарбоновых кислот, обусловленные наличием в молекуле двух карбоксильных групп, проявляются прежде всего в их склонности к реакциям декарбоксилирования. Так, щавелевая и малоновая кислоты при нагревании легко декарбоксилируются с образованием монокарбоновой кислоты с укороченной углеродной цепью: 6 HOOC HOOC t COOH CH2 HCOOH COOH + CO 2 CH3COOH + CO 2 Дикарбоновая кислота с достаточно длинной цепью может изогнуться в виде клешни, при этом карбоксильные группы окажутся близко расположены, что характерно уже для янтарной и глутаровой кислот. Поэтому при нагревании этих кислот происходит реакция внутримолекулярного ацилирования, сопровождаемая дегидратацией, с образованием устойчивых пяти- и шестичленных циклических ангидридов. O O CH2 C CH2 OH OH H2C CH2 t O H2C -H2O C C CH2 C O O ãëóòàðî âàÿ êèñëî òà ãëóòàðî âû é àí ãèäðèä O O O O C C C C H2C OH H2C OH NH3 H2C OH H2C O-NH4+ OH H2C t -H2O H2C NH2 H2C t -H2O N H2C C C C C O O O O ÿí òàðí àÿ êèñëî òà ñóêöèí èì èä (èì èä ÿí òàðí î é êèñëî òû ) Янтарная кислота в заметном количестве находится в янтаре – отсюда она и получила свое название. Некоторые её производные, например сукцинимид (имид) и соли – сукцинаты, называют с учетом латинского названия янтаря – succinium. 7 H Представители ненасыщенных дикарбоновых кислот с одной двойной связью служат π-диастереомерные малеиновая и фумаровая кислоты. H H C C C COOH HOOC COOH H C H HOOC ì àëåèí î âàÿ êèñëî òà ô óì àðî âàÿ êèñëî òà Малеиновая кислота является менее стабильным цис-изомером по сравнению с транс-изомером – фумаровой кислотой. Однако только одна из кислот, а именно малеиновая, в относительно мягких условиях претерпевает внутримолекулярную дегидратацию с образованием циклического ангидрида. H C O H H C C C C OH H HO O t -H2O O C C C O O ì àëåèí î âû é àí ãèäðèä ì àëåèí î âàÿ êèñëî òà Фумаровая кислота достаточно широко распространена в природе и участвует в обменных процессах, протекающих в организме. В частности, она является промежуточным соединением в цикле трикарбоновых кислот. 8 9




