Регистрационный номер - Российский кардиологический научно
реклама

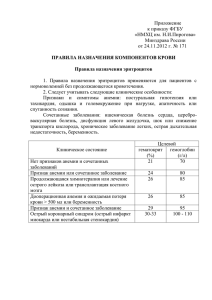
ИНСТРУКЦИЯ по медицинскому применению препарата МОНАФРАМ® Регистрационный номер Торговое название: МОНАФРАМ® Лекарственная форма: раствор для внутривенного введения. Состав: 1 мл содержит активного вещества - 5 мг F(ab’)2 фрагментов моноклональных антител FRaMon, вспомогательные вещества - 0,15 М натрия хлорида, 0,01 М натрия фосфата (рН 7,35), вода для инъекций. Описание. Прозрачная бесцветная жидкость. Фармакотерапевтическая группа: антиагрегантное средство. Код АТХ: В01АС13 ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА Характеристика. Монафрам относится к антиагрегантам – ингибиторам агрегации тромбоцитов. По механизму действия он является антагонистом гликопротеинов (ГП) IIbIIIa. Монафрам представляет собой F(ab')2 фрагменты мышиных моноклональных антител FRaMon (Фрамон) против рецептора фибриногена тромбоцитов - ГП IIb-IIIa (IIb3интегрин). Монафрам препятствует взаимодействию ГП IIb-IIIa с фибриногеном и другими лигандами и, таким образом, ингибирует агрегацию тромбоцитов. Фармакодинамика. При внутривенном болюсном введении в дозе 0,25 мг/кг массы тела Монафрам у большинства пациентов (более 90 %) через 1 час полностью ингибирует агрегационную активность тромбоцитов, измеряемую по их способности к АДФиндуцированной агрегации. Через 12 час после введения агрегационная активность 1 тромбоцитов остается сниженной в среднем более чем на 80 %, через 24 час - более чем на 60 % и через 3 суток - на 30-40 %. Способность тромбоцитов к агрегации полностью восстанавливается через неделю после введения препарата. Связанный с тромбоцитами Монафрам в течение первых 24 час после введения блокирует более 80 %, а через 3 суток 40-50 % ГП IIb-IIIa на поверхности циркулирующих тромбоцитов. У больных ишемической болезнью сердца, которым проводилась коронарная ангиопластика с высоким риском тромботических осложнений, Монафрам более, чем в 3 раза (с 11 % до 3 %), снижал количество неблагоприятных исходов (смерть от сердечнососудистых причин, инфаркт миокарда, показания к повторной реваскуляризации) в течение 1 месяца после проведения ангиопластики, по сравнению с больными, которым ангиопластика проводилась без применения Монафрама и других антагонистов ГП IIb-IIIa. Фармакокинетика. Свободный, присутствующий в плазме Монафрам полностью выводится из кровотока в течение 12 час, а связанный с тромбоцитами — в течение 6-7 дней после введения. ПОКАЗАНИЯ К ПРИМЕНЕНИЮ Профилактика тромботических осложнений у больных ишемической болезнью сердца, которым проводится коронарная ангиопластика. ПРОТИВОПОКАЗАНИЯ Состояния, характеризующиеся повышенным риском геморрагических осложнений: (1) активное внутреннее кровотечение, в том числе недавнее – до 6 недель, (2) нарушения мозгового кровообращения в последние 2 года жизни, (3) большие хирургические операции или травмы в последние 2 месяца, (4) геморрагический диатез, (5) тромобоцитопения (< 100000/мкл), (6) внутричерепные новообразования, артериовенозная фистула или аневризма сосудов; (7) васкулит, (8) неконтролируемая артериальная гипертензия (систолическое давление > 180 мм рт. ст. или диастолическое - > 110 мм рт. ст), (9) гипертоническая или диабетическая ретинопатия, (10) пункция некомпрессируемых сосудов, (11) подозрение на расслоение аневризмы аорты. 2 ДОЗИРОВКА И СПОСОБ ПРИМЕНЕНИЯ Монафрам нельзя использовать при нарушении целостности ампулы (флакона), помутнении, появлении осадка и нерастворимых частиц. При заборе препарата из ампул (флаконов) и последующих манипуляциях избегать вспенивания раствора. Препарат вводится внутривенно в виде болюсной инъекции в дозе 0,25 мг/кг массы тела. Требуемая доза разводится 10-20 мл 0,9 % раствора натрия хлорида и вводится внутривенно в течение 3-5 мин за 10-30 мин до проведения ангиопластики. При проведении коронарной ангиопластики с применением Монафрама на фоне стандартной дозы гепарина (см. ниже) устройство доступа удаляют из бедренной артерии не позже, чем через 6 час после процедуры при активированном времени свертывания (АВС) менее 175 сек и прижимают участок доступа на 30 мин. ПОБОЧНЫЕ ДЕЙСТВИЯ Тромбоцитопения. Монафрам может вызывать временное (в течение первых 3 суток после введения) и незначительное снижение количества тромбоцитов в периферической крови (на 10-30%). В редких случаях (менее 1%) после введения препарата может наблюдаться снижение количества тромбоцитов ниже 50000/мкл, требующее переливания тромбоцитарной массы. Кровотечения. Применение Монафрама может сопровождаться появлением подкожных гематом в местах пункции сосудов и незначительной кровоточивостью десен. Существует также риск развития крупных кровотечений и значимых изменений количественного состава красной крови (эритроциты, гемоглобин, гематокрит). При крупных кровотечениях рекомендуется переливание тромбоцитарной массы, а при развитии анемии - переливание эритроцитарной массы. Аллергические реакции. Нельзя исключить возможность развития аллергических реакций, и в том числе анафилактического шока. Выработка антител. Частота выработки антител против Монафрама составляет около 5 %. Их образование не связано с развитием аллергических реакций и других клинически выраженных побочных явлений. ПОВТОРНОЕ ПРИМЕНЕНИЕ Имеется опыт безопасного повторного введения препарата. Перед повторным применением необходимо провести тест на наличие в плазме/сыворотке крови антител против Монафрама. 3 ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ ПРЕПАРАТАМИ Гепарин. Гепарин вводится перед началом коронарной ангиопластики в виде болюса в дозе 60 Ед/кг, но суммарно - не более 5000 Ед. АВС поддерживается в диапазоне от 200 до 300 сек. АВС измеряется каждые 30 мин и при АВС менее 200 сек проводится болюсное введение гепарина (по 20Ед/кг) до достижения АВС более 200 сек. После проведения ангиопластики введение гепарина прекращается. Ацетилсалициловая кислота. Монафрам, как и другие антагонисты ГП IIb-IIIa, обычно применяется на фоне назначения стандартной дозы ацетилсалициловой кислоты (75325 мг/сутки). Тиенопиридины (тиклопидин и клопидогрел). Доказана целесообразность применения тиенопиридинов (клопидогреля) в сочетании с антагонистами ГП IIb-IIIa. Опыт сочетанного применения тиенопиридинов и антагонистов ГП IIb-IIIa, и в том числе Монафрама, показывает, что их совместное использование не приводит к нежелательным побочным явлениям и, в частности, к развитию геморрагического синдрома. Назначение тиенопиридинов целесообразно планировать таким образом, чтобы их действие проявилось через 2-3 дня после введения Монафрама, т.е. на фоне снижения антиагрегантного эффекта последнего. Тромболитики. Целесообразность и безопасность применения тромболитиков в сочетании с антагонистами ГП IIb-IIIa и, в том числе с Монафрамом, остается неясной. При необходимости применения тромболитиков на фоне Монафрама необходимо учитывать повышенный риск развития геморрагических осложнений. Непрямые антикоагулянты. Целесообразность и безопасность применения непрямых антикоагулянтов в сочетании с антагонистами ГП IIb-IIIa и, в том числе с Монафрамом, остается неизученной. В том случае, если Монафрам будет использован на фоне непрямых антикоагулянтов, необходимо учитывать повышенный риск геморрагических осложнений. ОСОБЫЕ УКАЗАНИЯ При применении Монафрама необходимо: определить содержание тромбоцитов перед введением препарата и затем провести повторные определения через 2-3 часа и через 24 часа после введения, провести измерения гемокоагулогических показателей для выявления возможных нарушений гемостаза, обеспечить доступность тромбоцитарной массы для возможного переливания. 4 ФОРМЫ ВЫПУСКА: Раствор для внутривенного введения. 1 флакон или 1 ампула содержит 5 мг F(ab’)2 фрагментов моноклональных антител FRaMon в 1 мл. По 1, 3 или 5 ампул или флаконов в контурной ячейковой упаковке, контурная ячейковая упаковка в картонной пачке с инструкцией по медицинскому применению. Допускается упаковка в пачке картонной с ячейками. УСЛОВИЯ ХРАНЕНИЯ В сухом, защищенном от света и недоступном для детей месте при температуре от 2 до 10оС. СРОК ГОДНОСТИ 2 года. Не применять после истечения срока годности. УСЛОВИЯ ОТПУСКА. По рецепту. НАЗВАНИЕ И АДРЕС ПРОИЗВОДИТЕЛЯ ФГУ «Российский кардиологический научно- производственный комплекс Росздрава» – Экспериментальное производство медико-биологических препаратов; 121552 г. Москва, 3-я Черепковская ул., д. 15-а, Тел./факс: (495) 149-02-13, e-mail: [email protected] Произведено для ЗАО «Фрамон»; 121552 г. Москва, 3-я Черепковская ул., д. 15-а, стр.7, Тел./факс: (495) 414-64-40, e-mail: [email protected] Претензии потребителей направлять в адрес ФГУ «РКНПК Росздрава» - ЭПМБП. Директор ИДКЭЛС Профессор В.В. Чельцов Генеральный директор ЗАО «Фрамон» М.Ю. Писцов 5