Органическая химия Биотехнология, 1 курс(очная форма) Занятия №4-6 №4-Реакционная способность органических соединений. Классификация
реклама

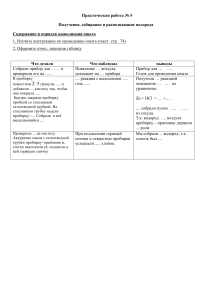
Органическая химия Биотехнология, 1 курс(очная форма) Занятия №4-6 №4-Реакционная способность органических соединений. Классификация реагентов и реакций. №5-Реакции электрофильного присоединения(Ае);алкены, диены. №6-Реакции электрофильного замещения(Sn);арены. Общая цель: Сформировать знания способности локализованных и сопряженных двойных углерод-углеродных связей в открытых системах и замкнутых циклах(реакции АЕ,SN), как основу для понимания аналогичных реакций в организме. Занятие №4 Тема: Реакционная способность органических соединений. Классификация реагентов и реакций. Учебные вопросы занятия: 1. Классификация реагентов по способу разрыва ковалентной связи (гомолитический, гетеролитический). а) Радикальные реагенты:Cl, ОН,СН3 и др. б)Ионные :электрофильные(Е+)и нуклеофильные. 2. Классификация органических реакций: а)реакции замещения- S(SR, Sе, SN ) б) реакции присоединения А(АЕ ,А N) в) реакции элиминирования (Е) г) перегруппировки, окисления-востановления. Занятие №5 Тема:Реакции электрофильного присоединения (АЕ ) Учебные вопросы занятия. 1.Электрофильное присоединение к ненасыщенным соединениям. Механизм реакций, этапы реакций галогенирования, гидрогалогенирования, воды. 2.Электрофильное присоединение к несимметричным алкенам. Правило Марковникова. 3. Присоединение к диеновым углеводородам. 4. Присоединение к алкинам. Гидротация алкинов (реакция Кучерова). Народно-хозяйственное значение этой реакции. Лабораторная работа: Опыт№1. Получение этилена из этилового спирта, проверка его свойств. В пробирку поместите 8 капель Н 2 S0 4 конц., 4капли этилового спирта и несколько крупинок Al 2 O 3 в качестве катализатора. Закройте пробирку пробкой и конец её в пробирку с перманганатом калия. Обратите внимание на быстрое обесцвечивание этого раствора. Тотчас удалите пробирку с перманганатом калия и подожгите этилен у конца газоотводной трубки; убедитесь , что он горит светящимся пламенем. Соответствующие уравнения реакций запишите в проткол. Опыт №2. Получение ацетилена из карбида кальция, проверка его свойств. В пробирку поместите кусочек карбида кальция СаС 2, добавьте несколько капель воды. Немедленно начинается выделение газообразного ацетилена. Подожгите ацетилен у отверстия пробирки, он горит коптящим пламенем. Немедленно закройте отверстие пробирки пробкой с газоотводной трубкой и опустите в заранее приготовленную пробирку с раствором с перманганатом калия. Розовый раствор быстро обесцвечивается. Соответствующие уравнения реакции запишите в протокол. Занятие №6 Тема:Реакции электрофильного замещения (S n ); арены. Учебные вопросы занятия: 1.Ароматичность бензоидных и небензоидных соединений(правило Хю0ккеля). 2.Электронные эффекты заместителей, ориентанты I и II рода 3.Реакционная способность ароматических соединений, склонность к реакциям SE/ 4. Механизм реакций галогенирования, нитрования, сульфирования, алкирования, ацилирования. 5. Окисление гомологов бензола. 6. Химическая структура и значение стерана (циклопентанпергидрофенантрена). Нафтолы. Лабораторные работы: Отличительные реакции α- и β- нафтолов. Налейте в пробирку 5 капель α-нафтола и одну каплю FeCl 3 , появляется грязно-фиолетовое окрашивание. Проделайте аналогичную реакцию с βнафтолом, получается слабое желтовато-зеленое окрашивание, а затем беловатый осадок. Напишите формулы α- и β- нафтолов.