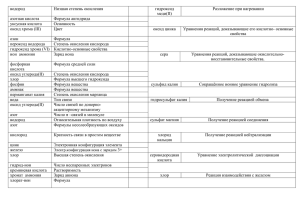
Основные классы неорганических веществ Тема урока: Основные классы неорганических веществ Тип урока: Урок обобщения и систематизации знаний Цель урока: Обобщить и систематизировать знания о классификации неорганических веществ Задачи: 1. Обобщить и систематизировать знания учащихся о составе, номенклатуре важнейших классов неорганических соединений. 2. Совершенствовать навыки составления формул сложных веществ, решения расчетных задач. 3. Способствовать формированию устойчивого интереса к предмету, развитию познавательных мотивов учащихся, внимания, воображения, памяти. 4. Формировать коммуникативные способности учащихся, воспитывать чувство взаимопомощи при работе в группах, соблюдать правила техники безопасности при проведении химического эксперимента. Методы и формы обучения: ___ Беседа ___ Фронтальная работа ___ Групповая работа ___ Лабораторная работа (работа в парах) ___ Самостоятельная работа (с тестами) Средства обучения: ___ Периодическая система и таблица растворимости ___ Наборы карточек для выполнения заданий «Классификация неорганических веществ», «Найди родственников», «Третий лишний»; «Ромашка» ___ Лабораторное оборудование и реактивы для эксперимента ___ Карточки-инструкции по выполнению лабораторной работы ___ Тестовые задания (разноуровневые) Ход урока 1. Организационный момент (целеполагание, эмоциональный настрой) Мир сложен. Он полон событий, сомнений, И тайн бесконечных, и смелых догадок. Как чудо Природы Является гений И в хаосе этом Находит порядок... Эти слова, несомненно, можно адресовать великому русскому учёному – Д.И. Менделееву. Именно он создал тот «стройный порядок», который называется периодической системой химических элементов. На сегодняшний день в неё входит 110 химических элементов. А сколько разнообразных веществ они образуют? Миллионы. И среди этих веществ тоже существует свой порядок, своё деление на классы, группы. 2.Актуализация знаний. Тема сегодняшнего урока «Основные классы неорганических веществ». Вокруг нас огромное количество химических веществ. Со многими из них мы уже познакомились. Чтобы привести наши знания в систему, необходимо знать классификацию, номенклатуру основных классов соединений, а также уметь распознавать их с помощью качественных реакций. Давайте вспомним, на какие группы делятся все неорганические вещества (работа со схемой «Классификация неорганических веществ») вещества простые металлы неметаллы оксиды основания металлов растворимые неметаллов нерастворимые сложные кислоты Кислородсодержащ. соли Бескислородные растворимые нерастворимые о д н о о с н д в у х о с н т р е х о с н о д н о о с н д в у х о с н 3. Фронтальный опрос 1. Какие вещества называют оксидами? 2. Приведите примеры твердых оксидов? Жидких? Газообразных? 3. Какие вещества называют основаниями? 4. Как определить число гидроксогрупп в формуле основания? 5. Какие вещества называют кислотами? 6. Что такое основность кислоты? 7. Чему равен заряд иона кислотного остатка? 8. Какие вещества называют солями? Дополнительные вопросы: 1. Оксид какого элемента входит в состав речного песка? 2. Оксид какого элемента называют негашеной известью? 3. Что такое гашеная известь? 4. Почему гидроксиды щелочных металлов называют едкими щелочами? 5. Какая кислота содержится в желудочном соке? 6. Какую соль мы добавляем при приготовлении пищи? Одновременно у доски работает 4 ученика по заданию «Найди родственников» - распределить вещества, формулы которых приведены на доске, по классам в составленной схеме). Формулы веществ: NaOH, NO, CaCO3, H2SО3, NaCl, Fe(OH)3, CO2 , H2S, Al2(S04 )3, Сu(0H)2 Н3Р04 , MgО, HF, Ва(OH)2, Fe2O3 , Ag3PO4 , HNO3 . Проверка выполнения задания. 4. Групповая работа Класс разделяется на 3 группы для выполнения следующих заданий: 1) «Третий лишний» Указать «лишнее» вещество и объяснить, по какому признаку оно отличается от других. а) НС1 Н2СО3 H2S б) КОН Mg (ОН)2 Ва (ОН)2 в) BaSO4 СaCO3 NaCl 2) «Родословная» («ромашка») На доске прикреплена ромашка, на лепестках которой (с обратной стороны) написаны формулы солей. Надо составить «обратные» генетические ряды для этих веществ). Каждая команд срывает по одному лепестку. Формулы солей: Fe2(SO4)3 , CaCO3 , Al(NO3)3 , Mg(NO2)2, Na3PO4 3) «Загадки лаборанта» Каждая команда должна отгадать загадку и при помощи подготовленных наборов реактивов доказать ответ. ( Ответы: 1- фенолфталеин, 2 – лакмус, 3 – метиловый оранжевый). 1. Смущает меня щелочная среда: Краснею… Но если вокруг кислота, И если в воде растворён я один, Не видно меня. Я …………… . 2. Ничего не могу я поделать с собой: Как едкая щёлочь – от страха синею. А с кислотой – совершенно другой: От пылкой любви мгновенно краснею 3. Как на прогулке от мороза, От кислоты я стану розов. А в щёлочи мой вид смешон – Я сразу жёлтый, как лимон Выполнение последнего задания подготавливает вас к следующему этапу урока – лабораторной работе. 5. Лабораторная работа «Помогите юному химику» (работа в парах) Прежде чем приступить к работе, ребята вспоминают основные правила техники безопасности. Юный химик налил в три склянки дистиллированную воду, растворы кислоты и щелочи. По халатности склянкики оказались без этикеток. Как определить горе-химику, в какой из склянок находится вода, кислота и щелочь? Учащимся раздаются задания, ход работы; вывод записывают в таблицу и сдают учителю. Лабораторная работа Исследование реакции среды растворов. Используя индикаторы распознайте в каких склянках содержатся растворы NaOH, HCl, Н20 . Результаты занесите в таблицу. Алгоритм решения задачи. 1) Прилить в 3 чистые пробирки по 1 мл исследуемых веществ. 2) Добавить во все пробирки фенолфталеин. 3) Малиновое окрашивание - NaOH 4) В 2 чистые пробирки прилить по 1 мл необнаруженных веществ. 5) Добавить лакмус или метил. оранж. 6) По изменению окраски определить вещества 7) Вывод Индикатор Фенолфталеин Метил.оранж Лакмус Вывод: 1 Номер пробирки 2 3 Изменение окраски индикаторов в зависимости от среды Название индикатора Лакмус Метиловыйоранжевый Фенолфталеин Окраска индикатора в нейтральной среде Фиолетовая Окраска индикатора в щелочной среде Синяя Окраска индикатора в кислой среде Красная Оранжевая Желтая Красно-розовая бесцветная малиновая бесцветная 6. Динамическая пауза 7. Задание «Химия дружит с математикой» «Химик не требуется такой, который из одного чтения книг понял бы всю науку, но который собственным искусством в ней прилежно упражнялся». М.В. Ломоносов Разминка: К степени окисления натрия прибавьте число атомов кислорода в молекуле серной кислоты; умножьте полученное число на максимальное число электронов на втором энергетическом уровне. Полученное число разделите на высшую степень окисления азота. Какой химический элемент имеет данный порядковый номер? (Ответ: кислород) Решите следующие расчетные задачи: I вариант. Вычислите количество вещества и число молекул, содержащих в 10,2 граммах оксида алюминия. II вариант. Вычислите объём для 0,5 моль углекислого газа. Сколько молекул содержит данное количество этого оксида? Одновременно 2 человека решают задачи у доски. 8. Итог урока (работа с тестами) 9. Домашнее задание 1. Повторить материал §§ 19 – 21 2. Выполнить упр. 3 после § 21. 3. Составить формулы солей, пользуясь таблицей растворимости. Ионы солей изображены на этикетках от бутылок из-под минеральной воды. ВАРИАНТ I Тестирование Установите соответствие. 1. Формула I. КOH II. Fe2O3 III. Mg(NO3)2 IV. H2SO4 Класс соединения А. оксид Б. основание В. кислота Г. соль 2. Формула оксида I. SO3 II. CaO III. Cu2O IV. N2O5 Степень окисления элемента А. +1 Б. +2 В. +5 Г. +6 3. Формула кислоты I. HNO3 II. H2S III. H3PO4 IV. Н2СО3 Название А. угольная Б. азотная В. сероводородная Г. фосфорная 4. Формула соли I. Na2CO3 II. FeCl2 III. K2SiO3 IV. BaSO3 Название А. силикат калия Б. сульфит бария В. карбонат натрия Г. хлорид железа (II) 1 уровень – задание I-II 2 уровень – задания I-III 3 уровень – задания I-IV 5. Для 1,5 моль оксида углерода (IV) (н.у.) найдите: 1) массу; 2) объём; 3) число молекул. 1 уровень – задание 1 2 уровень – задания 1-2 3 уровень – задания 1-3 ВАРИАНТ II Установите соответствие. 1. Формула I. H3PO4 II. Na2S III. Ca(OH)2 IV. FeO Класс соединения А. оксид Б. основание В. кислота Г. соль 2. Формула оксида I. N2O3 II. Na2O III. SO2 IV. BaO Степень окисления элемента А. +1 Б. +2 В. +3 Г. +4 3. Формула кислоты I. HNO2 II. HCl III. H2SO4 IV. Н2SiО3 Название А. кремневая Б. азотистая В. хлороводородная Г. серная 4. Формула соли I. AlPO4 II. CuCl2 III. K2SO3 IV. MgCO3 Название А. сульфит калия Б. фосфат алюминия В. карбонат магния Г. хлорид меди (II) 1 уровень – задание I-II 2 уровень – задания I-III 3 уровень – задания I-IV 5. Для 0,5 моль оксида серы (VI) (н.у.) найдите: 1) массу; 2) объём; 3) число молекул. 1 уровень – задание 1 2 уровень – задания 1-2 3 уровень – задания 1-3