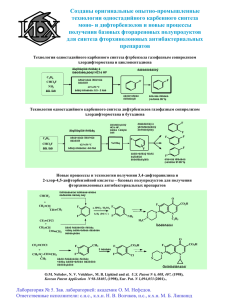
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «МИРЭА ‐ Российский технологический университет» (РТУ МИРЭА) Зубов В. П., Гомзяк В. И. Полимеры для биологии и медицины Учебное пособие Москва 2021 УДК 66:663.1+615.4 ББК 30.16+35я73 З 91 Зубов В.П. Полимеры для биологии и медицины [Электронный ресурс]: Учебное пособие / Зубов В.П., Гомзяк В.И. — М.: МИРЭА – Российский технологический университет, 2021. — 1 электрон. опт. диск (CD-ROM) В пособии изложены вопросы использования синтетических и искусственных полимеров как материалов биомедицинского назначения. Показана роль полимеров в создании биотехнологических и биоаналитических (диагностических) систем, новых лекарственных препаратов направленного действия и синтетических вакцин. Предназначено для студентов кафедры ХТВМС им. С.С. Медведева, обучающихся по направлениям «Химия» и «Химическая технология». Учебное пособие издается в авторской редакции. Авторский коллектив: Зубов Виталий Павлович, Гомзяк Виталий Иванович. Рецензенты: Ярославов Александр Анатольевич, член-корреспондент Российской академии наук, профессор, доктор химических наук, заведующий кафедрой высокомолекулярных соединений химического факультета МГУ имени М.В. Ломоносова Межуев Ярослав Олегович, профессор, доктор химических наук, заведующий кафедрой биоматериалов РХТУ имени Д.И. Менделеева Системные требования: Наличие операционной системы Windows, поддерживаемой производителем. Наличие свободного места в оперативной памяти не менее 128 Мб. Наличие свободного места в памяти постоянного хранения (на жестком диске) не менее 30 Мб. Наличие интерфейса ввода информации. Дополнительные программные средства: программа для чтения pdf-файлов (Adobe Reader). Подписано к использованию по решению Редакционно-издательского совета МИРЭА — Российский технологический университет. Обьем: 4.64 мб Тираж: 10 © Зубов В.П., Гомзяк В.И., 2021 © МИРЭА – Российский технологический университет, 2021 ОГЛАВЛЕНИЕ ВВЕДЕНИЕ ................................................................................................................. 7 ПРИМЕНЕНИЕ ПОЛИМЕРОВ В БИОЛОГИИ И БИОТЕХНОЛОГИИ .......... 8 МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ ПОЛИМЕРОВ ........................................... 10 Капсулированные лекарства ............................................................................ 10 Полимерные пролонгаторы и лекарства ......................................................... 10 Полимерные антигены и вакцины ................................................................... 10 Диагностические системы ................................................................................ 11 Заменители плазмы крови ................................................................................ 11 Контактные линзы ............................................................................................. 11 Стоматологические материалы ........................................................................ 11 Мембраны (искусственная почка, легкие) и гемосорбенты ......................... 11 Кровеносные сосуды и искусственные органы (сердечные клапаны, суставы) .............................................................................................................. 11 Искусственная кожа .......................................................................................... 12 Матриксы для регенеративной медицины ...................................................... 12 Прочие материалы ............................................................................................. 12 ПОЛИМЕРЫ ПРИРОДНОГО ПРОИСХОЖДЕНИЯ...................................... 14 Целлюлоза .......................................................................................................... 14 Крахмал .............................................................................................................. 15 Декстран ............................................................................................................. 16 Агароза ............................................................................................................... 16 Хитозан ............................................................................................................... 17 Альгиновая кислота .......................................................................................... 17 Гиалуроновая кислота ....................................................................................... 18 Полисиаловая кислота (коломиновая кислота) .............................................. 18 Желатина ............................................................................................................ 19 Фиброин ............................................................................................................. 20 Гепарин ............................................................................................................... 20 СИНТЕТИЧЕСКИЕ ПОЛИПЕПТИДЫ ............................................................. 21 СИНТЕТИЧЕСКИЕ ГИДРОФИЛЬНЫЕ ПОЛИМЕРЫ ................................ 22 Полиэтиленгликоль ........................................................................................... 22 Полиакриламид .................................................................................................. 22 Поли-N-винилпирролидон ............................................................................... 23 Поли-N-винилкапролактам .............................................................................. 24 Полиэтиленимин................................................................................................ 24 Поликонидин и политриэтилендиамин ........................................................... 24 Поливиниловый спирт ...................................................................................... 26 Полиакриловая кислота .................................................................................... 26 3 Полипептиды ..................................................................................................... 28 Полифосфазены ................................................................................................. 28 Биоразлагаемые сложные полиэфиры................................................................. 29 Полилактид ........................................................................................................ 30 Полигликолид .................................................................................................... 31 Полигидроксибутират ....................................................................................... 31 ПОЛУЧЕНИЕ ТРЕХМЕРНЫХ ПОЛИМЕРОВ (ГИДРОГЕЛЕЙ) ................ 32 Радикальная полимеризация ............................................................................ 32 Ионные реакции ................................................................................................ 33 Поликонденсация .............................................................................................. 34 Фотохимические и радиационно-инициированные сшивки ........................ 36 Биоспецифические взаимодействия ................................................................ 38 ФИЗИЧЕСКИЕ УЗЛЫ ПОЛИМЕРНЫХ СЕТОК .............................................. 39 Гидрофобные взаимодействия ......................................................................... 39 Стимулчувствительные («smart») полимеры ................................................. 40 Ионные связи ..................................................................................................... 40 Полиэлектролитные комплексы ...................................................................... 41 Кристаллизация ................................................................................................. 42 ХАРАКТЕРИСТИКИ СЕТОК .............................................................................. 43 Термодинамический метод............................................................................... 43 Механические свойства гелей .......................................................................... 45 Транспортные свойства гелей .......................................................................... 46 МАКРОПОРИСТЫЕ ГЕЛИ.................................................................................. 49 Физико-химический подход к получению макропористых систем на основе фазового расслоения ......................................................................................... 49 Макропористые материалы на основе кремнезема ........................................... 52 Силикагели ......................................................................................................... 52 Макропористые стекла ..................................................................................... 52 Макропористые органические полимерные гели .............................................. 53 Порообразователи ................................................................................................. 54 ЭЛЕКТРОФОРЕЗ .................................................................................................... 57 Электрофорез в гелях. Белковый электрофорез ............................................. 58 Электрофорез нуклеиновых кислот в гелях ................................................... 64 ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ ............................................................... 66 Эксклюзионная хроматография ....................................................................... 67 Ионообменная хроматография......................................................................... 71 Хроматофокусирование .................................................................................... 73 Обращенно-фазовая хроматография ............................................................... 74 Хроматография гидрофобного взаимодействия ............................................ 75 Металло-хелатная хроматография................................................................... 76 4 Ковалентная хроматография ............................................................................ 77 Аффинная хроматография ................................................................................ 78 МЕТОДЫ ИММОБИЛИЗАЦИИ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ И БЕЛКОВ НА ПОЛИМЕРНЫХ МАТРИЦАХ ................. 80 РАСПРЕДЕЛЕНИЕ МЕЖДУ ЖИДКИМИ ВОДНЫМИ ФАЗАМИ ............. 85 Термодинамические основы метода................................................................ 85 Общие закономерности распределения между фазами................................. 88 Аффинное распределение................................................................................. 90 Аффинное осаждение........................................................................................ 91 Аффинное осаждение в двухфазных системах .............................................. 92 Биосепарация ..................................................................................................... 92 Биокатализ в двухфазных системах ................................................................ 94 Получение глюкозы из крахмала ..................................................................... 95 Превращение гидрокортизона в преднизолон................................................ 95 ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ. БИОКАТАЛИЗ ........................... 97 Получение глюкозо-фруктозных сиропов ...................................................... 97 Разделение рацемических смесей аминокислот............................................. 99 Гидролиз лактозы (молочного сахара) ............................................................ 99 БИОАНАЛИТИЧЕСКИЕ СИСТЕМЫ ............................................................. 100 Иммуно-ферментный анализ.......................................................................... 100 Роботизированный ИФА-анализатор (Immuno-1) ....................................... 105 Ферстеровский резонанс ................................................................................. 107 Поверхностный плазмонный резонанс ......................................................... 108 Спектрально-фазовая интерферометрия ....................................................... 110 ПОЛИМЕРНЫЕ ЧАСТИЦЫ В БИОЛОГИИ И МЕДИЦИНЕ ................... 111 Полимерные дисперсии (латексы) размером 0.1-10 мкм ............................ 111 Полимерные частицы диаметром 10 нм ....................................................... 114 Крупные полимерные частицы (250-300 мкм) ............................................. 115 ПРОБЛЕМЫ МЕДИЦИНСКОГО ИСПОЛЬЗОВАНИЯ ПОЛИМЕРОВ .. 118 Капсулированные лекарства .......................................................................... 121 Стимул-зависимые гели (системы с обратной связью) ............................... 124 Методы и технология капсулирования ......................................................... 126 Химический метод .......................................................................................... 126 Распылительная сушка.................................................................................... 128 Микрокапсулирование в псевдокипящем слое ............................................ 129 Испарение летучего растворителя в эмульсиях ........................................... 129 (Со)экструзия ................................................................................................... 130 ПОВЕДЕНИЕ ПОЛИМЕРОВ И МОЛЕКУЛЯРНЫХ КОНЪЮГАТОВ НА ОСНОВЕ ПОЛИМЕРОВ И АФС В ОРГАНИЗМЕ ........................................ 132 ПОЛИМЕРЫ С СОБСТВЕННОЙ ФИЗИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ .................................................................................................. 134 Нейтральные гидрофильные полимеры ........................................................ 134 5 Поликатионы.................................................................................................... 134 Полианионы ..................................................................................................... 137 Полимерные антигены и субъединичные вакцины ..................................... 140 СПИСОК ЛИТЕРАТУРЫ ................................................................................... 142 6 ВВЕДЕНИЕ Полимеры являются одними из основных материалов современной цивилизации. Они выполняют роль как крупнотоннажных конструкционных материалов, так и малотоннажных, но очень важных функциональных компонентов в современных устройствах различного назначения. Это в полной мере относится и к современной биологии и медицине, тем более, что все живое – это мир биополимеров (белков, нуклеиновых кислот, полиуглеводов), осуществляющих все основные сложнейшие функции живых организмов. Естественно, что, для взаимодействия с этим миром, в особенности на молекулярном уровне, что и является предметом внимания современной биомедицины, следует ожидать важной роли различных полимеров, – как общего, так и очень специализированного функционального назначения. Данное учебное пособие является попыткой познакомить читателей с миром полимеров биомедицинского назначения. Оно основано на курсе лекций, разработанных и читаемых профессором Зубовым В.П. на протяжении ряда лет студентам кафедры химии и технологии высокомолекулярных соединений им. Медведева С.С. Института тонких химических технологий имени М.В. Ломоносова РТУ МИРЭА. Раздел «Электрофорез» подготовлен к.х.н. Жигис Л.С. (ИБХ имени академиков М.М. Шемякина и Ю.А. Овчинникова РАН). В пособии рассмотрены вопросы, связанные с применением высокомолекулярных соединений в биотехнологии и медицине. Значительное внимание уделено взаимодействию полимерных материалов с живыми тканями, биохимическим аспектам биосовместимости и биодеградации, а также характеристике отдельных видов полимеров, применяющихся в данных областях. Авторы отдают себе отчет в том, что в рамках этого краткого конспекта невозможно сколько-нибудь полноценно охватить всю обширную и очень разнообразную область биомедицинских материалов. Тем более, что, по многим разделам области имеются обстоятельные монографии и обзоры. Так, в данном курсе не рассматриваются такие важные направления, как полимерные имплантаты, материалы для регенеративной медицины, стоматологии, офтальмологии и многие другие. Основное внимание в данном учебном пособии будет обращено на некоторые аспекты химии полимеров биомедицинского назначения и на взаимодействия полимеров с биологическими объектами in vitro и in vivo на молекулярном уровне. 7 ПРИМЕНЕНИЕ ПОЛИМЕРОВ В БИОЛОГИИ И БИОТЕХНОЛОГИИ Современная биология, биотехнология и медицина, равно как и другие области науки и техники, основаны на фундаментальных научных открытиях, определивших их нынешнее состояние. Но реализация этих достижений практически невозможна без создания (разработки) новых специальных материалов. Данный курс является попыткой обсудить роль полимерных материалов в развитии биологии и медицины. Начнем с биологии. Современная биология сформировалась сравнительно недавно и стала результатом целой серии важнейших фундаментальных открытий, большинство из которых было отмечено Нобелевскими премиями. Некоторые из них приводятся ниже. 1953 г. – определение строения (т.е. последовательности аминокислотных звеньев) Ф. Сенгером (Sanger) в 1953-1956 гг. первого белка инсулина (полипептидного гормона). 1953 г. – определение структуры двойной спирали ДНК и комплементарных связей азотистых оснований Дж. Уотсоном (Watson) и Ф. Криком (Crick). 1960 г. – определение третичной структуры белка (методом рентгеноструктурного анализа) Дж. Кендрью (Kendrew) и М. Перутцем (Perutz) в Кембридже. 1963 г. – Р.Б. Меррифилд (Merrifield) разработал твердофазный синтез пептидов. С помощью этого метода удалось искусственно синтезировать фермент рибонуклеазу и другие белки. 1963 г. – расшифровка генетического кода М.У. Ниренбергом (Nirenberg). 1970 г. – химический синтез ДНК Г. Кораной (Khorana). 1972 г. – Пол Берг (Berg) получил первую рекомбинантную ДНК. 1976 г. – определение последовательности нуклеотидов в нуклеиновых кислотах Гилбертом (Gilbert) и Сэнгером (Sanger). 1979 г. – введение ДНК в клетки – Кейичи Итакура (Itakura). На базе этих и других фундаментальных научных открытий стало возможно не только глубже на молекулярном и клеточном уровне понимать механизмы жизненных процессов, но и разработать совершенно новые технологии, в частности, для получения фармакологических препаратов биологической сложности, например, полипептидов и белков, это привело к возникновению новой науки – молекулярной биотехнологии. 8 Рассмотрим примерную схему биотехнологического процесса получения биологически активного препарата белковой природы. 1) Синтез олигонуклеотида – фрагмента гена целевого белка (на полимерном носителе с помощью синтезатора); 2) Выделение полноразмерного гена (на полимерном носителе с магнитным ядром); 3) Введение нужного гена в плазмиду, а затем в клетки; 4) Клонирование клеток и выбор клона, со встроенным геном (рекомбинантным) – на полимерном геле; бактериальные посевы рост бактериальных клонов клоны Рисунок 1. Схема клонирования в гидрогеле 5) Масштабное культивирование клеток (происходит на поверхности полимерных микросфер – животные клетки поверхностно зависимы). Бактериальные клетки часто выращивают внутри частиц гидрогеля; Рисунок 2. Схема культивирования клеток на микроносителях: а) на поверхности частиц носителя; б) в объеме гидрогелевого носителя 6) Выделение и очистка целевого продукта (более 90 % расходов на весь процесс, 99.99 % – чистота) на гелях, мембранах, пористых волокнах, дисперсиях полимерных микросфер; 7) Анализ/диагностический контроль (использование дисперсий, гелей, мембран для постановки анализа). Как мы видим, практическая реализация биотехнологической цепочки, каждый этап которой основан на фундаментальных научных открытиях, требует использования специальных полимерных материалов. Этап 1 – это полимерный носитель (реагент). Этап 2 – это частицы полимерной дисперсии с диаметром < 1 мкм. Этап 4 – это полимерный гидрогель. Этап 5 – твердые или гелеобразные частицы с диаметром ~ 102 мкм и/или полимерные пористые мембраны. Этапы 6 и 7 – это серия пористых и непористых носителей, мембран, дисперсий. Список рекомендованной литературы к разделу: [1], [2], [3]. 9 МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ ПОЛИМЕРОВ Медицину нельзя считать молодой отраслью знаний. Однако, в современной медицине, основанной на знаниях молекулярных основ жизни, специализированные полимерные материалы и системы играют не менее важную роль, чем в биотехнологии. Их можно сгруппировать по выполняемым задачам. Терапевтические системы Капсулированные лекарства Большинство применяемых в настоящее время лекарственных препаратов являются низкомолекулярными веществами синтетического или природного происхождения. При непосредственном приеме таких препаратов (перорально, инъекционно), их концентрация в крови быстро растет, часто превышая токсический уровень, а затем они быстро выводятся из организма (через почки). Поэтому, большинство используемых в настоящее время форм препаратов капсулировано, т.е. таблетка защищена «умными» полимерными мембранами, которые контролируют время, место и скорость выделения препарата (желудок, кишечный тракт и т.д.), и даже момент выделения лекарственного средства (системы с обратной связью). Отдельной разновидностью капсулированных систем являются гидрогелевые накладки для трансдермальной доставки лекарств (в том числе и в ротовой полости). Полимерные пролонгаторы и лекарства В отличие от предыдущего случая (макроскопические системы), речь идет о молекулярных конъюгатах как низко-, так и высокомолекулярных (белки) лекарственных соединений с полимерами, с целью увеличить время циркуляции в кровотоке, снизить или устранить иммунную реакцию и биодеградацию в организме, добиваться адресной доставки лекарства в органмишень. Отдельным видом являются полимерные лекарства, у которых физиологическая активность проявляется только в полимерной форме. Полимерные антигены и вакцины Эта группа веществ обеспечивает терапевтическое действие, направленно активируя иммунную систему организма. Связывание низкомолекулярных 10 антигенов с макромолекулярными носителями существенно усиливает иммунный ответ и открывает путь к созданию искусственных вакцин. Диагностические системы Задача диагностических систем – молекулярное «узнавание» соответствующих молекул. Иммунный анализ – определение белков и др. иммуноактивных молекул; генетический анализ – работа с генным материалом. Материалы и имплантаты Заменители плазмы крови Это водорастворимые биосовместимые полимеры, водные растворы которых восполняют необходимое для кровоснабжения количество крови при экстренных потерях. Они соответствуют плазме крове по реологическим, осмотическим свойствам, нейтрализуют токсины, и за определенное время (1– 2 сут.) выводятся из организма. Контактные линзы Это сшитые гидрогели с необходимыми оптическими свойствами, водо- и кислородопроницаемостью и биосовместимостью. Стоматологические материалы Это отверждающиеся (обычно УФ-светом) полимерные композиции, имитирующие по свойствам поврежденные или отсутствующие части зубов (длительная прочность, биосовместимость и проч.). Мембраны (искусственная почка, легкие) и гемосорбенты Мембраны и гемосорбенты – это полимерные системы, предназначенные для экстракорпорального отделения из крови токсичных веществ с возвращением очищенной крови в организм. Кровеносные сосуды и искусственные органы (сердечные клапаны, суставы) Кроме необходимого комплекса физико-механических свойств (прочность, гибкость и т.д.), указанные материалы должны обладать антитромбогенными свойствами, что обеспечивается созданием гемосовместимых групп на поверхности. 11 Искусственная кожа Материалы, применяемые при поражениях участков кожи. Они, наряду с необходимыми физико-механическими характеристиками, должны обладать адгезионными свойствами (к тканям), а также обеспечивать защиту от инфекции при сохранении влагопроницаемости. Матриксы для регенеративной медицины Губчатые материалы на основе биосовместимых полимеров (в частности, на основе производных лактида) представляют большой интерес для тканевой инженерии. В зависимости от морфологии и состава полимерной матрицы, возможно использование губок в самых разных областях, например, для регенерации костной ткани, для регенерации хрящевой ткани, для регенерации кожи и т.д. Помимо применения данных материалов в тканевой инженерии, из-за возможности включения в поры и полимерную матрицу лекарственных препаратов, они могут быть использованы в качестве носителей лекарственных соединений. Прочие материалы Применение полимеров для изготовления изделий медицинского назначения позволяет осуществлять серийный выпуск инструментов, предметов ухода за больными, специальной тары и посуды, а также упаковочных материалов, обладающих рядом преимуществ перед аналогичными изделиями из металлов и стекла: экономичностью, в ряде случаев – повышенной стойкостью к действию различных сред, возможностью выпуска изделий разового пользования (шприцы, флаконы, пленки, трубки и проч.). Основными требованиями, предъявляемыми к полимерам и материалам на их основе, используемым для производства изделий биомедицинского назначения, являются: необходимый комплекс физико-механических свойств, зависящий от конкретного назначения материала; повышенная химическая стойкость, обусловливающая стабильность изделий под воздействием жидких сред; минимальное содержание низкомолекулярных примесей (катализаторов, стабилизаторов и проч.); способность выдерживать различные виды стерилизации (радиационная или тепловая стерилизация данных изделий не 12 должна сопровождаться появлением токсичных продуктов или снижением механических характеристик). Таблица 1. Некоторые полимерные материалы, применяемые в медицине и биологии (сводная таблица) линейные полимеры заменители плазмы крови; носители лекарств; физиологически активные полимеры; вакцины; полибуферы; несмешивающиеся жидкие водные фазы. сшитые полимеры (гидрогели) жидкостная хроматография; электрофорез; носители (пролонгаторы) лекарств; глазные линзы; имплантаты; биоаналитические системы; полимерные реагенты (синтез белков, РНК); иммобилизованные ферменты. пористые мембраны (волокна) культивирование клеток; биотехнология (ферменты, клетки); искусственные легкие, почки, кожа. полимерные дисперсии биоанализ; наномедицина; культивирование клеток. 1 2 3 4 Таким образом, в качестве биомедицинских материалов используются: 1) Линейные водорастворимые полимеры (заменители плазмы крови, носители лекарств, вакцины, полимерные буферные растворы). Водные растворы различных полимеров образуют несмешивающиеся жидкие фазы. 2) Сшитые полимеры – гидрогели (жидкостная хроматография – ВЭЖХ, электрофорез, пролонгированные лекарства, линзы, имплантаты, биоаналитические системы, полимерные реагенты, иммобилизация ферментов). 3) Полимерные мембраны (биоанализ, культивирование клеток). 4) Полимерные дисперсии (биоанализ, наноносители лекарств, культивирование клеток). Список рекомендованной литературы к разделу: [1], [6], [14], [18]. 13 ПОЛИМЕРЫ ПРИРОДНОГО ПРОИСХОЖДЕНИЯ По происхождению различают природные и синтетические высокомолекулярные соединения. Мы будем рассматривать, в основном, гидрофильные полимеры, которые контактируют и взаимодействуют с биологическими объектами in vitro и in vivo на молекулярном уровне. Полисахариды – одна из основных групп природных полимеров (наряду с белками, нуклеиновыми кислотами, лигнином). К ней относятся целлюлоза, хитин и хитозан, декстраны, крахмал, полисахариды водорослей и пектины. Полисахариды широко используются для создания различных препаратов и изделий медицинского назначения. Основные природные источники полисахаридов: наземные растения, водоросли, ткани животных и др. Полисахариды состоят из звеньев моносахаридов, которые входят в состав полисахаридов в виде циклов. Целлюлоза Целлюлоза – наиболее распространенный природный полимер. Она содержится в любом растении, более того, обнаружена даже в организмах низших беспозвоночных. Макромолекулы целлюлозы построены из элементарных звеньев D-глюкозы, соединенных 1,4-β-гликозидными связями в линейные неразветвленные цепи. Элементарное звено макромолекулы целлюлозы имеет конформацию кресла с экваториально расположенными группами -OH и -CH2OH. Благодаря стереорегулярному строению и интенсивному межмолекулярному взаимодействию посредством водородных связей, природная целлюлоза характеризуется сравнительно высокой степенью кристалличности, образует анизотропные структуры, не растворяется в воде и в традиционных органических растворителях. Известен органический растворитель – N-метилморфолин N-оксид, который способен растворять целлюлозу с образованием гомогенного раствора (процесс Lyocell). 14 N-метилморфолин N-оксид Основные направления модификации целлюлозы по ОН-группам: вводим -OCH3, -OC2H5, -OCH2CH2OH – происходит нарушение регулярности и кристалличности, полимер становится водорастворимым. при введении более гидрофобных групп (например, -OCH2CH2CH2OH или -OCH2CH2CH3), полимер растворим в воде только при температуре ниже Тнктр (нижней критической температуры растворения) – smart-полимер. при введении кислотных или сильно-кислотных групп, полимер становится pH-чувствительным, водорастворимым – это слабый катионообменник. для придания свойств анионообменника, проводят реакцию целлюлозы с 2-хлортриэтиламином (получение диэтиламиноэтилцеллюлозы, ДЭАЭ): Рисунок 3. Схема реакции целлюлозы с 2-хлортриэтиламином Крахмал Крахмал представляет собой смесь полисахаридов амилозы и амилопектина, мономером которых является α-глюкоза. Содержится в плодах растений. Возможна модификация по гидроксильным группам (аналогично целлюлозе). 15 Декстран Декстран – водорастворимый биополимер, являющийся продуктом жизнедеятельности бактерии Leuconostoc mesenteroides. Декстран представляет собой разветвленный полимер, макромолекулы которого состоят из звеньев αD-глюкопиранозы, связанных, главным образом, α-1-6-гликозидными связями, и, в небольшом количестве, – α-1-3-гликозидными связями. В медицине декстраны используются в качестве компонентов крове- и плазмозамещающих растворов, носителей лекарственных веществ различной природы (в том числе белковой), растворов для консервации имплантируемых органов, в частности, в криоусловиях. Диэтиламиноэтилдекстран (ДЭАЭ-декстран) – полимерный катион, используемый для снижения уровня холестерина и триглицеридов в крови. Сшитый декстран в виде сферических гранул марки Sephadex используется как сорбент для гель-хроматографического разделения фракций водорастворимых полимеров и как носитель для создания различных сорбционных материалов, в первую очередь ионообменных. Агароза Агар (агар-агар) – гидрофильный, ограниченно набухающий гелеобразующий полисахарид нерегулярного строения, получаемый из морских водорослей. Агар включает два компонента: агарозу (50-80 %) и агаропектин. Агароза растворяется в горячей воде, но, при охлаждении до 45 ºС и ниже, даже при низких концентрациях (менее 3 мас. %), образует агарозные гели, которые используют для биосепарации и для культивирования клеток. 16 Химически сшитые производные агарозы (Sepharose, BIO-RAD, BIOGEL) широко используются как биосорбенты в хроматографии. Sepharose (агароза с поперечными сшивками) применяется для препаративной очистки белков (например, ДНК-связывающие факторы, коагулирующие белки, липопротеины). Хитозан Хитин – второй после целлюлозы наиболее распространенный природный полимер, основной структурный материал у многих беспозвоночных животных, таких как насекомые и ракообразные. При деацетилировании хитина свыше 50 %, он становится растворимым в разбавленных кислотах (например, в уксусной) и называется хитозаном. Хитозан обычно получают щелочным или ферментативным гидролизом амидной группы в хитине. Молекулярная масса хитозана составляет ~ 0.1–4⋅106 Da. На основе хитина и хитозана разработаны эффективные радиопротекторы, антикоагулянты с высокой антигепариновой активностью, порошки и пленки с кровеостанавливающей и ранозаживляющей активностью для обработки ран, апирогенные хирургические нити, компоненты перевязочных материалов для заживления ран, биосорбенты, биологически активные добавки, мембраны для аппаратов «искусственная почка», носители лекарств и мн. др. Альгиновая кислота Альгиновая кислота – полисахарид, добываемый из бурых водорослей, является гетероцепным полимером, который образован двумя мономерами: Dманнуроновой и L-гулуроновой кислотами, являющимися остатками полиуроновых кислот, их пропорции зависят от вида водорослей. 17 Альгиновая кислота и ее соли с одновалентными металлами растворима в воде, но, при взаимодействии с двухвалентными и трехвалентными катионами (Mg2+, Ca2+, Ba2+, Sr2+, Al3+, Fe3+), образует гели различной жесткости, которые можно растворить хелатирующим агентом. В области медицины альгинаты используются в системах доставки биологически активных веществ, в качестве инъекционного средства сайтспецифической доставки клеток (хондроцитов, стромальных клеток костного мозга) и различных факторов (нейротрофического фактора головного мозга, основного фактора роста фибробластов). Гиалуроновая кислота Гиалуроновая кислота (гиалуронат, гиалуронан) – несульфированный гликозаминогликан, входящий в состав соединительной, эпителиальной и нервной тканей. Является одним из основных компонентов внеклеточного матрикса, содержится во многих биологических жидкостях (слюне, синовиальной жидкости и др.). Принимает участие в пролиферации и миграции клеток. Спираль составлена из трех дисахаридных блоков на виток. Связывает тысячекратное количество воды. Глаз (стекловидное тело) состоит из 1 % гиалуроновой кислоты и 98 % воды. Полисиаловая кислота (коломиновая кислота) Сиаловые ацилированные кислоты (СК) – полифункциональные соединения, производные нейраминовой кислоты. Это бесцветные 18 кристаллические вещества, хорошо растворимые в воде. Содержатся в слизистых оболочках и тканях внутренних органов, секретах слюнных желез, спинномозговой жидкости, плазме крови. Участвуют в транспорте катионов и процессах клеточного «узнавания». Образуют полимеры – полисиаловую кислоту (ПСК). Некоторые штаммы бактерий имеют ПСК в составе олигосахаридов на поверхности клеточных мембран. Коломиновая кислота используется для поверхностной модификации имплантируемых диагностических и терапевтических систем с целью гидрофилизации поверхности и улучшения биосовместимости. Желатина Желатина (желатин) – белковый материал, полидисперсная смесь полипептидов (ММ ~ 50 000–70 000 Da) и их агрегатов (ММ ~ 300 000 Da). Образуется гидролизом из коллагена при длительной обработке дермы, костей, хрящей с последующим экстрагированием водой при 50-100 ºС (представляет собой денатурированный белок). Желатина образует прочные гели при температурах ниже 40 ºС. Процесс желатинизации состоит в переходе от раствора, содержащего свободные цепи белка, к трехмерной пространственной структуре, стабилизированной межмолекулярными водородными связями и силами межмолекулярного взаимодействия. В фармацевтической промышленности желатина широко используется при производстве твердых и мягких капсул, лечебных сывороток, биологических растворов для внутривенного вливания, модификаторов эндопротезов сосудов. Желатина – один из компонентов среды для проведения бактериологических анализов, производства биомедицинских тест-систем и косметики. 19 Фиброин Фиброин – основной белок шелка, который получают из коконов шелкопряда Воmbух mori и родственных видов. Фиброин не растворяется в воде, а также в разбавленных растворах многих кислот и щелочей, но растворим в концентрированных растворах хлорида лития, тиоцианата лития и кальция, хлорида кальция. Фиброин применяется в сфере регенеративной медицины в качестве материала для изготовления матриксов, пленок, гидрогелей, микро- и макроносителей для клеточных культур, а также в составе конструкций для доставки лекарственных и биологически активных веществ в организме. Гепарин Гепарин – сульфатированный гликозаминогликан (мукополисахарид), состоящий из остатков D-глюкозамина и D-глюкуроновой кислоты. В больших количествах гепарин содержат печень, легкие, слизистая оболочка кишечника. Для медицинских целей гепарин выделяют из слизистой оболочки кишечника свиньи и из легких крупного рогатого скота. Применяется для профилактики и терапии тромбоэмболических заболеваний, при операциях на сердце и кровеносных сосудах, для поддержания жидкого состояния крови в аппаратах искусственного кровообращения и гемодиализа, а также для предотвращения свертывания крови при лабораторных исследованиях. Список рекомендованной литературы к разделу: [2], [7]. 20 СИНТЕТИЧЕСКИЕ ПОЛИПЕПТИДЫ Пептиды, играющие большую роль в жизнедеятельности организмов в качестве гормонов, регуляторов, передатчиков импульсов и т.д., представляют собой олигомеры (или полимеры) α-аминокислот, соединенных амидными связями. Синтетические пептиды широко используются для структурнофункциональных исследований, или как носители биологически активных веществ, благодаря их биосовместимости и низкой иммуногенности. Пептидный синтез – это построение пептидной цепи путем соединения аминокислот химическими методами. Обычно получают пептиды, содержащие 40-45 аминокислот, но можно получать и небольшие белки. Синтез полипептидов с биологически значимой первичной структурой чрезвычайно трудоемок из-за раздельности проведения каждой стадии присоединения последующего аминокислотного звена, и необходимости очистки продуктов от избытка реагентов и побочных веществ на каждой стадии [2]. Для того, чтобы получить прямым одностадийным способом простые линейные полиаминокислоты методом поликонденсации α-аминокислот, необходимо предотвратить димеризацию α-аминокислот: Рисунок 4. Реакция димеризации α-аминокислот Поэтому, для синтеза таких гомо- или сополимерных линейных полипептидов используют реакцию полимеризации карбоксиангидридов αаминокислот с раскрытием цикла и выбросом диоксида углерода. Реакция идет по механизму живых цепей, что позволяет получать полимеры заданной молекулярной массы с узким ММР. R O O A NH - NH R O H3C CH3 HC CH2 NH полилизин (ПЛ) CH3 HC H3C CH2 4 CH3 O O O NH CH3 HC H3C - CO 2 O NH H3C CH2 2 C C HO CH3 HC O полиглутаминовая кислота HO O полиаспарагиновая кислота Рисунок 5. Полимеризация карбоксиангидридов α-аминокислот с раскрытием цикла 21 СИНТЕТИЧЕСКИЕ ГИДРОФИЛЬНЫЕ ПОЛИМЕРЫ Полиэтиленгликоль O H2C CH2 O CH2 HO CH2 H n Полиэтиленгликоль (ПЭГ) – водорастворимый неионный полимер, получаемый полимеризацией этиленоксида с раскрытием цикла. В зависимости от средней молекулярной массы, ПЭГ – вязкая бесцветная жидкость, воскообразный или твердый продукт. Методами анионной полимеризации можно получать полиэтиленгликоль и его производные, статистические и блок-сополимеры, которые различаются по гидрофильно-липофильному балансу. Такие полимеры являются поверхностнои мембрано-активными, с концевыми функциональными группами или без них. При их сшивке получаются гидрогели. ПЭГ биоразложим (медленно, неспецифично гидролизуется в организме), неиммуногенен. Используется для защиты белковых лекарственных препаратов от иммунной реакции организма, делая их «малозаметными» («stealth»). Диблок- и триблок-сополимеры этиленгликоля и пропиленгликоля являются эффективными неионными поверхностно-активными веществами и широко применяются в биотехнологии и ряде других областей. Торговые названия: «Pluronic» или «Проксанол». Некоторые из них растворимы в воде только ниже определенной температуры, то есть являются температурнозависимыми smart-полимерами. Полиакриламид H3C CH2 H2N CH3 HC C n O Полиакриламид – хорошо растворим в воде, широко применяется в качестве гелеобразователя, пленкообразователя, флокулянта и коагулянта. Полиакриламид является основой для создания гидрофильных носителей для биологически активных веществ. Основным методом синтеза полимеров на основе акриламида (АА) и других ненасыщенных амидов является радикальная полимеризация. При переходе к производным акриламида, например, Nизопропилакриламиду, возможно получать «умные» (smart) полимеры, 22 обладающие температрурно-зависимой растворимостью в воде, а именно НКТР – способностью переходить в гелевую фазу при T>TНКТР и обратно при незначительном изменении температуры. Сополимеры акриламида с высшими N-алкилакриламидами (например, -C16H31) нерастворимы в воде, но образуют набухающие гидрогели. Поли-N-виниламиды Поли-N-винилформамид легко гидролизуется и его используют в синтезе поли-N-виниламина. Другие поли-N-виниламиды гидролитически устойчивы. Рисунок 6. Схема синтеза поли-N-виниламина Поли-N-винилацетамид биологически инертен. хорошо растворим H3C O в воде, химически и C HN H3C CH CH3 CH2 n Поли-N-винилпирролидон Поли-N-винилпирролидон (ПВП) водорастворим, биологически инертен, не разрушается в организме, комплексуется со многими веществами. Применяется как антисептик, материал для хрусталиков глаза и др. Водный раствор поливинилпирролидона широко применяют как заменитель плазмы крови. 23 Поли-N-винилкапролактам H3C HC CH2 n N CH3 O Поли-N-винилкапролактам (ПВК или ПВКЛ) представляет собой химически стойкий, биосовместимый, чувствительный к изменениям температуры полимер. Растворяется в холодной воде, при температурах выше 34 ºС теряет растворимость (smart-полимер), осаждается и образует гидрогель. Полиэтиленимин Полиэтиленимин и его производные ионогенны, биологически активны. Применимы в качестве носителей биологически активных соединений. В силу особенностей полимеризации этиленимина, обычно образуется разветвленный полимер с широким молекулярно-массовым распределением (ММР), содержащий первичные, вторичные и третичные аминогруппы. Это позволяет использовать его в качестве полибуфера, но затрудняет применение в качестве носителя биологически активных веществ. III H2C CH2 N H + K H3C CH2 CH2 N CH2 CH2 II NH CH3 CH2 H2C NH2 I Рисунок 7. Реакция полимеризации этиленимина Полимеры со вторичными аминогруппами в цепях и узким ММР можно получать полимеризацией циклических мономеров – конидина и триэтилендиамина, проходящей по механизму живых цепей. Поликонидин и политриэтилендиамин Разработка и исследование биологической активности производных конидина были вызваны поиском новых антагонистов гепарина. Синтетические антигепаринаты обладают более высокой специфичностью связывания с гепарином и не вступают во взаимодействие с белками плазмы. Полимеры на 24 основе конидина – полиэлектролиты. Кроме того, возможно получать различные производные, водорастворимость, токсичность и другие физиологические свойства которых зависят от введения заместителей по атомам азота. Установлено, что производные конидина оказывают многофункциональное воздействие на иммунную систему (проявляют иммуностимулирующую активность). Иммуностимулирующее действие складывается из усиления функциональной активности макрофагов и активации лимфоцитов. CH2 N + K H2N CH2 CH2 CH2 NH2 N N N CH2 CH2 CH2 CH2 n Рисунок 8. Схема полимеризации конидина Другим аналогичным полимером, получаемым азотсодержащего цикла, является политриэтилендиамин. N N H2N N CH2 N CH2 N N путем раскрытия CH2 CH2 CH3 n Рисунок 9. Схема полимеризации триэтилендиамина Получаемые полимеры токсичны и не растворимы в воде при нейтральных pH. Поэтому их подвергают дальнейшей модификации по атомам азота в мономерных звеньях. H2N N N CH2 O R-Br N + N CH2 CH2 Cl H2N NH2 n - NH2 n CH2 C L-X H2N CH2 [O] OH + N N CH2 CH2 CH2 R Br C O H2N N + N H2N N N L-биолиганд HO O OH CH2 CH2 - NH2 n NH2 n CH2 CH2 NH2 n OOH L X Рисунок 10. Схема модификации политриэтилендиамина по атомам азота На основе триэтилендиамина «Полиоксидоний». получают 25 лекарственный препарат Поливиниловый спирт H3C CH3 CH2 CH H 2O n O O C CH3 CH2 H3C n CH - CH 3COOH OH поливиниловый спирт поливинилацетат CH3 Рисунок 11. Схема синтеза поливинилового спирта Поливиниловый спирт (ПВС) – неионогенный биоинертный полимер. ПВС получают алкоголизом поливинилацетата (ПВС невозможно синтезировать непосредственно из мономера). Неполный гидролиз приводит к сохранению остаточных ацетатных групп, от их количества зависит гидрофильно-гидрофобный баланс макромолекул. Применение поливинилового спирта в медицине: в качестве заменителя плазмы крови, поверхностно-активного вещества, для получения наночастиц, компонент препарата «Йодинол», при нехирургическом лечении онкологических заболеваний (в качестве эмболизирующего агента), в растворах для глазных капель и контактных линз в качестве лубриканта, для иммобилизации клеток и ферментов в микробиологии, для получения медицинских адгезивов и др. Полиакриловая кислота Полиакриловую кислоту (ПАК) получают радикальной полимеризацией акриловой кислоты в водном растворе или в среде органических растворителей. Как сама кислота, так и ее натриевые и калиевые соли, растворимы в воде. Соли поливалентных металлов (Ca2+, Mg2+, Al3+) нерастворимы в воде. При введении 1-3 % ионов кальция происходит сшивка и образование геля. Эфиры алифатических спиртов акриловой и метакриловой кислот в воде не растворимы. CH3 H3C H2C CH CH2 HC m C O C HO O HO акриловая кислота полиакриловая кислота Рисунок 12. Схема синтеза полиакриловой кислоты 26 CH3 CH3 H2C C H3C C CH2 C O HO m CH3 C O HO метакриловая кислота полиметакриловая кислота Рисунок 13. Схема синтеза полиметакриловой кислоты Полиакриловая кислота – носитель физиологически активных веществ, ферментов. Сшитые полимеры и сополимеры акриловой кислоты – ионообменные смолы (катионообменники, используются для биосепарации). Производные акриловой кислоты используются в качестве связующих, например, при создании пломбировочных материалов в медицине. Таблица 2. Производные акриловой кислоты H2C -OH-группа ПАК может быть заменена на: Me1+, Me2+ -NH2, -O-R, и др. CH C O HO H3C CH m CH3 CH2 C H3C H2N O CH2 CH m CH3 C O NH H3C C CH3 H H3C HO CH m CH3 CH2 CH2 C O CH2 O H3C CH2 CH m CH3 C O O CH Поли-N-изопропилакриламид – термочувствительный полимер (Тнктр ~ 34 ºС), образует гели. Может быть привит или адсорбирован на твердые поверхности, которые приобретают способность изменять смачиваемость и адсорбционную активность в ответ на небольшие изменения внешних условий. Полигидроксиэтилакрилат используют в качестве носителя биологически активных веществ, для получения искусственных хрусталиков. Полиглицидилакрилат способен химически связываться с NH2группами биологически активных веществ. Используют для иммобилизации ферментов и биолигандов. R O H2C Полиакриламид (ПАА) – неионогенный биоинертный полимер, полиэлектролит, получают радикальной полимеризацией. Широко применяется в качестве гелеобразователя, пленкообразователя, флокулянта и коагулянта. Используется в биосепарации и в качестве компонента хрусталиков глаза. O CH2 HC CH2 O + R NH2 R O CH2 HC OH 27 CH2 NH R В особую группу выделим полимеры, которые могут выводиться из организма путем биоразложения без образования побочных токсичных промежуточных веществ. Полипептиды O O NH NH H3C CH n CH3 HC H3C CH2 R n 4 NH2 CH3 H3C NH CH CH2 CH3 C 4 O n CH3 полипептид α-полилизин ε-полилизин Пептиды – это цепочечные молекулы, содержащие от двух до ста остатков аминокислот, соединенных между собой амидными (пептидными) связями. Пептиды, в которых меньше десяти аминокислотных остатков, часто называют олигопептидами, пептиды, построенные из большего числа аминокислотных звеньев – называют полипептидами (см. раздел «синтетические полипептиды»). Полифосфазены Полифосфазены – полимеры, содержащие фосфор-азотную связь. Существует множество видов олиго- и полифосфазенов, получаемых на основе циклических хлорфосфазенов, производных полигексахлорциклофосфазена (ПГХФ). Эти соединения находят широкое применение в самых разных областях – от материалов медико-биологического назначения и систем доставки лекарств, до материалов для авиационно-космической отрасли. Исходным мономером для синтеза полифосфазенов является гексахлорфосфазен, который полимеризуется с раскрытием цикла. Образующийся полимер является эластомером и обладает хорошими физическими характеристиками, однако крайне неустойчив на влажном воздухе. Для получения годных к эксплуатации материалов требуется модификация (замена хлора на функциональные группы). 28 Cl Cl Cl P P N Cl Cl N kt N H2P Cl P Cl N Cl Cl P N Cl P n P Cl замена хлора Cl H2O R1 H2P P разрушение NH2 N R2 PH2 N n R1, R2 = NH2 NH H2N CH2 n NH H2N C CH2 F O HO C F HO O OH O F C F F CH3 Рисунок 14. Схема синтеза и модификации полифосфазенов В результате таких замен получают серию полимерных материалов с комплексом ценных свойств. Если это алкильные или фторалкильные группы, то это гидрофобные твердые и волокнообразующие полимеры, или эластомеры с антипиренными свойствами. При модификации аминами или аминокислотами получают водорастворимые нетоксичные биоразложимые полимеры, которые являются перспективными носителями биологически активных и, в частности, лекарственных соединений. Биоразлагаемые сложные полиэфиры Наиболее распространенные биоразлагаемые полиэфиры, используемые в биомедицинских целях – это полилактид, полигликолид, сополимеры на основе лактида, гликолида, ε-капролактона, а также полигидроксиалканоаты, прежде всего полигидроксибутират. Биоразлагаемые сложные полиэфиры получают химическими (поликонденсация, полимеризация циклов) и микробиологическими (путем синтеза полимеров или мономеров с помощью микроорганизмов) методами. 29 Наряду с гомополимерами, отдельный интерес представляют статистические и блочные сополимеры. Регулирование молекулярной и надмолекулярной структуры, а также архитектуры биоразлагаемых полимеров, позволяет управлять их физико-химическими свойствами и профилем высвобождения активного вещества, что имеет важное значение для создания фармацевтических систем пролонгированного действия. Наиболее распространенным методом синтеза полилактида и полигликолида является полимеризация с раскрытием цикла. Каталитическую активность в данном процессе проявляют самые разнообразные органические и неорганические соединения: металлы (Zn), оксиды металлов (MgO, CdO), соли металлов (Sn(Oct)2, лактат цинка), кислоты Льюиса (AlCl3), протонные кислоты (трифторметансульфокислота, TfOH) и др. Октаноат олова (2-этилгексаноат олова(II)) является одним из наиболее широко применяемых катализаторов, так как проявляет высокую каталитическую активность, растворяется в расплавленном мономере и большинстве органических растворителей, стабилен при хранении. Благодаря биосовместимости, а также возможности регулирования физико-механических свойств и сроков биодеградации, полимеры и сополимеры лактида с гликолидом широко используются для изготовления шовных материалов для хирургии, крепежных изделий для травматологии и ортопедии, матриксов для регенеративной медицины, систем направленной доставки и пролонгированного высвобождения лекарств. Полилактид O CH3 H3C O O H3C O CH3 n CH3 O O лактид полилактид Полилактид – биосовместимый биоразлагаемый алифатический полиэфир, синтезируемый полимеризацией с раскрытием цикла циклического диэфира молочной кислоты (лактида). Основным продуктом биодеструкции полилактида является молочная кислота – естественный продукт обмена веществ живых организмов. Конечными продуктами деструкции молочной кислоты являются углекислый газ и вода. 30 Полигликолид O O H3C O CH2 O n CH3 O O гликолид полигликолид Полигликолид – простейший алифатический сложный полиэфир с высокой степенью кристалличности. Основным продуктом биодеструкции полигликолида является гликолевая (гидроксиуксусная) кислота, являющаяся естественным продуктом обмена веществ живых организмов. Полигидроксибутират H3C CH3 CH2 O HC C n CH3 O Полигидроксибутират (ПГБ) – биоразлагаемый термопластичный полимер бактериального происхождения, относящийся к классу полигидроксиалканоатов. При росте некоторых микроорганизмов на средах, содержащих питательные углеродные вещества, и имеющих дефицит азота или фосфора, микробные клетки начинают синтезировать и накапливать полигидроксиалканоаты (ПГA), которые являются резервом энергии и углерода. Эту способность бактерий используют для промышленного получения полигидроксиалканоатов. Полигидроксибутират по физикохимическим характеристикам схож с полилактидами и полилактонами. Список рекомендованной литературы к разделу: [1], [2], [6], [7], [14]. 31 ПОЛУЧЕНИЕ ТРЕХМЕРНЫХ ПОЛИМЕРОВ (ГИДРОГЕЛЕЙ) Гидрогели представляют собой набухшие в воде гидрофильные полимеры, связанные в трехмерную пространственную сетку за счет ковалентных или нековалентных взаимодействий. Такие сетки находятся в равновесии с водным окружением, при этом наблюдается баланс упругих напряжений поперечных сшивок и осмотического давления раствора. Вследствие способности поглощать и удерживать значительные объемы жидкости, гидрогели нашли практическое применение в целом ряде областей, например, в качестве материалов для контактных линз, для разделения белков, матриксов для выращивания клеток и тканей, для систем с контролируемым выделением лекарственных препаратов. На основе гидрогелей получают синтетические мембраны и сорбенты с высокоизбирательной пропускающей способностью, ионообменные материалы, носители физиологически активных и лекарственных веществ. Ковалентные узлы полимерных сеток Радикальная полимеризация Химически сшитые гидрогели могут быть получены радикальной сополимеризацией монофункциональных виниловых мономеров и бифункциональных сшивающих агентов. Данным методом получают гидрогели на основе полиакриловой кислоты и ее эфиров, таких как диэтиламиноэтилакрилат и гидроксиэтилакрилат, акриламида, Nвинилпирролидона и других винильных мономеров. В качестве сшивателей используют бифункциональные соединения, например, N,N-метилен-бисакриламид, этиленгликольдиакрилат, дивинилбензол (см. табл. 3). Существенным достоинством данного метода является то, что целый ряд характеристик гидрогелей, в том числе и их набухаемость, может регулироваться варьированием природы и концентрации основного мономера и количества сшивающего агента в реакционной смеси. Использование в качестве мономера акриловой кислоты позволяет получать pH-чувствительные, а Nизопропилакриламида – термочувствительные гидрогели. Полимеризация в замороженных растворах, или в присутствии различных порогенов, позволяет получать макропористые системы. 32 Таблица 3. Мономеры и сшиватели для получения полимерных сеток мономеры H2C H2C H2C CH C O HO CH CH2 C O H2C H3C O C O CH2 O HO CH CH CH2 CH2 CH2 C N O H2N N HC CH2 O CH2 H3C акриловая кислота гидроксиэтилакрилат диэтиламиноэтилакрилат акриламид N-винилпирролидон сшиватели O CH H2C O C CH2 CH2 CH n O диакрилат олигоэтиленгликоля N,N-метилен-бис-акриламид H2C CH O CH2 C H2C CH CH CH2 CH п-дивинилбензол CH2 м-дивинилбензол Ионные реакции Из ионных реакций получила известность лишь реакция химической сшивки полистирола с использованием катализаторов Фриделя-Крафтса, с образованием так называемого «сверхсшитого полистирола». CH3 H3C CH3 H3C Cl + AlBr3 , T iCl4 R R R Cl CH3 H3C H3C CH2 R: Cl CH2 Cl Cl O CH2 CH2 Cl Рисунок 15. Схема получения «сверхсшитого» полистирола 33 CH3 Вследствие участия в реакции алкилирования практически всех фенильных ядер полистирола, образуется супермелкопористая сетка, обеспечивающая особые сорбционные свойства материала – способность «втягивать» как гидрофобные, так и гидрофильные низкомолекулярные соединения. Поликонденсация Эта реакция широко используется для сшивания водорастворимых полимеров и формирования гидрогелей, в особенности в случае полимеров природного происхождения. Реакцию проводят по функциональным группам (-OH, -COOH, -NH2 и др.) полимера и сшивателя. Синтетический путь Например, полиуретаны получают взаимодействием соединений, содержащих изоцианатные группы, с би- и полифункциональными гидроксилсодержащими мономерами и олигомерами: Рисунок 16. Схема получения полиуретанов Сшивка природных макромолекул Важным примером данного подхода является сшивка полиуглеводов, таких как целлюлоза и декстран. Наиболее распространенным реагентом для их сшивки является эпихлоргидрин, обе функциональные группы которого реакционноспособные. O R1 OH + H2C CH CH2 Cl R1 O CH2 HC CH2 O + R2 OH R1 O CH2 CH CH2 OH O R2 Рисунок 17. Схема реакции эпихлоргидрина с гидроксильными группами В гелях для хроматографии («Сефадексах») макромолекулы декстрана сшиты эпихлоргидрином. Сефадексы относительно мягки и легко сжимаются, а в водных растворах сильно набухают. Изменяя степень сшивки, можно регулировать средний размер пор, образуемых пространственной сеткой сшитого геля. 34 сефадекс «Сефароза» – это торговое название сшитой гранулированной агарозы, обычно этот материал применяется для хроматографического разделения биомолекул. В жестких макропористых гелях связанными между собой оказываются практически все гликозидные циклы. С целью получения нерастворимых материалов (гелей, волокон, пленок, сорбционных материалов, мембран) на основе хитозана, используют следующие сшивающие агенты: глутаровый альдегид, эпихлоргидрин, диглицидиловый эфир этиленгликоля и менее распространенные: N,N-метилен-бис-акриламид, гексаметилендиизоционат и мочевиноформальдегидную смолу. хитозан Рисунок 18. Схема сшивки хитозана глутаровым альдегидом 35 Для сшивки полимеров, имеющих цис-гликольные группировки в цепях, одним из эффективных агентов является глутаровый альдегид: CH3 H3C CH3 H3C OH O H C H HO CH2 + OH O O CH2 H2C H2C CH2 OH H3C CH3 H CH2 H C O O C O H3C CH3 Рисунок 19. Схема сшивки глутаровым альдегидом В качестве сшивателей также используют бораты и боратсодержащие полимеры, например, сополимеры боратсодержащего акриламида с Nвинилпирролидоном: H2C CH C H3C CH2 CH2 HC O CH n HN C R. HC m N O CH2 N OH HN CH3 O OH O B B OH OH схема сшивки: H3C OH H2B B + H HO + OH H3C - B H2B HO HO H3C O O H3C Рисунок 20. Схема сшивки боратсодержащими соединениями Фотохимические и радиационно-инициированные сшивки Эффективные методы сшивки основаны на применении излучений. Однако, одной из важнейших задач здесь является обеспечение избирательности и контроля процесса. Примером могут служить методы 36 фотохимической сшивки, основанные на реакции циклоприсоединения по 4центровому механизму с участием фрагментов коричной кислоты или стильбена. O H H C C OH C C H H стильбен коричная кислота Если ввести в макромолекулы остаток коричной кислоты или стильбена, то, под действием излучения, они межмолекулярно димеризуются, образуя узлы сетки. CH3 H3C OH OH O OH O CH3 H3C OH C OH O C CH CH + CH hν HC CH CH HC HC C OH OH O C O OH O OH OH CH3 H3C O O OH CH3 H3C H3C OH H3C H C H C + C H hν C CH HC H CH CH CH3 CH3 Рисунок 21. Образование трехмерных структур под действием излучения Радиационно-инициированные процессы сшивки, как правило, мало специфичны и сопровождаются процессами деструкции, однако, в некоторых случаях они оказываются наиболее практически пригодными. Например, это наблюдается в случае полиэтиленгликолей. Водные растворы этих полимеров легко желируются, превращаясь в гидрогели при облучении γ-излучением или рентгеновским излучением. 37 . CH2 H3C CH2 O CH2 O CH2 CH3 O γ CH H3C O CH2 O CH2 CH2 O HC CHH 3 3C CH2 O CH2 O CH2 O CH3 . CH2 H3C O CH2 O CH2 CH2 CH3 O CH H3C O CH2 O CH2 CH2 O CH CHH 3 3C O CH2 O CH2 CH2 CH3 O Рисунок 22. Сшивка полиэтиленгликоля под действием γ-излучения Биоспецифические взаимодействия Биологические молекулы способны образовывать соединения по принципу молекулярного «узнавания» без образования ковалентных связей. На основе полимеров с группами-биосшивателями можно получать гели, способные реагировать на биологические сигналы. Рисунок 23. Схема выделения инсулина из геля, сшитого конканавалином-А, под действием глюкозы (гель, демонстрирующий выделение АФС по механизму обратной связи) Например, инсулин, капсулированный в гидрогель, полученный с помощью полимера с гликозидными остатками в боковых группах и конканавалина-А (белок растительного происхождения, содержащий 4 сайта связывания глюкозы, выполняющий роль управляемого сшивателя), высвободится при появлении избытка глюкозы в крови, из-за разрыхления геля и его растворения. 38 ФИЗИЧЕСКИЕ УЗЛЫ ПОЛИМЕРНЫХ СЕТОК К физическим («обратимым») гидрогелям относят системы, в которых молекулы полимера в сетке удерживаются за счет межмолекулярного взаимодействия или нековалентных связей (ионной связи, водородной связи или гидрофобных взаимодействий). Все эти взаимодействия являются обратимыми. Разрушение структуры может произойти при изменении условий: ионной силы, рН, температуры и т.д. Преимуществом этого типа гидрогелевых систем является отсутствие необходимости использования сшивающих агентов при их получении. Гидрофобные взаимодействия Рассмотрим несколько конкретных примеров. Поливинилпиридин и его производные. Поливинилпиридин в воде не растворяется, но, если провести реакции кватернизации (ввести метильные, этильные или другие группы), можно управлять растворимостью полимера в воде и водно-органических средах. Такие полимеры при R= -CH3 и -C2H5 хорошо растворяются в воде, а при более гидрофобном R, например, -C8H17, полимеры в воде нерастворимы. Однако, при введении небольшой доли -C8H17 групп, полимеры не растворяются, но хорошо набухают в воде, при этом они растворимы в органических и водно-органических растворителях. Эти полимеры можно диализовать или проводить выпаривание органического растворителя, получая нерастворимую в воде сетку, но, при введении органического растворителя, гель перейдет в растворимое состояние. CH2 CH CH2 CH2 CH 3 HC H3C X - N + X - N + R2 R1 Другой пример: гели на основе сополимеров акриламида с Nалкилзамещенными акриламидами (-C18H37, -C16H33). В таких системах возможно явление «самозалечивания» за счет перестройки гидрофобных доменов, выполняющих роль узлов сетки. 39 H3C H3C CH m CH3 CH2 C H2N O NH O HN HC H3C C18H37 полиакриламид – водорастворимое звено CH m CH3 CH2 C C O H3C CH m CH3 CH2 водонерастворимое звено CH3 поли-N-изопропилакриламид – температурозависимый блок (растворим при t < 35 ºC) Контролируемой радикальной полимеризацией получают блоксополимеры стирола с акриловой кислотой. Диблок-сополимеры образуют организованные мицеллы, из триблочников получают гидрогели. H3C CH2 CH CH2 n HC C HO HC H3C CH3 m HO O C CH2 m CH2 HC n CH2 HC C O HO а CH3 m O б Рисунок 24. Диблок- (а) и триблок-сополимеры(б) стирола с акриловой кислотой Стимулчувствительные (smart) полимеры Некоторые полимеры при повышении температуры выше Tнктр (например, поли-N-изопропилакриламид, поли-N-винилкапролактам) или изменении pH (например, сополимеры акриловой кислоты и ее эфиров), образуют гель. Эти процессы обратимы и могут быть использованы для получения биомедицинских материалов с управляемыми растворимостью или набуханием. Ионные связи При введении в раствор полимера, содержащего карбоксильные группы (обычно в виде одновалентных солей поликислот), поливалентных ионов металлов (например, Ca2+), происходит сшивка. O O O Na O O O O Na + H3C O Na O O Na Na O CH3 H3C CH3 H3C Ca 2+ 2+ Ca Na Na O O O O Na O CH3 CH3 H3C Рисунок 25. Схема сшивки полимера, содержащего карбоксильные группы (в виде натриевых солей) ионами кальция 40 Примером полимера, который может быть желирован за счет ионных взаимодействий, является альгинат, способный к сшивке в присутствии ионов кальция. Однако, альгинатные гели могут быть дестабилизированы при экстракции ионов кальция хелатирующими агентами. Сшивка альгинатов возможна при комнатной температуре и физиологических значениях pH, поэтому альгинатные гели очень часто используются в качестве матрицы для инкапсуляции клеток и выделения различных белков. Полиэлектролитные комплексы Полиэлектролиты – это полимеры, макромолекулы которых содержат ионогенные функциональные группы, способные к электролитической диссоциации. Полиэлектролитные комплексы (ПЭК) формируются путем смешения противоположно заряженных полиэлектролитов (поликатионов и полианионов) за счет кулоновских взаимодействий. Данным способом можно получать гидрогели как из синтетических полиэлектролитов, так и из природных полимеров. В случае хитозана, такими сшивателями являются полифосфаты. В случае низкомолекулярных соединений, ионная реакция вытеснения сильной кислоты слабой невозможна (равновесие практически на 100 % сдвинуто влево): O O H3C - C + + Cl H3N H3C CH2 CH3 C H Cl + O OH + OH H3N CH2 CH3 Рисунок 26. Схема реакции ионного вытеснения однако, для полиэлектролитов картина может быть обратной, вследствие кооперативных эффектов полимерной цепи: H3C CH3 O HO Cl - + NH3 H3C HO O HO CH3 O HO O HO O O O HO O O + HCl - - Cl + NH3 + NH3 Cl H3C + NH3 CH3 H3N + + NH3 H3C Рисунок 27. Схема реакции ионного вытеснения для полиэлектролитов 41 CH3 При стехиометрических соотношениях ионогенных групп, это обычно приводит к образованию плотного осадка, но, в случае избытка одного вида ионогенных групп, можно получить набухший гидрогель, узлами которого служат короткие участки нерастворимого поликомплекса, соединенных фрагментами водорастворимых цепей свободного полиэлектролита. Кристаллизация Кристаллизация – процесс получения гидрогелей, формирующихся за счет образования кристаллических доменов. Кристаллизация полимера в растворе. При повышении температуры кристаллиты полимера плавятся, и гель превращается в раствор; при понижении температуры – начинается процесс кристаллизации фрагментов цепи, и происходит желирование раствора. Данным методом получают гели на основе ПВС, агарозы, желатины. Кристаллизация растворителя. При замораживании водного раствора полимера (например, ПВС) образуются мелкие кристаллы чистого льда, между которыми «выдавлены» жидкие «прослойки» таким образом сконцентрированного полимера. После оттаивания системы получается высокопористая эластичная губка. Общее название таких систем – криогели. Криогели оказались хорошими матрицами для иммобилизации ферментов и клеток. концентрированный раствор полимера лед закристаллизованный полимер Рисунок 28. Схема получения криогеля 42 ХАРАКТЕРИСТИКИ СЕТОК Термодинамический метод Понятие молекулярной массы исчезает для трехмерных сшитых полимеров, в том числе для гидрогелей, ввиду их трехмерности. Химически сшитые макромолекулы не могут в растворах разойтись полностью, но фрагменты цепей, имеющие сродство к растворителю, будут сольватированы, и будут стремиться разойтись, при этом будут удерживаться силами упругости связанных в сетку макромолекул, что уравновешивает стремление растворителя к набуханию полимера. Важные характеристики сеток: проницаемость (пористость), механическая прочность (жесткость, эластичность). Рисунок 29. Трехмерная полимерная сетка с точечными узлами сетки Важнейшей характеристикой геля является Mc – среднее расстояние между узлами сетки или эффективная величина поры геля. Эта величина может быть определена термодинамически, по набуханию гелей, с помощью уравнения Флори-Ренера: −∆𝑮общ = −∆𝑮наб + ∆𝑮эласт Энергия взаимодействия полимера и растворителя равна разности между энергией набухания и эластичной энергии сопротивления гелей. В предельном случае достигается равновесие: −∆𝑮наб + ∆𝑮эласт = 𝟎 Изменение парциальной энтропии и термодинамического потенциала растворителя при набухании сшитого полимера, в зависимости от густоты сшивок, выражается как: ∆𝑺𝟏 = 𝑹[𝐥𝐧(𝟏 − 𝝋𝟐 ) + 𝝋𝟐 + d2V1 𝑴c ∆ϻ1 = 𝑹𝑻[𝐥𝐧(𝟏 − 𝝋𝟐 ) + 𝝋𝟐 + 𝝌1𝝋𝟐 𝟐 + 43 𝟏 ∗ (𝝋𝟐 𝟑 − d2V1 Mc 𝟐𝝋𝟐 ʄ 𝟏 )] ∗ (𝝋𝟐 𝟑 − (1) 𝟐𝝋𝟐 ʄ )] (2) ∆S1 ‒ изменение энтропии растворителя; 𝛗𝟐 ‒ объемная доля полимера в растворе; d2 ‒ плотность полимера; 𝛘𝟏 ‒ энергия взаимодействия полимера с растворителем (константа Хаггинса); ʄ ‒ функциональность сетки (количество разветвлений из одного узла); 𝐕1 ‒ парциальный мольный объем растворителя. Все эти параметры определяются экспериментально. Измерив Δμ1 и ΔS, можно определить Mc. При равновесном набухании Δμ1 = 0, следовательно, уравнение 2 приравнивается к 0, константа Хаггинса определяется из таблиц. ∆𝑮общ = 𝟎 𝐥𝐧(𝟏 − 𝝋𝟐 ) + 𝝋𝟐 + 𝝌1𝝋𝟐 𝟐 + d2V1 Mc 𝟏 ∗ (𝝋𝟐 𝟑 − 𝟐𝝋𝟐 ʄ )=𝟎 (3) ΔP равновесная степень набухания ΔP – степень набухания время Рисунок 30. Кинетика набухания сшитого полимера Измерения можно проводить и не достигая равновесия, в том числе для систем, где константа Хаггинса неизвестна. В этом случае можно измерить μ1 при разных степенях набухания, измерив упругость пара растворителя над гелем: 𝒑 ∆ϻ1 = 𝑹 𝑻 𝐥𝐧( 𝟏𝟎 ) (4) 𝒑𝟏 подставив выражение в уравнение (2), после преобразований получим: 𝟏 𝟐𝝋 𝒑 𝐥𝐧( 𝟏𝟎 )−𝐥𝐧(𝟏−𝝋𝟐 )−𝝋𝟐 𝒑𝟏 𝝋𝟐 𝟐 = 𝝌1 + 44 d2V1(𝝋𝟐 𝟑 − ʄ 𝟐 ) 𝑴c·𝝋𝟐 𝟐 (5) это уравнение типа y = a + bx : tg α = 1/ Mc a = χ1 Рисунок 31. Графическая обработка данных по уравнению (5) Термодинамический метод надежный, но медленный и трудоемкий. При увеличении частоты сшивки растет жесткость геля. Можно связать энергию упругости и частоту сшивки. Механические свойства гелей Механические свойства гелей определяются уравнением Муни-Ривлина (выведено для каучуков): 𝝈 = (𝒄𝟏 − 𝒄𝟐 𝝀−𝟏 )(𝝀 − 𝝀−𝟐 ) 𝓵 𝝀= 𝓵𝟎 учитывая, что 𝑐1 = 𝑑2 𝑅𝑇 𝑀𝑐 ; 𝑐2 = const для набухших гелей 𝑐2 ~ 0 получим уравнение: 𝝈= d2 RT (𝝀 − 𝝀−𝟐 ) Mc Уравнение Муни-Ривлина – связь напряжения (σ), которое прикладывают к гелю, с относительным удлинением образца (𝜆 = ℓ ℓ0 ). Опыт показывает, что в случае гидрогелей, полученных радикальной сополимеризацией моно- и бифункциональных виниловых мономеров, удовлетворительными физико-механическими свойствами обладают гели, полученные с 5 % и выше содержанием сшивателя, а гели, полученные при меньшем количестве сшивателя, плохо держат форму и слипаются. 45 Транспортные свойства гелей Оценка с помощью эксклюзионной (гель-проникающей) жидкостной хроматографии. В данном методе, чем больше размер частиц (чем крупнее макромолекулы), тем в меньшее количество пор геля они смогут зайти, и, следовательно, быстрее пройдут весь объем колонки и раньше выйдут из нее, где будут детектированы (УФ-спектроскопией, рефрактометрически, светорассеянием) качественно и количественно. раствор полимера колонка с наполнителем разделение (фильтрация) макромолекул детекция макромолекул Рисунок 32. Принципиальная схема эксклюзионной жидкостной хроматографии 46 Таким образом, на выходе из колонки получим такую картину: Vп – полный объем колонки; Vм – объем, доступный для частиц (объем пор + объем межпорового пространства); V0 – объем пространства; межчастичного V1 – объем элюирования растворенного вещества. Рисунок 33. Жидкостная хроматограмма по механизму эксклюзионной сепарации Первыми выходят самые крупные частицы – они не заходят в поры (пик 1), затем – частицы промежуточных размеров (пик 2), и самым последним выходит растворитель, которому доступны все поры (пик 3). Таким образом, можно определить размер и объем пор геля и/или размер частиц. положение пика: V1 = V0 + Ksec·Vм при полностью недоступном поровом пространстве: K=0, V1 = V0 при полностью доступном объеме пор: K=1, V1 = V0 + Vм Для конкретного геля с определенной пористостью взаимосвязь объема элюирования (т.е. доступностью объема пор) от молекулярной массы растворенного вещества имеет вид: Рисунок 34. Связь объемов элюирования с молекулярными массами элюатов при эксклюзионной жидкостной хроматографии 47 При наличии калибровки (см. ниже в разделе по жидкостной хроматографии), с помощью данной колонки методом эксклюзионной хроматографии можно определить молекулярную массу в интервале M1<Mx<M2. Но, при использовании сорбата с известной молекулярной массой, этим методом можно определять доступные для него объемы пор различных сорбентов, т.е. решать обратную задачу. Если пропускать через колонку, набитую однородными гидрогелевыми частицами с разной густотой сшивки (с разными Mc), смесь олигомерных сорбатов с M ~ 102-104 Da, мы получим следующую картину: Рисунок 35. Влияние густоты сшивки геля на параметры жидкостной эксклюзионной хроматографии (см. текст) С ростом густоты сшивки от 1 до 5 % сшивателя, доступный объем пор и предельные молекулярные массы сорбатов резко падают. Так что гидрогели, полученные с 5 % и более сшивателя, могут выполнять роль «депо» для низкомолекулярных веществ, но практически не обладают свойствами объемно-пористых сорбентов, а гели с меньшей густотой сшивки не обладают практически необходимой жесткостью. Выход из этого противоречия может быть найден путем создания жестких объемно-пористых материалов. Такие сорбенты обеспечивают высокие транспортные характеристики для элюентов и сорбатов, которые при этом будут мало зависеть от их природы, ионной силы, pH элюента и других факторов. Объемно-пористые структуры с жесткими «толстыми» стенками (макропористые гели) возникают при фазовом расслоении в растворе полимеров, либо при синтезе нерастворимого в среде или сетчатого полимера. Список рекомендованной литературы к разделу: [4], [5]. 48 МАКРОПОРИСТЫЕ ГЕЛИ Физико-химический подход к получению макропористых систем на основе фазового расслоения (термодинамический подход) Схематически зависимость ΔG смешения в бинарной системе полимеррастворитель представлена на рисунке для трех случаев: отсутствие взаимной растворимости; полная взаимная растворимость (совместимость); ограниченное смешение (фазовое расслоение). В последнем случае, система среднего состава 𝑥2 0 распадается на две равновесные фазы: 𝑥21 𝐼 (обогащенную растворителем) и 𝑥21 𝐼𝐼 (обогащенную полимером). Для понимания механизма фазового распада и морфологии выделяющейся полимерной фазы, отметим точки перегиба на кривой 3: 𝑥22 𝐼 и 𝑥22 𝐼𝐼 . Геометрическое место точек минимума величин 𝑥21 𝐼 и 𝑥21 𝐼𝐼 в зависимости от температуры, называется бинодаль, а соответствующая кривая для точек 𝑥22 𝐼 и 𝑥22 𝐼𝐼 – спинодаль. Бинодальный распад происходит в квазиравновесных условиях (например, при медленном понижении температуры в соответствии с рисунком). В растворе возникают критические флуктуации – зародыши новой фазы, близкие к составу равновесных фаз, и растут области, обогащенные растворителем (из-за разности коэффициентов диффузии). Спинодальный распад происходит в неравновесных условиях, например, при быстром понижении температуры с пересечением бинодали (в соответствии с рисунком). В системе возникают и растут периодические неоднородности по составу, размеры которых зависят от температуры и свойств полимера. Бинодальный распад обычно наблюдается в растворах гибкоцепных полимеров. Квазибинодальный механизм формирования морфологии полимерной фазы реализуется при химическом росте новой фазы путем полимеризации. Спинодальный механизм удается реализовать для жесткоцепных полимеров. В этом случае удается получать высокопористые системы (гели) с большим объемом пор и более «гладкими» стенками пор, чем при реализации бинодального распада. 49 Рисунок 36. Термодинамические характеристики системы «полимер-растворитель» при фазовом распаде «жидкость-жидкость» (см. текст) 1 – нет смешения; 2 – полное смешение; 3 – ограниченное смешение. X2 = 0 – чистый растворитель; X2 = 1 – полимер. для ограниченного смешения: 1 – бинодаль (геометрическое место точек минимума); 2 – спинодаль 50 Схемы фазового распада: Бинодальный фазовый распад (образование и рост зародышей) Спинодальный фазовый распад Рисунок 37. Схемы фазового распада в системах «полимер-растворитель» 51 Рассмотрим несколько примеров получения макропористых систем. Макропористые материалы на основе кремнезема Силикагели Кремнеземы – это неорганические полимеры брутто-формулы SiO2. На их основе получают два вида макропористых материалов. Это силикагели и макропористые стекла. Силикагели получают в несколько этапов. На первом этапе получают силиказоль – коллоидный раствор наноразмерных частиц SiO2 в воде – путем гидролиза прекурсоров или нейтрализации Na2SiO3: H3Si Si (OC 2H5)4 H3Si SiH3 или SiCl 4 Na 2SiO3 H2O (H2SiO3)x HCl - H2 O SiO2 Рисунок 38. Схема синтеза SiO2 Продукт выделяется в виде зародышей новой фазы – сферических коллоидных частиц кремнезема с поверхностными -SiOH-группами. Затем, после концентрирования, происходит агломерация частиц с получением трехмерного пористого каркаса, построенного из сферических частиц силиказоля, который укрепляют путем спекания, благодаря поверхностным силанольным группам: H3Si H3Si H3Si SiH3 Si OH + HO Si SiH3 SiH3 SiH3 H3Si H3Si Si O Si SiH3 (химическое сращивание) SiH3 H3Si Наконец, гидротермической обработкой увеличивают размеры пор и улучшают «гладкость» их внутренних поверхностей. Процесс происходит по квазибинодальному механизму. Диаметры пор силикагелей, в зависимости от условий, составляют 102-103 Å (10-100 нм). Макропористые стекла Эти материалы получают, исходя из так называемого «боратного» стекла с брутто-формулой Na2O·B2O3·SiO2. На самом деле, это смесь двух неорганических полимеров с брутто-формулами SiO2 и Na2O·B2O3. В расплаве этого стекла, при температурах 450-750 °С, происходит расслоение по 52 спинодальному механизму на две указанные фазы, образующие взаимопроникающую жидкую систему. Затем систему быстро охлаждают и тем самым «замораживают» ее структуру. Наконец, стекло обрабатывают HCl, и Na2O·B2O3 фаза уходит в раствор. Оставшийся кремнезем подвергают контролированному травлению щелочами. Размеры пор в макропористых стеклах разных марок лежат в диапазоне 102-104 Å (10-1000 нм) при очень узком распределении пор по диаметрам и общем объеме пор до 80 %. Кремнеземные сорбенты обладают прекрасными физико-механическими и транспортными характеристиками, но их серьезными недостатками является высокая неспецифическая сорбция и низкая химическая гидролитическая активность, в особенности к щелочным средам: Рисунок 39. Реакция SiO2 с NaOH Поэтому, для практического использования в жидкостной хроматографии, их поверхностно химически модифицируют. Для этой цели, наиболее распространенным способом является модификация с использованием реакции различных кремнийорганических соединений с поверхностными силанольными группами сорбентов. H3Si H3Si H3Si Si OH + H2Si H3Si Si OH X RO Si O Y X Si H2Si Si RO H3Si Y H3Si Si O H3Si H3Si Рисунок 40. Химическая модификация кремнеземных сорбентов Разработаны методы модификации кремнеземных сорбентов путем нанесения нано-толщинным слоем различных полимеров (политетрафторэтилена, полистирола, полиакрилатов). Макропористые органические полимерные гели Для получения таких гелей используют радикальную (со)полимеризацию моно- и полифункциональных виниловых мономеров при высоких содержаниях сшивателя и порообразователей, в роли которых выступают неполимеризующиеся жидкости. С помощью порообразователя можно регулировать объем и размер пор в конечном геле. Возникновение и рост 53 полимерной фазы в такой системе, в силу особенностей радикальной полимеризации, происходит по зародышевому механизму. На начальной стадии реакции возникают микрогели, которые начинают разрастаться, вследствие малой скорости реакции бимолекулярного обрыва внутри этих частиц. Тем самым, процесс возникновения и «химического роста» полимерной фазы напоминает процесс фазового распада по бинодальному механизму. Это приводит к сходству морфологий возникающей пористой структуры. Каркас геля в данном случае формируется из сросшихся густо сшитых жестких сферических элементов (микрогелей). Таким путем получают жесткие полистирольные гели и ионообменники на их основе, жесткие гели на основе полиакриловой кислоты и др. Проиллюстрируем роль природы сшивателя и порообразователя как регуляторов структуры макропористого геля на примере получения такого материала в виде гранул, на основе полистирола и дивинилбензола, методом суспензионной полимеризации в водных дисперсиях. Оценим пригодность изомеров дивинилбензола (ДВБ) для сшивки полимерных цепей. 1) для орто-ДВБ, при раскрытии первой двойной связи происходит атака на вторую двойную связь и циклизация. Поэтому, орто-ДВБ не годится. 2) для мета-ДВБ, двойные связи ведут себя как квазинезависимые, поэтому, при сополимеризации со стиролом, образуется однородная трехмерная сетка. 3) для получения неоднородных макропористых систем, необходимо брать пара-ДВБ, поскольку он обладает повышенной реакционной способностью, активно полимеризуется уже на ранних стадиях реакции и образует густо сшитые области. Структура сетки обычно регулируется составом смеси мета- и пара-ДВБ. Порообразователи В зависимости от сродства к мономерам, порообразователь будет стремиться либо внутрь капли, либо на поверхность. В системе «стирол-ДВБ» используются следующие порообразователи: 1) Алканы – будут стремиться уйти внутрь капли, поэтому образуется система с мелкими порами на поверхности («корка») и крупными внутри. Гель может использоваться как «контейнер» для иммобилизации. 2) Ароматические углеводороды – распределяются равномерно и образуют поры одинакового размера во всей капле. 54 3) Высшие спирты – обладают повышенной активностью и концентрируются в поверхностном слое, вытесняя оттуда мономер и сшиватель. Получается система с крупными порами на поверхности и мелкими внутри. Спинодальный механизм образования полимерных макропористых гелей реализуется в случае жесткоцепных высокомолекулярных полиуглеводов (целлюлозы, агарозы) при резком изменении температуры раствора ниже температуры начала фазового распада (бинодали). Образующаяся при этом спинодальная морфология выпавшего полимера затем фиксируется химически глутаровым альдегидом или эпихлоргидрином. Таким образом, полимерные гели можно разделить на две категории: мягкие гели – однородные, мелкопористые с точечными узлами сетки макромолекул, и неоднородные (макропористые), в которых как узлами сетки, так и связывающими их «отрезками» между сшивками, являются надмолекулярные структуры. Схематически, «жесткая» морфология этих систем может быть проиллюстрирована на рисунке ниже. а) мягкие гели б) жесткие гели Рисунок 41. Схематические изображения: а) однородных (мягких) и б) макропористых (жестких) гелей [8] Однородные («мягкие») гели могут использоваться как «депо» для различных АФС, для иммобилизации ферментов и клеток, как имплантаты, в частности, с высокими оптическими свойствами (глазные линзы), в качестве биосепарационных систем в электрофоретических методах разделения, где не требуется приложение внешнего давления. Морфология «жестких» (макропористых) полимерных гелей, полученных либо по механизму квазибинодального распада (рисунок а), либо 55 спинодального распада (рисунок б), продемонстрирована на электронномикроскопических снимках [8]. а 10 мкм 500 нм 5155 5555 500 б 500 нм Рисунок 42. а) сканирующая электронная микрофотография сорбента Sephacryl S500; б) сканирующая электронная микрофотография 2% агарозного геля На рисунках видно обсужденное выше преобладание глобулярных элементов в структуре сорбента на рисунке a и фибриллярных – на рисунке b. Очевидно, что такие системы должны обладать высокими транспортными характеристиками, в частности, при их использовании в качестве сорбентов для жидкостной хроматографии, в особенности в тех случаях, когда для обеспечения потока элюента сквозь пористую матрицу необходимо приложение внешнего давления. Список рекомендованной литературы к разделу: [4], [5], [9], [10], [11]. 56 ЭЛЕКТРОФОРЕЗ Электрофорез на протяжении последних десятилетий традиционно занимает важное место при исследовании белков и нуклеиновых кислот (НК). Метод электрофореза позволяет разделять макромолекулы по размерам, пространственной конфигурации, вторичной структуре и заряду, что, в сочетании с простотой и удобством в использовании, делает его незаменимым не только для качественного, но и для количественного анализа макромолекул. Впервые данный подход был применен шведским химиком Арне Тиселиусом (Arne Wilhelm Kaurin Tiselius) в 1930-х годах для разделения белков сыворотки крови, а в 1948-м году эта работа была отмечена Нобелевской премией. С тех пор, электрофорез успешно применяется для разделения почти всех известных органических и неорганических соединений. В основе метода электрофореза лежат следующие основные принципы. В составе всех нуклеиновых кислот и белковых молекул присутствуют химические группы, обладающие в водном растворе электрическим зарядом. Величина общего заряда такой молекулы определятся количеством заряженных групп, их природой, а также кислотностью (pH) раствора. Так, в нуклеиновых кислотах, в широком диапазоне pH, на каждую фосфатную группу приходится заряд «-1». В белковых молекулах одновременно присутствуют как положительно, так и отрицательно заряженные группы. Под действием внешнего электрического поля, заряженные молекулы могут перемещаться к катоду или аноду, в зависимости от их суммарного заряда. Такое явление и носит название электрофореза. Скорость движения молекулы в поле единичной напряженности называется электрофоретической подвижностью (Rf) и является важной характеристикой вещества. Именно различия в электрофоретической подвижности различных биологических молекул очень часто используются для разделения их смесей в аналитических или препаративных целях. На практике применяются три основных типа электрофореза: электрофорез с подвижной границей, зональный электрофорез и стационарный (вытесняющий) электрофорез. В методе подвижной границы, исходная проба, содержащая исследуемую смесь макромолекул, наслаивается на буферный раствор, при движении в котором под действием электрического поля можно наблюдать набор перемещающихся границ. Основная сложность при проведении электрофореза без поддерживающей среды заключается в том, что нет возможности зафиксировать картину получаемого распределения, а 57 наличие диффузии в растворе может привести к размыванию фронтов. Для уменьшения влияния диффузии, такой тип электрофореза часто проводится в капиллярах. Наиболее распространенным видом зонального электрофореза в настоящее время является электрофорез в поддерживающей среде. При анализе биологических макромолекул, в качестве такой среды чаще всего используются различные гели, наиболее распространенными среди которых являются агарозные и полиакриламидные гели. Рисунок 43. Прибор для постановки SDS-электрофореза в полиакриламидном геле Электрофорез в гелях. Белковый электрофорез Белковый электрофорез. В настоящее время электрофорез в полиакриламидном геле (ПААГ) является наиболее распространенным способом электрофоретического разделения белков и нуклеиновых кислот. Популярность метода, во многом, обусловлена его высокой разрешающей способностью и экспериментальной гибкостью. Параметрами разделения можно управлять, варьируя пористость геля, добиваясь тем самым оптимальных условий при разделении каждого конкретного образца. Путем изменения состава геля и буферных систем, можно осуществлять разделение макромолекул по массе, по заряду, или по соотношению между их массой и зарядом. Ключевым аспектом при использовании метода электрофореза в полиакриламидном геле является понимание самого процесса образования геля. Формирование однородного монолитного геля (ПААГ) осуществляют непосредственно в электрофоретической кювете, путем радикальной (со)полимеризации акриламида со сшивателем – N,N-метилен-бис-акриламидом (МБА). Реакция полимеризации проходит по свободнорадикальному механизму, инициируется персульфатом аммония. 58 Рисунок 44. Реакция сополимеризации акриламида с бис-акриламидом Скорость образования свободных радикалов из персульфата аммония можно увеличить путем добавления в раствор восстановителя (например, N,N,N′,N′-тетраметилэтилендиамина), который снижает энергию активации инициирования полимеризации. Густоту сетки и ее градиент в геле регулируют путем изменения концентрации мономера и сшивателя в исходном растворе. Электрофорез в полиакриламидном геле в присутствии додецилсульфата натрия (SDS) является самым распространенным на сегодняшний день методом разделения белков в денатурирующих гелях. Метод основан на том, что SDS связывается с белками, вызывает диссоциацию субъединичных белков и денатурирует сами молекулы (разрушает их вторичную структуру). При этом, для большинства белков, одна молекула SDS связана с двумя аминокислотными остатками, а соотношение заряда к молекулярной массе становится практически постоянным. Конформация молекулы комплекса «белок-SDS» может быть представлена в виде эллипсоида, большая ось которого пропорциональна длине полипептидной цепи. Электрофоретическая подвижность такого ассоциата (Rf) непосредственно определяется молекулярной массой белка и выражается формулой: 𝐑 𝐟 = 𝐀 − 𝐁 𝒍𝒈 𝐌 (где A и B – константы) Тем самым, используя белки-маркеры с известными молекулярными массами (см. рис. 45), можно быстро определить молекулярную массу исследуемого белка. Типичные электрофореграммы белков приведены на рисунке 45. 59 Рисунок 45. Маркерные белки при разделении в 15 % ПААГ в присутствии SDS (слева); маркерные пробы, нанесенные на одну дорожку с исследуемым образцом, и тот же маркер отдельно (в центре); зависимость смещения пробы в геле от логарифма ее молекулярной массы (справа); Полосы исследуемых белков помечены стрелками [9] Примером стационарного электрофореза может служить изоэлектрическое фокусирование, основанное на том, что в составе таких молекул как белки присутствуют группы, несущие как положительный, так и отрицательный заряд. Общий заряд макромолекулы в этом случае будет зависеть от pH среды, и возможна ситуация, когда количество положительных зарядов в молекуле сравняется с количеством отрицательных зарядов в ней. Говорят, что значение pH, при котором достигается такое зарядовое равновесие, соответствует изоэлектрической точке (pI) молекулы. При этом, суммарный заряд такой молекулы окажется нулевым, и она не будет двигаться во внешнем электрическом поле. На практике это позволяет разделять молекулы в смеси по величине их изоэлектрических точек. Для этого, в среде создается градиент pH, вдоль которого прикладывается электрическое поле. Когда молекула, двигаясь в поле, попадает в зону с pH, соответствующим ее изоэлектрической точке, ее движение прекращается, и она остается на одном месте до окончания электрофореза. Таким образом, через некоторое время после начала разделения зон, устанавливается равновесие, при котором ширина зон в дальнейшем уже не изменяется. Разделение в градиентах пористости и pH. Еще одним способом эффективного сужения полос при электрофорезе является проведение разделения в геле с монотонно уменьшающимся размером пор. Градиент пористости регулируется концентрациями используемых реагентов. Преимуществом такого подхода является не только возможность получения 60 достаточно узких полос, но и стационарный характер разделения. Иными словами, по истечении некоторого времени картина распределения белковых полос в геле перестает изменяться и остается постоянной, вплоть до окончания эксперимента. Такое поведение разделяемых молекул в геле с градиентом пористости обусловлено следующими обстоятельствами. Продвигаясь в геле под действием электрического поля, молекулы постепенно попадают в области с все меньшим размером пор. Постепенно, размер пор становится настолько мал, что дальнейшее движение молекулы оказывается невозможным, она останавливается и остается в таком положении, пока на нее действует электрическое поле. Таким образом, при движении пробы в геле, из нее будут постепенно отфильтровываться и «застревать» в геле сначала самые крупные молекулы, потом те, что поменьше, и так далее до самых маленьких молекул (при условии, что градиент пористости позволяет создать достаточно маленькие поры). Такой подход позволяет также получить достаточно узкие полосы, поскольку на молекулы, идущие впереди, действует сила сопротивления со стороны геля немного бόльшая, чем на молекулы, мигрирующие позади. Это означает, что, по аналогии с описанным выше механизмом, задний фронт пробы будет постоянно приближаться к переднему фронту, сужая тем самым белковую полосу. Количественную оценку результатов электрофореза проводят при помощи денситометрии геля или его фотографии. При связывании красителя Кумасси с белком, интенсивность окрашивания полосы в достаточно широких пределах линейно зависит от количества белка в полосе. Электрофорез в смешанных гелях. При разделении крупных частиц (например, нуклеопротеиновых комплексов), можно использовать смешанные гели, состоящие из агарозы (в концентрации около 0.5 %) и полиакриламида (в концентрации от 1.5 % до 2.5 %). При этом, агароза выполняет лишь функцию каркаса, который не нарушает эффект молекулярного сита, создаваемого сеткой полиакриламидного геля. Для образования такой структуры надо обеспечить условия, при которых агароза желируется раньше, чем формируется ПААГ. Капиллярный электрофорез представляет собой физический метод анализа, основанный на миграции внутри капилляра заряженных частиц определяемых веществ, растворенных в растворе электролита, под влиянием постоянного электрического поля. В капиллярном гель-электрофорезе разделение происходит внутри капилляра, заполненного гелем, действующим как молекулярное сито. Поскольку молекулы меньшего размера легче 61 проникают в структуру геля и мигрируют быстрее, чем большие, разделение молекул с близкими величинами отношения заряда к массе происходит в соответствии с их размерами. Таким образом, методом капиллярного гельэлектрофореза, по величинам молекулярных масс могут быть разделены различные биологические макромолекулы (например, белки и фрагменты ДНК), часто имеющие близкие величины отношения заряда к массе. Двумерный электрофорез Эффективность электрофоретических методов зависит от многих факторов, в том числе от суммарного заряда молекул, ситового эффекта используемого для электрофореза носителя, присутствия денатурирующих агентов и проч. Благодаря такой вариабельности, электрофорез обладает высокой разрешающей способностью. Однако, при исследовании сложной смеси, состоящей из многих белков, некоторые белковые зоны могут перекрываться. В подобных случаях, повторный электрофорез в перпендикулярном направлении может привести к более полному разделению анализируемых веществ, и этот принцип лежит в основе методов двумерного электрофореза. Электрофорез в первом направлении проводят обычным способом, а затем, полученную электрофореграмму используют без фиксации и окрашивания, в качестве стартовой зоны для электрофореза во втором направлении, перпендикулярном первому. Чтобы повысить разрешение в значительной степени, необходимо на втором этапе изменить, по крайней мере, один из электрофоретических параметров. Рисунок 46. Схема проведения двумерного электрофореза 62 Основные принципы двумерного электрофореза в полиакриламидном геле были сформулированы Раймондом (Raymond). Он показал, что электрофорез на пластинах полиакриламидного геля в двух направлениях (ортакрильная методика – от англ. orthogonal и acrylamide) позволяет получить информацию о разделении сходных белков по зарядам и размерам. На практике следует менять и концентрацию геля, и буферную систему. Возможность для дальнейшего улучшения разделения белков открывает сочетание изоэлектрического фокусирования с электрофорезом в полиакриламидном геле, содержащем додецилсульфат натрия, а также использование различных видов равномерных или скачкообразных градиентов концентрации полиакриламида. Поскольку все указанные методы можно сочетать друг с другом, число возможных вариантов двухмерного электрофореза огромно. На рисунке 47 приведена типичная картина двумерного электрофореза сложной смеси белков, например, в пробе из крови или ткани пациента. Можно видеть огромное число пятен, соответствующих отдельным белкам. Их идентификация является сложной и трудоемкой задачей, дающей, однако, важную информацию о биохимических процессах в клетке, или о состоянии пациента. Однако, даже без полной расшифровки, рисунок пятен и/или его изменения при патологиях, уже могут дать очень ценную диагностическую информацию. Такого рода исследования лежат в основе нового перспективного биомедицинского направления – протеомики (proteomics). Рисунок 47. Двумерный электрофорез смеси белков (а). На рисунке справа приведена модельная схема распределения белков (б). 63 Электрофорез нуклеиновых кислот в гелях Электрофорез в полиакриламидном геле применяют также для разделения коротких фрагментов нуклеиновых кислот, например, при секвенировании ДНК по Сэнгеру (Sanger). Кроме этого, ПААГ-электрофорез применяют для визуализации в методах ПДРФ (полиморфизм длин рестрикционных фрагментов, restriction fragment length polymorphism) и ПЦР (полимеразная цепная реакция – метод синтеза копий молекул ДНК, polymerase chain reaction). Для разделения фрагментов ДНК разной длины, используют гели с различной концентрацией агарозы. Чем меньше длина разделяемых фрагментов ДНК, тем больше должна быть концентрация агарозы (табл. 4). Таблица 4. Концентрация агароы в гелях для разделения фрагментов ДНК длина разделяемых фрагментов ДНК, пар оснований концентрация агарозы, % мас. 50 – 1 500 2.0 300 – 3 000 1.5 400 – 6 000 1.2 500 – 10 000 1.0 800 – 10 000 0.7 1 000 – 20 000 0.5 При проведении электрофореза, отрицательно заряженные фрагменты ДНК двигаются от катода, заряженного отрицательно, к положительному аноду. Более длинные молекулы мигрируют медленнее, так как задерживаются в геле, а короткие молекулы двигаются быстрее. После разделения, фрагменты ДНК разной длины визуализируют при помощи флуоресцентных красителей, специфично взаимодействующих с ДНК, например, агарозные гели обычно красят бромистым этидием, который интеркалирует между азотистыми основаниями дуплекса и флуоресцирует в УФ-лучах. Определение размеров производят путем сравнения наборов коммерческих фрагментов ДНК известной длины («DNA ladder», «линейка», «маркеры ДНК») и ДНК в исследуемых образцах. Обычно для электрофоретического анализа ДНК используют агарозные гели, но, если разделяемые фрагменты ДНК имеют длину всего в несколько 64 десятков нуклеотидных пар, например, при секвенировании ДНК, то можно использовать и полиакриламидный гель. Рисунок 48. Фотография агарозного геля после электрофореза ДНК. Левая дорожка – фрагменты ДНК известной длины Рисунок 49. Результат электрофоретического разделения продуктов ПЦР. Агарозный гель окрашен бромистым этидием, флуоресцирующим под действием ультрафиолета (здесь с длиной волны 312 нм) Электрофоретические методы исследования нуклеиновых кислот явились одной из основ возникновения важного и перспективного направления биологии и медицины (диагностика и терапия) – геномики (genomics). В медицине электрофорез белков широко используется для диагностики заболевания печени и почек, иммунной системы, некоторых злокачественных новообразований (лейкозы), острых и хронических инфекций, генетических поломок и др. Известен ряд своеобразных электрофоретических «синдромов» – типичных картин электрофореграмм, характерных для некоторых патологических состояний (например, при диспротеинемии или парапротеинемии). 65 ЖИДКОСТНАЯ ХРОМАТОГРАФИЯ Основное применение рассмотренных выше жестких макропористых гелей – это сорбенты для жидкостной хроматографии, которая позволяет разделять самые сложные смеси, в том числе биологические, с выделением в чистом виде целевых продуктов, как в аналитических (диагностика), так и в препаративных целях. В силу своей эффективности и универсальности, жидкостная хроматография является наиболее распространенным методом биосепарации. Виды хроматографии отличаются лишь природой сорбентов и различным характером взаимодействия пор и частиц, которое является причиной селективного удержания частиц в колонке с сорбентом. 1) Эксклюзионная (гель-проникающая) хроматография. 2) Сорбционная хроматография. 2.1 Ионообменная хроматография. 2.2 Хроматофокусирование. 2.3 Обращенно-фазовая хроматография. 2.4 Хроматография гидрофобного взаимодействия. 2.5 Металло-хелатная хроматография. 2.6 Ковалентная хроматография. При отсутствии взаимодействия сорбента с порами (1), сначала выходят самые крупные частицы, затем – мелкие. При наличии взаимодействия – наоборот (2). Рисунок 50. Зависимости объема элюирования от молекулярных масс элюатов при эксклюзионной (1) и адсорбционной хроматографии (2) 66 растворитель (элюент) дозатор насос (ввод пробы) сорбент детектор коллектор (сбор фракций) Рисунок 51. Принципиальная схема хроматографической установки Требования к оборудованию: коррозионная стойкость; работа под большим давлением; герметичность; постоянная скорость подачи элюента; высокоточное детектирование на выходе; эффективное фракционирование. Эксклюзионная хроматография Эксклюзионная хроматография (Size-exclusion chromatography, SEC, gelfiltration chromatography) – разновидность хроматографии, в ходе которой молекулы веществ разделяются по размеру, за счет их разной способности проникать в поры неподвижной фазы. При этом, первыми выходят из колонки наиболее крупные молекулы (бо́льшей молекулярной массы), способные проникать в минимальное число пор стационарной фазы. Последними выходят вещества с малыми размерами молекул, свободно проникающие в поры. В отличие от адсорбционной хроматографии, при гель-фильтрации стационарная фаза остается химически инертной и с разделяемыми веществами не взаимодействует. Условием для осуществления эксклюзионной жидкостной хроматографии (см. рисунок) является сорбционная инертность сорбента, включая внутренние поры, к частицам (молекулам) разделяемых веществ. В этом случае, объем элюирования: V1 = V0 + KsecVm, где 0 < Ksec < 1. 67 В данной ситуации, Ksec может рассматриваться как равновесный коэффициент распределения для данной молекулы между объемом пор и межчастичным пространством, который не зависит в определенных условиях от скорости потока элюента. тогда: ΔG0 = ΔH0 - T·ΔS0 = RT lnKsec , а ΔH0 = 0 и Ksec = exp(ΔS0/R). Как уже отмечалось, взаимосвязь объема элюирования с молекулярной массой в случае однотипных молекул можно представить в виде зависимости: Рисунок 52. Взаимосвязь объемов элюирования и молекулярных масс элюата при эксклюзионной жидкостной хроматографии сферическая частица стержнеобразная частица (вращается) статистический клубок Рисунок 53. Схема «поведения» частиц различной формы и размера в порах сорбента 68 Зависимость доступного объема пор для частиц разного размера и формы можно проиллюстрировать на рисунке (см. рис. 53). Из схемы видно, что для частиц большего размера доступна меньшая доля объема поры. Для частиц одной и той же массы, наименьшая величина исключенного объема наблюдается для сферических частиц (толщина слоя, dчаст/2), наибольшая – для вращающихся стержней (L), и промежуточная – для статистических клубков ( 2√𝑟 2 , где √𝑟 2 ~ √M ). Расчеты («теоретическая хроматография») дают: Ksec= exp(-S·L/2), где L – протяженность проекции молекулы, S – величина поверхности, отнесенная к единице объема поры (константа для данного сорбента, для шара – это диаметр). Рассчитанная зависимость L от V элюирования имеет вид, аналогичный экспериментально установленной зависимости M от Vэлюир. Рисунок 54. Теоретический расчет взаимосвязи объемов элюирования с протяженностью проекции молекулы при эксклюзионной жидкостной хроматографии Учет возможных различий не только в массе, но и в конформации частиц, возможен с помощью следующей формулы (уравнение Бенуа): [η]·M = 2.5·Na·Vr = 2.5·Na·D3/6 [η]·M – не зависит от конформации и свойств макромолекулы, не требуется калибровка; [η]·– характеристическая вязкость; D – коэффициент диффузии; Na – число Авогадро; Vr – гидродинамический объем молекулы. Экспериментально доказано, что величина [η]M не зависит от конформации, разветвленности и химической природы частиц, и может быть представлена в виде универсальной калибровочной зависимости (рис. 55). 69 Рисунок 55. Универсальная зависимость величины [η]M от объема элюирования при эксклюзионной жидкостной хроматографии полимеров различной структуры Для получения сорбента, способного к разделению в режиме эксклюзионной хроматографии в биомедицинских целях, необходимо создать на поверхности сорбентов нейтральные гидрофильные группы, которые не взаимодействуют с белками и другими биомолекулами: H3C O HO OH H3C n C N CH3 O NH2 полимеры на основе декстрана и других полиглеводов полимеры на основе акриламида полимеры на основе N-виниламидов (например, ПВП) Кроме получения соответствующих сшитых полимеров, возможны различные пути «посадки» этих групп на поверхность. Для крупнопористых кремнеземов – это поверхностная прививка. В этом случае распространенным вариантом является введение гликольной группировки: HO H3Si H3Si Si H3Si RO OH + H2Si H3Si HO H3Si Si OH RO Si RO H3Si CH2 CH2 HC O H3Si Si O H2 O Si H2Si H3Si O Si CH2 CH2 HC O O H3Si H3Si Si O Si H2Si H3Si O Si CH2 O CH CH2 OH OH H3Si Рисунок 56. Введение гликольной группировки на поверхность сорбентов Возможна также сорбционная или химическая модификация кремнеземов нанотолщинными слоями гидрофильных полимеров (поливинилпирролидоном, полиакриламидом, декстраном и др.). Эксклюзионная хроматография широко используется для изучения синтетических полимеров. Для получения очищенных препаратов белков она мало эффективна, в связи с тем, что молекулы белков в нативных 70 конформациях имеют форму, близкую к сферической, размер которой мало зависит от молекулярной массы, и не связан с химической структурой белка. Однако, есть как минимум две области, в которых этот метод оказался весьма эффективным. Например, получение очищенных вирусных препаратов для производства вакцин. Рисунок 57. Очистка вирусов и белков аллантоисной жидкости методом эксклюзионной хроматографии Наращивание вирусной массы (например, вируса гриппа) проводят, впрыскивая суспензию живых вирусов в куриные яйца. После завершения ферментации, для отделения выращенной колонии вирусов от белков яйца (аллантоисной жидкости), эту смесь наносят на колонку с эксклюзионным сорбентом, в качестве которого применяют макропористые стекла, покрытые нано-толщинными слоями поли-N-винилпирролидона. Крупные частицы вируса выходят в исключенном объеме колонки, а смесь белков аллантоисной жидкости выходит широким пиком при больших объемах элюирования. Обессоливание и концентрирование белков. При лабораторных исследованиях белковых систем, часто, целевые белки оказываются в виде разбавленных водных растворов с высокими концентрациями солей. Для концентрирования и обессоливания, в эти растворы вводят гранулы мелкопористых гидрогелей (например, сшитого полиакриламида). Гель быстро набухает, поглощая воду и соли, а более крупные молекулы белков остаются в межчастичном пространстве. Ионообменная хроматография Метод ионообменной хроматографии (Ion-exchange chromatography, IEC) основан на использовании явления ионного обмена между неподвижной твердой фазой ‒ ионообменником (сорбентом) и подвижной жидкой фазой ‒ раствором, содержащим ионы, обмениваемые с ионами сорбента. 71 Молекулы биополимеров (белков) обычно заряжены, и количество некомпенсированных зарядов на разных молекулах различно. Поэтому они будут притягиваться к противоположно заряженным группам на поверхности белка тем сильнее, чем выше их заряд. Пусть на отрицательно заряженный сорбент нанесена смесь белков с различными зарядами. В качестве сорбентов используют ионообменники ‒ иониты, представляющие собой нерастворимые в воде твердые фазы. Иониты состоят из матрицы, в которой распределены ионогенные группы, включающие фиксированные, прочно связанные в матрице ионы, и менее прочно связанные противоионы (т. е. ионы противоположного знака), способные к отщеплению от ионита и к переходу в раствор. Эти противоионы могут обмениваться с одноименными (катионы ‒ с катионами, анионы ‒ с анионами) ионами раствора. Разделение происходит за счет разницы зарядов различных молекул. А-1 выйдет первой в межпоровом пространстве, далее выйдет А0, затем А+1 и т.д., то есть, чем больше суммарный положительный заряд молекулы, тем дольше она задержится в колонке. А+1 поток молекул А с суммарным зарядом А-1, А0, А+1, А+2 и т.д. А0 А-1 Рисунок 58. Схема движения различно заряженных частиц через колонку с ионообменным сорбентом Таблица 5. Сорбенты на основе целлюлозы сорбенты-анионообменники на основе целлюлозы диэтиламиноэтил-целлюлоза (DEAE) + -O-(CH2)-NH-(Et2)- + -O-(CH2)-NH-(Et3)- сорбенты-катионообменники на основе целлюлозы -O-CH2-COOH -OPO3H2 -OCH2-CH2-SO3H карбоксиметильная группа ортофосфорная группа сульфоэтиловый эфир Метод был разработан в 1950-х годах Собером (Sober) и Петерсоном (Peterson) на примере DEAE- и карбоксиметил-целлюлозных сорбентов, и до сих пор является наиболее распространенным методом разделения белков (до 70 %). 72 Хроматофокусирование Хроматофокусирование (chromatofocusing) – метод ионообменной хроматографии, основанный на элюировании с внутренним (создаваемым внутри колонки) градиентом рН. Метод предложен Л. Слайтерманом в 197879 гг. как вариант ионообменной хроматографии с pH-градиентным элюированием для разделения веществ биполярного строения (аминокислот, белков, ферментов и т.д.). Колонку предварительно уравновешивают стартовым раствором до pH, соответствующего начальной точке градиента, а затем пропускают полибуферный элюент (раствор высокомолекулярного амфолита) при резко отличающемся pH, и тем самым формируют градиент pH (в анионообменной колонке – нисходящий, в катионообменной – восходящий). Градиенты линейны в широком диапазоне pH. Биполярные вещества разделяются в условиях градиента pH в соответствии со своими изоэлектрическими точками. Поведение заряженной молекулы (белка) в такой колонке, при пропускании через нее буферного раствора, можно проиллюстрировать следующими рисунками: Рисунок 59. Схема «фокусировки» и движения молекул белков с pI=8.5, 9.0 и 9.5 при элюировании с колонки с начальным pH=10 буфером с pH=8. В модельном эксперименте, на колонку с исходным pH=10, наносится буфер с pH=8, и разделяют модельную смесь 3 белков с pI: 8.5, 9.0 и 9.5 (изображено точками). После каждого из объемов, равных объему колонки, pH по высоте колонки изображена кривыми. Белки «фокусируются» в виде узких зон при pH=pI. При добавлении новых порций буфера, зоны будут синхронно сдвигаться к выходу из колонки. 73 Рисунок 60. Зависимость выхода белков с pI=8.5, 9.0 и 9.5 от объема элюирования буфером с pH=8 (начальное значение pH колонки = 10) Используются те же ионообменные сорбенты, что и при ионообменной хроматографии. В случае анионообменника, в качестве полибуфера используется полиэтиленимин. Обращенно-фазовая хроматография Обращенно-фазовая (Reversed-phase chromatography, RPC) хроматография – вариант хроматографии, в котором стационарная фаза является неполярной. Используется разница в гидрофильно-гидрофобном балансе анализируемых молекул. Для водных растворов полимеров используются носители с гидрофобными поверхностями, на которые высаживаются частицы из водной фазы. Чем более гидрофобна частица, тем сильнее она «прилипает» к поверхности. Далее вводится смешанный растворитель с градиентом состава (вода-изопропанол, или вода-ацетонитрил). С каждой новой порцией элюента выходят все более гидрофобные частицы. С увеличением доли органического растворителя в элюенте, гидрофобность выходящих частиц увеличивается. 74 возрастание гидрофобности I Рисунок 61. Схема движения частиц различной гидрофобности сквозь колонку с гидрофобным сорбентом при обращеннофазовой хроматографии Рисунок 62. Порядок выхода молекул с различной гидрофобностью из колонки при обращенно-фазовой хроматографии Ввиду того, что необходимо «проталкивать» водный элюент через узкие гидрофобные каналы (поры), необходимо прикладывать высокие давления и применять очень жесткие гели на основе агарозы, акрилатов, метакрилатов и, в особенности, силикагелей или макропористых стекол. Последние должны быть модифицированы «привитой» фазой на основе кремнийорганических соединений с гидрофобными органическими радикалами (C16-C18), или нанотолщинными слоями гидрофобных полимеров (например, политетрафторэтиленом, полистиролом). Этот метод очень эффективный и производительный, дает высокое разрешение при разделении (т.н. высокоэффективная жидкостная хроматография – ВЭЖХ или HPLC). Однако, при адсорбции на сильно гидрофобную поверхность, белковые молекулы часто «разворачиваются», и при этом необратимо теряют биологическую активность. Поэтому, этот метод наиболее часто используется для разделения и анализа низкомолекулярных объектов: витаминов, гербицидов, пептидов, нуклеотидов, фрагментов рестрикции белков. Метод разработан в 1950-е г. Боскотом (Boscott), Болдингом (Bolding) и Мартином (Martin). Хроматография гидрофобного взаимодействия Хроматография гидрофобного взаимодействия (Hydrophobic Interaction Chromatography) – один из эффективных методов разделения 75 сложных смесей белков, основанный на различиях в гидрофобности их молекул, и широко применяемый как в аналитической химии, так и в химической технологии. Отмеченную выше денатурацию белков при адсорбции на гидрофобных поверхностях можно устранить, переходя к «мягким» гидрофобным сорбентам. Однако, при этом сорбционная активность из водной фазы сильно снижается. При введении в воду солей ((NH4)2SO4, NaClO4), наблюдается эффект «высаливания», т.е. уменьшения растворимости органических соединений в воде (при определенной величине гидрофильно-гидрофобного баланса белка он теряет способность к растворению и высаживается на гидрофобной поверхности). Далее, снизив концентрацию соли в водной фазе, можно добиться растворения тех белков, которые «сели» на сорбент при более высокой концентрации соли. Рисунок 63. Порядок выхода молекул с различной гидрофобностью при хроматографии гидрофобного взаимодействия Белки выходят в порядке увеличения гидрофобности при ниспадающем градиенте концентрации соли. Этот вид разделения, в отличие от предыдущего, не приводит к денатурации белков. «Мягкие» гидрофобные сорбенты содержат на поверхности радикалы с меньшим, чем у предыдущих сорбентов, атомов углерода (-C8H17, -CO-NH-C8H17 и др.). Метод был разработан в 1970-е годы Поратом (Porath) и Эртеном (Hjertén). Металло-хелатная хроматография Рассмотренные выше виды хроматографии были основаны на неспецифических взаимодействиях (размер, заряд, гидрофобность) сорбатов и сорбентов. Можно добиться более избирательного выделения целевого продукта (белка), используя специфические молекулярные «узнавания» 76 определенных групп в молекуле сорбата с лигандами, закрепленными на поверхности сорбента. Таким взаимодействием может быть металл-хелатное связывание (Immobilized Metal Chelate Affinity Chromatography, IMAC). В качестве лиганда (L) могут выступать фрагменты иминоуксусной кислоты с хелатно связанными ионами Cu2+, Ni2+ и др. С этими координационно-ненасыщенными группами будут прочно связываться, в частности, имидазольные группы аминокислотных звеньев гистидина. H3C O CH2 H2N Ni N CH2 C O 2+ NH H N - O O CH2 + HC N C C CH2 CH HC (L) N C CH3 Ni 2+ O O H2N CH2 O - (L) C O O Снятие с колонки гистидин-содержащего белка можно осуществить введением раствора этилендиаминтетрауксусной кислоты (ЭДТА) или другого комплексона. Метод предложен Поратом (Porath) в 1975 г. Ковалентная хроматография Под термином «ковалентная хроматография» (Covalent chromatography) понимают способ выделения целевого вещества путем обратимого образования ковалентной связи с сорбентом. Этому требованию отвечает реакция тиол-дисульфидного обмена, основанная на том, что в ряде белков присутствуют тиольные или дисульфидные группы, благодаря наличию в них звеньев цистеина При введении в состав поверхностного слоя матрицы (сорбента) тиольных групп, возможна селективная иммобилизация HS-содержащих белков (в присутствии окислителей) с последующим выделением целевого продукта (путем восстановления дисульфидной связи): HS SH + HS белок [H] [O] HS S S белок HS SH + HS белок Рисунок 64. Схема иммобилизации HS-содержащих белков Метод разработан Карлсоном (Carlson, 1974 г.), Пачерником (Patchernik, 1977 г.) и Лозинским (СССР, 1980 г.). 77 Аффинная хроматография Аффинная хроматография (Affinity chromatography). Этот вариант хроматографии обеспечивает одностадийное выделение сложных соединений, основанное на молекулярном «узнавании» соответствующих групп и образовании прочных и специфичных комплексов. Существуют биологические пары, которые обладают сильным взаимным сродством друг к другу (антиген-антитело, фермент-субстрат или ингибитор фермента и т.д.). Таблица 6. Примеры систем «лиганд-антилиганд», используемых в аффинной хроматографии антитело фермент лектин нуклеиновая кислота гормон, витамин сахар антиген, вирус, клетка аналог субстрата, ингибитор, кофактор полисахарид, гликопротеин, клеточный рецептор, мембранный белок, клетка белок, связывающийся с нуклеиновой кислотой (фермент или гистон) рецептор, белок-носитель лектин; белок, связывающийся с сахаром На поверхности сорбента закрепляется один из участников пары, который «вылавливает» из потока нужные ему частицы. «Снятие» связанного целевого продукта осуществляется при введении в поток элюента избытка лигандовконкурентов в борьбе за взаимодействие с закрепленной группой, изменением температуры, pH, или состава элюента. Рисунок 65. Схема механизма аффинной хроматографии 78 Ограничения метода аффинной хроматографии: 1) биологические лиганды очень дороги и требуют предварительного выделения, могут денатурировать во времени, в ходе «снятия» и т.д. 2) необходимы удобные количественные методы иммобилизации лигандов на поверхности для точного определения условий связывания и разрушения. Список рекомендованной литературы к разделу: [8], [9], [10], [11]. 79 МЕТОДЫ ИММОБИЛИЗАЦИИ БИОЛОГИЧЕСКИ АКТИВНЫХ СОЕДИНЕНИЙ И БЕЛКОВ НА ПОЛИМЕРНЫХ МАТРИЦАХ Основные требования: прочное присоединение лиганда; мягкие, не денатурирующие условия реакции; возможность проведения реакции в водных средах; высокие (количественные) выходы продуктов реакции. Карбоксидиимидный метод (P- полимерная матрица, Pr- белок). 1. N P COOH + R C N O Pr C P R N O O Pr P R NH + R C N R NH NH NH2 R O H Выбор природы радикала в карбодиимиде определяется поставленной задачей. Если реакция проходит в гомогенной жидкой среде, то предпочтительнее, чтобы образующийся карбодиимид выпадал в осадок. Если же в реакции участвует твердая пористая полимерная матрица, то карбодиимид должен остаться в растворе и не загрязнять конъюгат. Реакция идет при комнатной температуре, в воде, при нейтральных значениях pH. 2. Ацил-азидный метод (основан на реакции Курциуса, 1902 г.) 1) с использованием гидразина: O O N 2H 4 P P O C COOH Pr HNO 2 P NH P NH2 C C NH N3 H2N Pr 2) с использованием хлорангидридов: P P C OH O O O NaN3 C P C O Pr NH2 P C NH N3 Cl Pr 3. Циклоприсоединение по реакции Хьюсгена (Huisgen) Открытие катализаторов «click»-реакций Шарплесом (Sharpless, 2001 г.): 1+ Cu , Ru2+, Pd2+ и др. сделало эту реакцию удобным методом «сборки» различных молекулярных конструкций: 80 R1 Br + + NaN 3 R1 CH2 Cl R2 NH2 -COOH N C CH R2 CH2 HO R1 N CH C или + N3 N CH C R2 0 25 C + R2 C CH N + N R1 N N выход ок. 100 % N R1 N Таким путем можно легко получать конъюгаты заданной структуры, блок-сополимеры, прививать различные молекулы на полимерные поверхности и частицы. Тиольные «click»-реакции 4. Обе реакции идут с высоким выходом при облучении. 5. С использованием (хлор)ангидридов кислот а) может быть реализован в случае двухосновных карбоново-кислотных групп в полимере. O O C P HC C O + Pr NH2 C P HC NH C O O 81 OH Pr б) обычно реализуется при введении –С(O)–Cl группы в полимерный носитель путем сополимеризации с акрилоилхлоридом (CH2=CH-C(O)-Cl). В холодной воде группы (-С(O)-Cl) гидролизуются, но медленно, в то время как реакция с NH2-группами быстрая. O O C P C Pr + NH2 Pr NH P Cl С использованием активированных эфиров 6. O P + NO2 O Pr NH P NH2 Pr HO + NO 2 O O O O P N Pr + NH2 NH P + Pr HO N O O O O Эти соединения устойчивы при хранении, медленно гидролизуются в воде, что обеспечивает количественный выход конъюгатов в водных растворах. За ходом первой реакции легко следить спектрофотометрически (O-Ph-NO2 – вещество ярко-желтого цвета). Карбонилдиазольный метод 7. O N OH P C N N + N N P N + O Pr Pr O O 8. Азометиновый метод O P + H2N H NH P NH2 P Pr -H 2O C H N Pr [H] P NaBH4 CH2 NH Pr Альдегидную группу в синтетические полимеры обычно вводят путем (со)полимеризации с акролеином (CH2=CH-C(O)H), а в полиуглеводы – путем контролируемого окисления. 82 Бромциановый метод 9. Для реакции необходимо наличие цис-гликольных групп в полимере (например, в целлюлозе). Реакция проходит в две стадии. Активированный на первой стадии полимер стабилен, и эту реакцию обычно проводят на специализированных предприятиях. а) OH O BrCN P C O N P P OH C OH NH O б) O H2N Pr P Pr NH C NH OH O P H2N NH C O Pr P N Pr O O O H2N Pr C NH Pr P OH 10. Реакции, основанные на использовании подвижного атома галогена 10а) с использованием полистирольных матриц: CH2 P H2N + CH2 P Pr -HCl NH Pr Cl Эта реакция была использована впервые Меррифилдом (Merrifield) для первого синтеза белка с использованием полимерного носителя. 10б) с использованием гидроксилированных матриц: Cl N P OH + Cl C N N C N C P O H2N N Pr P N C N Cl C NH Cl Cl O H2N P C 83 O Pr Pr C N C N NH Cl N Pr N C N C C C NH Pr изоцианатный метод 11. O O Pr P NH2 + O C R N N C P C O NH 12. R N NH C O NH2 C P O NH Pr C R NH NH NH эпоксидный метод Эпоксигруппа не очень активна, но стабильна, не окисляется, самопроизвольно не раскрывается, легко вводится на стадии синтеза и при модификации. Pr CH2 P HC CH2 NH2 P O C CH2 O O CH2 13. HC CH2 OH CH3 H2C CH2 HC NH Pr Глицидилметакрилат – легко сополимеризуется с другими мономерами и встраивается в матрицу O Реакция тиол-дисульфидного обмена Очень удобная обратимая реакция. Необходимо вводить в матрицу SHгруппы. В качестве матрицы часто используются не только полимеры, но и металлы. [O] P SH + HS Pr P S S Pr [H] Список рекомендованной литературы к разделу: [2], [7]. 84 РАСПРЕДЕЛЕНИЕ МЕЖДУ ЖИДКИМИ ВОДНЫМИ ФАЗАМИ Традиционно, экстракция – это переход в органическую фазу вещества, растворенного в воде, если оно имеет сродство к органике (2 несмешивающиеся фазы: 1-вода, 2-эфиры, углеводороды, амины и т.д.). Этот процесс давно используется в фармацевтике и косметологии. Термодинамические основы метода A – извлекаемое вещество; α, β – фазы; X – мольная доля; μ – химический потенциал; [Cα] [Cβ] ΔμαA = RT·lnXαA ΔμβA = RT·lnXβA Рисунок 66. Схема жидкостной экстракции При равновесии вещество распределено по фазам, так, что μα = μβ P/ Q/ = lnXβA - lnXαA μ0,α A - μ0,β A = P/ Q/ ·RT = = RT (lnXβA - lnXαA) = = RT·ln(XβA - XαA) = = RT·ln(XβA /XαA) = const коэффициент распределения: K = XαA/XβA или μ0,α A - μ0,β A = RT·lnK Рисунок 67. Термодинамика жидкостной экстракции Параметр K зависит от того, насколько растворитель α и растворитель β понижают химический потенциал вещества А. Разница потенциалов чистого вещества в этих фазах: μ0,α A - μ0,β A = RT·lnK. Следовательно, K не зависит от концентрации А в фазах, соотношение концентраций фиксировано, поэтому, любое количество А распределится по фазам. Для биологических систем нельзя использовать неводные растворители, поскольку они вызывают денатурацию. Поэтому, для образования фаз α и β, в 85 водную фазу вводятся водорастворимые полимеры, растворы которых не смешиваются между собой. При растворении в низкомолекулярном растворителе, молекула полимера ведет себя как набор квазинезависимых сегментов, аналогичных растворителю, поэтому, изменение энтропии при смешении достаточно велико для того, чтобы компенсировать небольшое увеличение энтальпии. При смешивании двух полимеров без растворителя (расплав), получится двухфазная система (нет смешения) в силу очень малого изменения энтропии. ΔSсмеш = -k(n1·lnφ1 + n2·lnφ2) >> ΔSсмеш = -k·(φ1/p1 ·lnφ1 + φ2/p2 ·lnφ2) полимер-низкомолекулярный растворитель полимерполимер где: n1и n2 – число молекул I и II видов; k – константа Больцмана; φ1 и φ2 – объемные доли; p1 и p2 >> 1 – степень полимеризации. Па́ры полимеров, образующие истинные растворы – большая редкость. В основном, такие растворы образуются при большом избытке одного из полимеров. Таблица 7. Типичные па́ры используемых полимеров P (нижняя фаза) Q (верхняя фаза) полипропиленгликоль полиэтиленгликоль; поливиниловый спирт декстран и его производные поли-N-винилпирролидон ППГ, ПВС, ПЭГ декстран метилцеллюлоза гидроксиэтилцеллюлоза Na-декстрансульфат Na-карбоксиметилдекстран Na-карбоксиметилцеллюлоза Na-декстрансульфат Примеры тройных систем: «Декстран-Гидроксипропилдекстран-Полиэтиленгликоль», «ДекстранПолиэтиленгликоль-Полипропиленгликоль» (известны системы, включающие до 30 полимеров). Практически удобно изображать фазовые диаграммы этих трехфазных систем в квазибинарном виде. 86 Рисунок 68а. Квазибинарная фазовая диаграмма смеси двух полимеров в водном растворе В модельном эксперименте cмешали 5 % раствор декстрана (ММ=500) и 3.5 % ПЭГ (ММ=6000). Видно, что даже низкомолекулярные полимеры образуют несмешивающиеся водные фазы, где различаются даже количества воды. С ростом молекулярных масс разделение будет практически полное. Рисунок 68б. Состав водных фаз при смешении 5 % раствора декстрана (ММ=500) и 3.5 % раствора ПЭГ (ММ=6000) Vверх/Vнижн ~ L1/L2 Реальный состав разделившихся водных фаз, содержащих декстран и ПЭГ, причем один из полимеров (декстран) заведомо низкомолекулярен, приведен на рисунке. Зависимость фазовых диаграмм (совместимости водных растворов полимеров) от молекулярных масс, на примере системы «декстран-ПЭГ», приведена на рисунке (рис. 69). 87 1) ПЭГ (6000)-ДК (23 000) 2) ПЭГ (6000)-ДК (2 300) 3) ПЭГ (6000)-ДК (83 000) 4) ПЭГ (6000)-ДК (280 000) Рисунок 69. Система «декстран-ПЭГ-вода». Влияние молекулярной массы декстрана на фазовую диаграмму Разбавленные растворы совместимы, а достаточное разделение на фазы достигается уже при молекулярной массе декстрана 23 000, когда растворы еще не вязкие. Необходимо, чтобы хотя бы один из полимеров имел молекулярную массу порядка нескольких десятков тысяч. Для облегчения перемешивания, второй полимер может быть низкомолекулярным. В приведенной схеме, система №2 близка к оптимальной. Общие закономерности распределения между фазами 1) веществ: Зависимость коэффициента распределения от массы разделяемых формула Бренстеда: C1/C2= eλM/kT где: λ – коэффициент, определяемый межмолекулярным взаимодействием, M – масса частиц; C1/C2 – коэффициент распределения. Зависимость от массы экспоненциальная, поэтому, если для низкомолекулярных веществ K составляет 0.5-2.0, то, при увеличении молекулярной массы вещества, K достигает огромных значений (почти стопроцентная избирательность). Таблица 8. Значения K для некоторых веществ вещество малые молекулы, витамины, красители белки и нуклеиновые кислоты К степень разделения 0.5-2.0 незначительное обогащение 0.01-100 значительное обогащение 88 крупные частицы, клетки, вирусы, бактерии 0- строгая избирательность 2) Зависимость К от полимеров, образующих фазы 2.1 Зависимость от концентрации полимеров, формирующих фазы при отсутствии полимеров К=1. C оптимальная (Cопт) – это минимальная концентрация, при которой Kопт. ~ Kпредельн. Сопт Рисунок 70. Влияние концентрации полимера, формирующего фазы, на K (распределения) 2.2 Зависимость от молекулярной массы При разделении, экстрагируемое вещество «выталкивается» из одной фазы и «втягивается» в другую. «Выталкивание» усиливается с ростом молекулярной массы полимера, образующего фазу. «Втягивание» усиливается с уменьшением молекулярной массы полимера, образующего фазу. Поэтому, необходимо подбирать молекулярные массы полимеров, исходя из конкретных условий. Например, с ростом молекулярной массы полиэтиленгликоля, K (белков) уменьшается, с ростом ММ декстрана – K (белков) растет. 3) Влияние ионной силы При I>0.5 (высокая ионная сила) для системы «ПЭГ-декстран»: белки идут в ПЭГ, нуклеиновые кислоты – в декстран. При низких значениях ионной силы, ионы Na+ и Li+ тоже оказываются неравномерно распределенными между полимерными фазами, поэтому, одна из фаз приобретает заряд; для компенсации этого заряда, в обратном направлении движутся заряженные молекулы разделяемых веществ: Li+ движутся в ПЭГ-фазу, Na+ – в фазу декстрана. pH влияет на заряд белков и, тем самым, на K. 4) Влияние гидрофильно-гидрофобного баланса полимеров Для низкомолекулярных растворителей и для полимеров, существует так называемая «гидрофобная лестница» – распределение веществ в порядке возрастания их гидрофобности. 89 гидрофобность гептан бензол эфир фенол ацетон вода вода+соль ПВКЛ ППГ ПЭГ ПВС метилцеллюлоза гидроксипропил-ДК ДК карбоксиметилдекстран ДК-сульфат Рисунок 71. «Гидрофобная лестница» растворителей и водных растворов полимеров Аналогичная «гидрофобная лестница» существует и для водорастворимых полимеров, но она «растянута» вокруг воды и позволяет тонко регулировать распределение разделяемых молекул по их гидрофильногидрофобному балансу (ГЛБ). Пользуясь этими данными, можно выбирать полимеры, в зависимости от ГЛБ разделяемых веществ. Аффинное распределение При аффинном распределении, в один из полимеров, который образует фазу (Q), вводится аффинный лиганд (Y), способный образовывать комплекс с целевым веществом (X). Молекулы X будут связываться с этими лигандами и концентрироваться в одной из фаз (фазе Q). После этого, вещество X выделяется. Рисунок 72. Схема аффинного распределения в водных фазах 90 Фаза с аффинными лигандами должна быть полностью сепарирована, поэтому, полимер Q должен быть высокомолекулярным и высококонцентрированным. Концентрация модифицированного полимера Q не должна превышать 5 %, для того, чтобы свойства верхней фазы не зависели от свойств лигандов и определялись свойствами полимера Q. Отделять целевой продукт от полимеров можно с использованием smartполимеров. Аффинное осаждение Smart-полимеры растворимы в воде, но, при небольшом изменении параметров (температура, pH, ионная сила), они могут обратимо терять растворимость. При этом, с осадком можно выделять нужные соединения, вводя в smart-полимеры группы лигандов, которые узнают соответствующие биологические молекулы (см. схему). Рисунок 73. Схема аффинного осаждения в водном растворе Таблица 9. Примеры аффинно осаждаемыхсистем полимер альгинат хитозан EUDRAGIT (сополимер ММА и МАК) поли-N-IPAN ПВКЛ лиганд ингибитор соевый ингибитор соевый краситель Cibacron Blue пара-аминобензамидин соевый ингибитор трипсина 91 целевой белок трипсин трипсин лактатдегидрогеназа трипсин трипсин осадитель Ca2+ pH pH Т Т Альгинаты, в присутствии солей Ca2+, осаждаются, за счет образования солевых мостиков. Аминосодержащий полиуглевод хитозан меняет фазовое состояние (растворимость) в узком интервале pH (менее 7 – раствор, более 7 – осадок). Сополимеры метакриловой кислоты и ММА, при подкислении, также выпадают в осадок. От соотношения мономеров зависит чувствительность к разным значениям pH. Поли-N-изопропилакриламид и поли-Nвинилкапролактам теряют растворимость в воде выше Tнктр. Аффинное осаждение в двухфазных системах Один из полимеров – обычный, – в 1 фазе, во второй фазе – smartполимер, оба – в растворе. В одной из фаз концентрируют искомое вещество, затем меняют условия, отделяют жидкую фазу и выделяют целевой продукт. Биотехнологическое применение несмешивающихся полимерных водных фаз Биосепарация Выбор подходов при биосепарации с помощью несмешивающихся полимерных водных фаз определяется величиной константы распределения K. Для пары «ПЭГ-декстран» наблюдается следующее: Таблица 10. Константы распределения K для некоторых молекул 1 2 3 вещество K малые молекулы (пептиды, витамины, лекарственные препараты и т.д.) высокомолекулярные вещества (белки) частицы (клетки, фрагменты клеточных мембран) 0.5-2.0 0.01-100 0 или В случае 3, специальной техники не требуется, искомый объект полностью перейдет в одну из фаз. Таким образом, в частности, удалось выделить из растительных клеток чрезвычайно сложный мембранный комплекс – реакционный центр, отвечающий за фотосинтез в растениях, с последующим определением его структуры рентгеноструктурными методами. В случае 2, простейший подход заключается в регулировании объемов фаз. Так, при К=2, при V1/V2 = 1, в одну из фаз переходит 66.7 % вещества, а при V1/V2 = 5 – в одну из фаз переходит 97.0 % вещества. При биотехнологическом синтезе рекомбинантных белков, в целях увеличения эффективности выделения, к искомой молекуле специально 92 добавляют пептидный фрагмент, увеличивающий К, который впоследствии удаляется ферментативно. Примером может служить стафилококковый белок А (состоящий из 147 аминокислотных звеньев), необходимый для получения соответствующей вакцины. К этой молекуле (экспрессия в E. coli) присоединяем 0, 1 и 3 тетрапептида Ala-Trp-Trp-Pro. При разделении в системе «ПЭГ(4000)-KH2PO4», величины К, соответственно, были: К0=1.6, К1=11.6, К3=96.0. Таким образом, ради эффективности выделения целевого продукта, оказалось выгодным на 1 этапе получать химерный (гибридный) белок 3. При незначительном отличии К от 1, применяются различные технологические решения: многократная противоточная экстракция (последовательное обеднение первичных фаз целевым компонентом путем смешения с чистым растворителем, для получения ряда фракций), жидкостная распределительная хроматография (смешение фаз в стеклянной спирали и центрифугирование), колоночная жидкостная хроматография с полимерным сорбентом, более совместимым с полимером, образующим фазу, например, «целлюлоза-декстран-ПЭГ». В последнем случае, декстран лучше смачивает целлюлозу и удерживается на поверхности целлюлозных частиц. При многократных переносах фаз в разделительных ячейках в коллекторе для сбора различных фракций, наблюдается своеобразная «хроматограмма» разделения смеси веществ по величинам K. Рисунок 74. Теоретический расчет распределения веществ по фракциям в зависимости от величин K при многократных переносах в 180 ячейках где: r – номер пробирки коллектора, а n – число переносов фаз. В этом случае, ширина пика ~ √𝒏, а положение пика rmax = улучшается с ростом числа переносов. 93 𝐧·𝐊 𝟏+𝐊 , то есть, разделение Биокатализ в двухфазных системах Сложнейшие биохимические процессы в живых организмах протекают благодаря природным биокатализаторам – ферментам. Использование этих катализаторов в химической технологии позволяет осуществлять реакции, недоступные при применении синтетических катализаторов. Однако, для реализации такого процесса, необходимо обеспечить ряд условий, основанных на базовых характеристиках ферментативного катализа. Простейшая схема ферментативной реакции указывает, что, для обеспечения многократности актов действия ферментов, нужно, как минимум, обеспечить его доступность субстрату, отсутствие денатурации и удаление продукта реакции, тем более, что многие ферментативные реакции ингибируются продуктами реакций. S + E S .... E P + E где: S – субстрат, E – фермент, P – продукт. Одним из успешных подходов является использование несмешивающихся водных фаз. В этом случае, нужно обеспечить следующую схему: Рисунок 75. Схема биокатализа в несмешивающихся водных фазах Продукт должен уходить из фазы, в которой локализованы E и S. Для увеличения поверхности раздела, смесь разбивается на капли (σв-в ~ 0.01 мН/м, а σвода-масло ~ 40 мН/м), а полимеры, образующие фазу, не должны вызывать денатурацию фермента. Рассмотрим два примера проведения ферментативных процессов в несмешивающихся водных фазах. 94 Получение глюкозы из крахмала Получить чистую глюкозу путем химического гидролиза крахмала практически невозможно из-за большого количества разнообразных, в том числе токсичных, побочных продуктов. Ферментативная реакция идет «гладко». Фермент – α-амилаза, фазы – «ПЭГ-крахмал + 3 % декстран». αамилаза аффинно связывается с крахмалом и находится в этой водной фазе, декстран, не разрушаемый ферментом, поддерживает фазу по мере исчерпания крахмала. Глюкоза, в основном, переходит в ПЭГ-фазу. Схема установки приведена на рисунке (рис. 76). Рисунок 76. Технологическая схема получения глюкозы из крахмала в несмешивающихся водных фазах (система «ПЭГ-ДК») Смесь из реактора поступает в отстойник, в котором происходит разделение жидких слоев. Верхний слой (содержащий ПЭГ и глюкозу) поступает в мембранный сепаратор. Выделяется глюкоза, а ПЭГ возвращается в реактор. Превращение гидрокортизона в преднизолон Эта реакция относится к области фармацевтической химии, а именно – к получению ценного лекарственного препарата против полиартрита из менее ценного предшественника (прекурсора). гидрокортизон (ГК) преднизолон (ПР) 95 В сложной и мобильной молекуле гидрокортизона нужно было продегидрировать один из циклов (показано стрелкой), не затронув остальную часть молекулы. С использованием синтетических катализаторов дегидрирования это не представляется возможным. В качестве биокатализатора был выбран не очищенный фермент, а живая бактерия Arthrobacter Simplex, продуцирующая этот фермент. Фазы: «ПЭГ (15 %) – декстран (3 %)». Соотношения объемов фаз: Vв/Vн = 12.3 : 1.0. Кгк = 2.6, Кпр = 6.4. Все клетки в декстране, ПР почти 100 % в ПЭГ-фазе, ГК в основном (~75 %) в декстран-фазе. В итоге, выход преднизолона составляет почти 100 %. Список рекомендованной литературы к разделу: [9], [15], [16]. 96 ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ. БИОКАТАЛИЗ Выше уже указывалось, что при проведении реакций, катализируемых in vitro ферментами, проводится локализация компонентов процесса. В настоящее время, наиболее распространенным способом локализации является иммобилизация фермента на твердых носителях, благодаря физической сорбции (гидрофобные, ионные, водородные взаимодействия) или путем образования ковалентных связей. Несмотря на многообразие процессов, приводящих к иммобилизации фермента, единые цели можно сформулировать следующим образом: - легкость отделения продукта реакции; - многократность действия (определяется только временем жизни фермента); - сохранение, а, желательно, увеличение активности и стабильности фермента, изменение условий (специфичности) взаимодействия с субстратом и продуктами реакции; - в случае высокомолекулярного субстрата и продукта, желательно наличие «ножки» («spacer»), отделяющей молекулу фермента от поверхности твердого (полимерного) носителя, и не затрагивающей области его активного центра. Рисунок 77. Схема катализа иммобилизованным ферментом (см. текст) Некоторые процессы с иммобилизованными ферментами Получение глюкозо-фруктозных сиропов Относительная сладость 15 % растворов при 15 ºС: Сахар – 100; Глюкоза – 75; Фруктоза – 165; Глюкозо-фруктозный сироп ~ 100. 97 Промышленный процесс, впервые осуществлен в 1973 г.: глюкоза глюкоза + глюкозоизомераза фруктоза Методы иммобилизации: 1) Захват в полые пористые волокна ацетата целлюлозы (SNAM Progetti, Италия) – t1/2 = 70 дней. 2) Захват в гранулы желатинового геля (d ~ 1.3-1.5 мм) с последующей сшивкой глутаровым альдегидом (Gist-brocades, США). 3) Адсорбция - пористый Al (Corning glass works, США), t1/2 = 40 суток. - фенолформальдегидная смола (Kyowa Hakko, Япония). - ионообменная смола (Mitsubishi Chemical Corporation, Япония). - DEAE-целлюлоза (Clinton coouing), t1/2 = 20 дней. 4) Химическая иммобилизация (агароза, BrCN). - захват в гранулы полимера (сшивка глутаровым альдегидом). Схема процесса: Рисунок 78. Технологическая схема процесса получения глюкозо-фруктозного сиропа с помощью иммобилизованного фермента (глюкоизомеразы - ГИ) 98 Разделение рацемических смесей аминокислот Разделение рацемических смесей аминокислот – это первый промышленный ферментативный процесс (1969 г. – получение L-метионина, Япония.) R O D, L- Ac - NH CH R C OH L- H2N аминоацилаза O CH C NH CH C OH O R- Ac рацемизация (изомераза) R OH Способы иммобилизации аналогичны: - адсорбция на DEAE-целлюлозе; - полые волокна и др. Гидролиз лактозы (молочного сахара) Гидролиз лактозы (~5 % в сыворотке молока) – это расщепление ее молекул с образованием глюкозы и галактозы. Гидролиз лактозы может проходить под действием фермента лактазы (β-галактозидазы). лактоза лактаза (β-галактозидаза) глюкоза +галактоза Методы иммобилизации: - захват в полые волокна ТАЦ; - ковалентное связывание: SiO2 (d=0.4-0.8 мм), сталь, NiO2, Al. - адсорбция на ионообменной смоле; - включение в полиакриламидные гели; - связывание с феноло-формальдегидной смолой. Список рекомендованной литературы к разделу: [12]. 99 БИОАНАЛИТИЧЕСКИЕ СИСТЕМЫ Кроме использования в качестве катализаторов в важных биотехнологических процессах, иммобилизованные ферменты являются основой для создания многих биоаналитических и медико-диагностических систем. Одним из важнейших из них является иммуноферментный анализ. Список рекомендованной литературы к разделу: [13], [17]. Иммуно-ферментный анализ Иммуно-ферментный анализ (ИФА, enzyme-linked immune sorbent assay, ELISA) – это обнаружение разнообразных биологических веществ (белки, низкомолекулярные соединения, гормоны и проч.) с помощью специфического биологического «узнавания». Наиболее общим видом биологического молекулярного «узнавания» является взаимодействие специфических белков-иммуноглобулинов, или антител (Ab), с чужеродными белками, или молекулами другой химической природы, называемыми антигенами (Ag), с образованием иммунного комплекса: Ag + Ab → [Ag···Ab] Однако, это событие не сопровождается никакими видимыми изменениями (изменением цвета, флуоресценцией). Нужно найти способ визуализации – это и есть основа иммуноферментного анализа (ИФА). Из англоязычного названия следует, что, для проведения анализа, кроме пары Ag и Ab, необходим сорбент (полимер), организующий всю систему. Чтобы обнаружить антиген с помощью антитела, нужно вместо исходной молекулы иммуноглобулина использовать химический конъюгат с ферментом, тогда, при образовании соответствующего комплекса, появляется возможность проявить это событие, запустив реакцию «субстрат-продукт», например, с образованием окрашенного или флуоресцентного продукта. Но, для того, чтобы увидеть эту серию биохимических событий, необходима полимерная матрица, которая это все закрепит и организует в виде аналитической методики. Рисунок 79. Принципиальная схема иммуно-ферментного анализа 100 Ферменты, которые могут использоваться для организации этой стадии проявления (детекции) с субстратами: 1) Пероксидаза (ПО) действует совместно с Н2О2, субстратом являются дианизидин, фенилендиамин и другие хромогены. 2) Щелочная фосфатаза (ЩФ) – в качестве субстрата используют тетрафенилфосфат. 3) β-галактозидаза – в качестве субстрата используют нитрофенилгалактозид. Требования при получении конъюгатов: 1) их состав должен быть 1:1; 2) не должно быть примесей свободных антител, свободных ферментов; 3) Должна быть прочная связь между антителом и ферментом, чтобы в водной среде она не разрушилась. 4) Должно быть ориентированное связывание фермента с антителом. Прямой способ получения конъюгатов состава 1:1 – соединение напрямую двух белковых молекул, например, с помощью глутарового альдегида. Но, наряду с конъюгатами (>–E), возможно образование спаренных «гомо-конъюгатов» (антитело-антитело, либо фермент-фермент), которые надо тщательно удалять, например, методом жидкостной хроматографии. Есть реагенты, которые специально соединяют антитела только с ферментом: H2N O N O O O E CH2 N O CH2 H O S SH Ab H2C Например, сначала, через «click»-реакции, по –SH группе присоединяют первый белок (Ab), затем, по активированной эфирной связи присоединяется второй белок (фермент). Таким образом, удается получать конъюгаты «правильного» «гетеро» типа (AB-E). Рассмотрим несколько примеров биоаналитических систем, основанных на использовании ферментов. Одним из распространенных тестов, выполненным в виде портативного прибора индивидуального пользования, является глюкометр, контролирующий 101 содержание глюкозы в крови при заболевании диабетом (например, глюкометр фирмы «Bayer»). Метод основан на двух последовательных ферментативных реакциях, приводящих в конечном итоге к появлению окраски, интенсивность которой пропорциональна содержанию глюкозы в пробе крови. OH OH H2C H2C OH O OH OH O + H2O + O2 OH δ-D-глюконолактон β-D-глюкоза H3C CH3 H2O 2 + H2N CH3 3,3/,5,5/ - тетраметил-бензидин (бесцветный, хромоген) CH3 HN NH2 H3C O + H2O 2 OH OH H3C OH глюкозоксидаза (ГО) пероксидаза (ПО) NH H3C + CH3 синий (краситель) интенсивность цвета пропорциональна концентрации [ГЛ] Рисунок 80. Схема работы ИФА-глюкометра Капля исследуемой крови наносится на окошко прибора, где находится двухслойная гидрогелевая мембрана. В верхней мембране иммобилизована гликозидаза, а в нижней – пероксидаза и хромоген. Глюкоза из капли крови поступает в верхнюю мембрану, а белки и другие компоненты крови удаляются с поверхности мембраны. Глюкоза окисляется, а образующееся стехиометрическое количество H2O2 поступает в нижнюю мембрану, где генерируется стехиометрическое количество красителя, определяемое фотометрически. Иммуно-ферментные анализы, основанные на взаимодействиях [Ab··Ag], обычно проводят с использованием автоматических или полуавтоматических ИФА-анализаторов, в которых используются конъюгаты [Ab-E]. В полимерную плашку, обычно из полистирола, с плоским дном (в планшете обычно 96 плашек) помещают все необходимые компоненты, 102 2H2O пропускают луч света, который проходит через раствор и попадает на датчики, таким образом, можно узнать не только о наличии комплекса, но и определить концентрацию, построив график зависимости оптической плотности от времени. Существует несколько подходов к связыванию комплексов с дном и стенками плашки: 1) Антиген (Ag) адсорбционно связывается с поверхностью плашки из специального сверхчистого полистирола (например, плашки Nunc-Immuno). Также возможно добавление в раствор шариков из полистирола (полимерных микросфер), на которых будет адсорбироваться антиген. Но проблема в том, что этот метод действует не всегда, поскольку не все антигены сорбционно связываются с поверхностью плашки. Рисунок 81. Схема анализа антигена методом ИФА на полистирольной кювете 2) Другой метод заключается в химическом присоединении антитела, которое «настроено» на определенный антиген, на поверхность плашки. К данному антигену, присоединенному к антителу на плашке, присоединяется конъюгат «Ab-E» для дальнейшего анализа (так называемый «сэндвич»). Рисунок 82. Схема анализа методом «сэндвич»-ИФА 103 3) К антителу конъюгирован smart-полимер, который может образовывать с поверхностью плашки (при определенных температурах) устойчивый адсорбционный комплекс. Далее, все проводится аналогично методу 2, но плашка, в отличие от 2, становится многоразовой, поскольку, после проведения анализа весь «сэндвич» легко отмывается. Рисунок 83. Схема анализа антигена методом «сэндвич» ИФА с использованием конъюгата Ab1-температурнозависимый smart-полимер Для определения низкомолекулярных гаптенов (моновалентные антигены), таких как антибиотики, допинги, пестициды и проч., используют метод «конкурентного анализа» (см. рис. 84). Исходные плашки «заряжены» конъюгатами «Ab·····Ag-E» (или «Ag·····Ab-E»), дающими в отсутствие гаптена максимальный сигнал с хромогенным субстратом. В присутствии гаптена, интенсивность сигнала уменьшается пропорционально концентрации гаптена. 104 Рисунок 84. Схема конкурентного ИФА (определение гаптена) Рисунок 85. Зависимость ИФА-сигнала от концентрации аналита при прямом и конкурентном ИФА Кроме полистирольных плашек, можно использовать полиэтиленовые и полистирольные пористые мембраны, на которых также адсорбционно прикрепляются комплексы. Роботизированный ИФА-анализатор (Immuno-1) В данном устройстве имеются кюветы, расположенные по кругу, и робот поочередно наполняет их разными пробами. В кюветы заливают реагент R 1, который представляет собой дисперсию гидрогелевых сфер из полиакриламидного геля, в которые иммобилизованы наночастицы магнетита (Fe3O4) и химически прикреплено первое антитело Аb0, настроенное на флуоресцеин изотиоцианат (FITC, флуоресцентный краситель). Чтобы этот реагент, общий для всего семейства, сделать специфическим на какой-либо вид заболевания, то есть «настроить» на поиск его характеристического антигена, делают первый «сэндвич», связывая его с конъюгатом флуоресцеин изотиоцианата – антитело на этот антиген. Антитело Ab0, обладая специфическим сродством с FITC, используется как универсальный стыковочный «замочек» для того, чтобы можно было строить и иммуно105 комплекс дальше. Иммуно-комплекс FITC конъюгирован с антителом Ab1, уже специфическим на определенный антиген (реагент R2). Проконъюгировав реагент R1 с реагентом R2, получаются частицы, «настроенные» на поиск определенного антигена. Эти частицы готовы связываться с антигеном, если он присутствует в пробе. R2 R1 O ПААм-гель C Ab1 Ab0 NH OH R Fe3O 4 C FITC NH2 O Рисунок 86. Схема получения конъюгата Затем этот конъюгат входит в контакт с реагентом R3, являющимся конъюгатом соответствующего антитела Аb2 с ферментом, который может дать цветную реакцию. R2 R1 S O ПААм-гель C NH Ab0 Ab1 OH R Fe3O4 C NH2 R3 AG E Ab2 FITC P O Рисунок 87. Схема взаимодействия конъюгата с R3 Порядок работы с полимерными частицами: 1. кювету заполняют раствором R1. 2. включив магнит, сливают избыток растворителя, т.к. все частички сразу примагничиваются к дну кюветы. 3. Вводят реактив 2. Для того, чтобы частички хорошо прореагировали, выключают магнит. В растворе образуется комплекс с реагентом 2 (получается конъюгат Аb1). Частицы снова осаждают. 4. Вводится проба (слюна, моча, кровь). После инкубации, частицы вновь осаждают и отмывают, затем выключается магнит. 5. Добавляют реактив 3 (образуется комплекс). 6. Добавляют субстрат. Регистрируется цветная реакция, автоматически записывается сигнал (с помощью принтера выводится результат: «обнаружено … в … концентрациях»). Таким образом, без наличия «умного» и управляемого полимерного рабочего тела, вся «многосэндвичевая» структура невозможна. 106 Биоаналитические методы, основанные на других физических явлениях Ферстеровский резонанс Ферстеровский резонанс (Förster resonance energy transfer, FRET) – механизм переноса энергии между двумя хромофорами (от донора к акцептору), который происходит без промежуточного испускания фотонов и является результатом диполь-дипольного взаимодействия между донором и акцептором. Этот эффект в настоящее время широко используется в различных биомедицинских исследованиях (межклеточное взаимодействие, трекинг внутрь клеток и др.). Мы кратко рассмотрим его применение для иммунодиагностики (обнаружения антигенов). Рисунок 88. Схема определения антигена методом FRET (см. текст) Две молекулы красителя (К1 и К2), имеющие разные полосы поглощения и разные полосы флуоресценции, при расположении на определенном расстоянии (R) способны передавать специфически свою энергию, так, что, облучая краситель К1, который давал бы свой флуоресцентный сигнал, будучи свободным, если он находится рядом с молекулой красителя К2, то может передать ему энергию и будет светиться краситель К2. Рабочим телом прибора является стеклянная или кварцевая пластина. Чтобы построить многослойную конструкцию (слоями на молекулярном уровне), используют принцип L-b-L (layer by layer, слой за слоем), когда на одном монослое полиэлектролита выстраивается слой противоионов или 107 другого полиэлектролита. На пластинку, за счет электростатических или химических взаимодействий (используют связи -Si-OH), наносят монослой поликатиона. На этот слой, в виде второго монослоя, садится краситель К1 (отрицательно заряженный), конъюгированный с антителами. На этих антителах, на стадии подготовки пластины, формируется монослой конъюгатов антигенов с красителем К2. Размер этих частиц позволяет достигать ферстеровское расстояние. Поэтому, если мы будем облучать систему в области К1, он будет передавать энергию на К2, и будет светиться в другой области спектра красителя К2. Если этот комплекс разрушится в присутствии свободного антигена, пришедшего из пробы, то будет получаться комплекс без красителя К2 и будет светить К1. При внесении пробы на такую пластинку при отсутствии антигена, получаем цвет одной длины волны, а если все заменяются на антиген из пробы – будет цвет другой длины волны. А при смешанных случаях, когда концентрация промежуточная, будут дополнительные цвета, в результате смешения флуоресценции от К1 и К2. Без полиэлектролита эту конструкцию не построить. Поверхностный плазмонный резонанс Поверхностный плазмонный резонанс (SPR, surface plasmon resonance) широко используется в биохимии. Образование межмолекулярных комплексов на границе раздела двух сред сопровождается изменением показателя преломления одной из них, что приводит к модуляции параметров SPR, регистрируемой детектором. Фактически, SPR-детекторы являются рефрактометрами. На основании SPR разработано множество сенсорных систем, ставших эффективными инструментами для решения практических аналитических задач. Технология SPR носит универсальный характер и позволяет регистрировать взаимодействия как низкомолекулярных объектов, так и макромолекул и их агломератов, вирусов и даже целых клеток. Это обусловило интенсивное применение метода в фундаментальных исследованиях и медицине. Рабочим телом является стеклянная призма. Если внутрь призмы падает луч, то, согласно законам классической физики, он отражается от нижней поверхности под таким же углом. Современная физика доказывает, что луч проникает в среду под нижней поверхностью призмы, а потом поворачивает и уходит (отражается). За счет поверхностных плазмонных явлений, отражение при определенном угле падения будет минимальным, и угол отражения, при котором наблюдается минимальное отражение, зависит от того, что находится 108 под нижней поверхностью стекла, покрытого нанотолщинным слоем Au (15 нм) или Ag (50 нм). А если на нижнюю часть металла наносят нанотолщинный слой полимера (в приборе фирмы «Bio Core» – это карбоксиметил-декстран (KMD)), с дополнительно введенными SН-группами. За счет SН-групп, полимер химически прикрепляется в виде монослоя «распластанных» макромолекул. В полимере имеются карбоксильные группы, которые являются якорными группами для прикрепления биологических лигандов. На эти группы прикрепляются антитела, «настроенные» на определенный тип возбудителей. Если дальше внести антиген, то он будет образовывать комплексы [-Ab····Ag]. 1 среда: стекло (n1>n2) 2 среда: вода. карбоксиметилдекстран Рисунок 89. Схема определения антигена методом поверхностного плазмонного резонанса (SPR) I отражения сигнал отражения (среда под призмой): 1 – воздух; 2 – вода; 3 – с иммобилизованными Ab; 4 – после инкубации с Ag. 1 2 3 4 угол падения (отражения) света Рисунок 90. Регистрация результата определения Ag методом SPR 109 Спектрально-фазовая интерферометрия Рабочее тело в данном методе – тонкая стеклянная пластина, являющаяся дном проточной кюветы, на которую может быть нанесен нанотолщинный сорбционный или биосорбционный слой. Луч света проходит и отражается от нижней и верхней поверхности кюветы. При этом происходит его интерференция. Если в кювету поступают и сорбируются частицы (антитела или антигены), прибор будет регистрировать в режиме реального времени изменение толщины слоя в нанотолщинном диапазоне. Это позволяет не только фиксировать наличие соответствующих биомолекул, но и изучать процессы молекулярного «узнавания» в режиме реального времени. Рисунок 91. Изучение сорбции Ag и взаимодействия Ag-Ab в режиме реального времени методом спектрально-фазовой интерферометрии 110 ПОЛИМЕРНЫЕ ЧАСТИЦЫ В БИОЛОГИИ И МЕДИЦИНЕ Дисперсии полимерных частиц (ДПЧ) представляют собой коллоидные системы, в которых полимер диспергирован в жидкой дисперсионной среде в виде стабильных индивидуальных частиц. Такие системы широко используются для медико-биологических и биотехнологических исследований. Применение ДПЧ в этих исследованиях связано, прежде всего, с такими свойствами, как высокоразвитая поверхность, возможность получения частиц в широком диапазоне диаметров (5 нм - 1 мм) с узким распределением по размерам, различная морфология, функциональность, возможность присоединения биологически активных молекул. Список рекомендованной литературы к разделу: [13], [17], [19], [20]. Полимерные дисперсии (латексы) размером 0.1-10 мкм Выше были рассмотрены методы биоанализа, в которых сочетались полимерные носители с инструментальными методами детекции. Использование в качестве матриц полимерных дисперсий позволяет создать методики анализа (диагностики), отличающиеся простотой и доступностью, и часто не требующих сложных инструментальных методов детекции. Эти методы основаны на агломерации полимерных частиц. Прототипом такого рода подходов служила давно известная в медицине реакция агглютинации эритроцитов для определения групп крови. Существует 4 основных группы крови, отличающиеся по наличию двух видов антигенов на эритроцитах (A и B) и двух видов антител в сыворотке (α и β): Таблица 11. Характеристики основных групп крови группа крови Ag совместимость плазмы. донор может быть: Ab 1 (0) α, β 0 2 (A) β 0 или A 3 (B) α 0 или B 4 (AB) - любой тип крови При переливании крови следуют правилам совместимости (см. табл. 11). В противных случаях, наблюдается агглютинация, вследствие связывания эритроцитов соответствующими антителами. 111 Можно заменить эритроциты полимерными частицами. На поверхности частиц иммобилизованы биологические лиганды (антитела или антигены). Тогда, в присутствии соответствующих антигенов или антител, происходит агглютинация частиц, которую можно зафиксировать визуально или инструментально. Рисунок 92. Схема латекс-агглютинации 1 способ детекции (самый простой, но не самый надежный, поскольку имеет невысокую чувствительность). На темное стекло наносится капля исследуемой биологической жидкости и капля дисперсии реагента. Под микроскопом наблюдают картину после смешения: при наличии антигена (антитела) образуются творожистые сгустки агглютината, при его отсутствии – равномерно опалесцирующее пятно. 2 способ: пассивная латексная агломерация (происходит под действием силы тяжести, оседание: 1-3 ч.). Проводят на планшетах с U-образным углублением. Рисунок 93. Результаты анализа методом пассивной латекс-агглютинации в кювете с U-образным дном 112 В объеме жидкости, в случае отрицательной реакции (отсутствие образования агглютинатов), частицы скатываются на дно в центре кюветы и образуют компактный осадок – реакция «пуговица»; в случае положительной реакции – осадок равномерно распределяется в виде большого пятна по всей поверхности лунки («зонтик»). Путем титрования при разбавлении пробы можно определить количество антигенов (антител). Материал частиц: полистирол, полиакрилаты, полиакролеин, размер частиц – 0.5-2 мкм. Для удобства визуальной регистрации, в частицы вводят краситель или флуорофор. Метод удобен и широко используется в медицине. 3 способ: инструментальный метод. Агломерация регистрируется по интенсивности светорассеяния соответствующими нефелометрами (размер частиц < 0.8 мкм, для предотвращения оседания в ходе измерений). 4 способ: индивидуальные тест-пластинки («стрип-тесты»). Тестпластина представляет собой плоский «пенальчик», открытый конец которого предназначен для ввода жидкой пробы, и имеются два прозрачных «окна»: для проверки исправности тест-системы и для выявления положительной реакции. Пенал заполнен пористым полимерным материалом, способным путем смачивания втягивать в себя биологические жидкости (слюну, мочу): Рисунок 94. Схема работы иммунохроматографического «стрип-теста» В зоне I: физически захваченные конъюгаты полимерных окрашенных частиц с иммобилизованными антителами к Ag. При наличии Ag, часть из них связывает его, избыток свободных и связанные частицы движутся в зону II, в которой химически иммобилизованы антитела к Ab1. Они связывают свободные частицы, в окошке появляется окраска, – тест-система работает. Частицы продолжают движение в зону III, где химически иммобилизованы антитела Ab3 к Ag. Они образуют иммобилизованный комплекс, и появляется окраска во втором окошке – положительная реакция. При отсутствии Ag цвет не появляется. 113 5 способ: «Люминекс-система» (разработанная с использованием принципов проточного разделения клеток – проточного цитофлуориметра). «Рабочим телом» являются полимерные (полистирольные) сферы диаметром 56 мкм. Их наполняют разным количеством флуоресцентных красителей двух видов (F1 и F2), что позволяет их идентифицировать. В системе «Luminex» – это 100 видов частиц. На поверхность частиц химически иммобилизованы антитела на определенный соответствующий возбудитель (антиген). После инкубации с биологической пробой (слюна, кровь, лизаты клеток и др.), частицы, связавшие антиген, метят другим флуорофором (F3). Рисунок 95. Иммуно-анализ по принципу проточной цитофлуориметрии Считывание результатов проводится в проточном флуориметре, позволяющего идентифицировать флуоресценцию каждой отдельной частицы, проходящей через узкий капилляр (благодаря своему размеру, частицы выстраиваются в линию). Данный метод используется в крупных госпиталях. Полимерные частицы диаметром 10 нм Частицы размером ~ 10 нм заметно меньше клеток (5-10 мкм) и могут быть использованы для маркирования клеток (диагностика) и их сепарации (медицина, биотехнология). Для этого, полимерные частицы следует наполнить флуорофором или магнетитом, а на поверхности частиц химически иммобилизовать биолиганды (антитела) к рецепторам на поверхности клеткимишени. Частицы «узнают» рецепторы, прикрепляются к ним, и тем самым «метят» данные клетки. Меченые флуорофорами клетки можно идентифицировать под микроскопом или разделить на флуоресцентном сортере 114 клеток – проточном цитофлуориметре. Клетки, меченые магнитными частицами, могут быть выделены с помощью магнитного сепаратора. Такую систему для гемосорбции разработала компания Qiagen. В кровь пациента впрыскивают дисперсию декстрановых частиц, наполненных наночастицами магнетита (Fe3O4), с иммобилизованными антителами против рецепторов на раковых клетках в кровотоке. Затем кровь пациента пропускают через магнитный сепаратор, задерживающий только «намагниченные» клетки, а очищенную кровь возвращают в кровоток. Сепаратор представляет собой колонку, набитую тонкой стальной проволокой. После окончания процедуры, частицы можно смыть с сепаратора, сняв магнитное поле. Рисунок 96. Схема магнитного сепаратора клеток (см. текст) Крупные полимерные частицы (250-300 мкм) Частицы такого размера выполняют роль носителей для культивирования клеток в ферменторах различного объема. Первый тип частиц – это носители для культивирования поверхностнозависимых (животных) клеток. Этот важный вид клеток – продуцентов ценных биопрепаратов (например, рекомбинантных гликопротеинов), способен пролиферировать и продуцировать целевой продукт только после прикрепления и «распластывания» на поверхности носителя с последующим делением и заполнением всей поверхности частицы. Поверхность должна быть биосовместимой, гладкой и с малой кривизной, т.е. почти плоской для клеток размером 5-10 мкм, но, в то же время, максимально большой. Последнему требованию отвечают полимерные частицы размером 250-300 мкм. Такие частицы должны «висеть» в водной культуральной жидкости, т.е. их плотность 115 должна быть близкой к 1. Поверхность частиц должна быть или нейтральной, или положительно заряженной. Первым видом таких носителей являются гидрогелевые сферические частицы на основе декстрана, целлюлозы, желатины, получаемые в дисперсиях «вода в масле», путем гелеобразования (химической сшивки) в каплях водного раствора полимеров, диспергированных в углеводородах. Возможна дополнительная химическая модификация поверхности. Так, поверхность частиц в некоторых марках носителей на основе полиуглеводов дополнительно модифицируют введением групп: H5C2 C2H5 HO O CH2 N CH2 или HO C2H5 O CH2 + CH2 CH2 Cl N CH2 Cl C H 2 5 C2H5 + N H C2H5 улучшающих «прикрепление» клеток к носителю. Клетки можно культивировать и внутри гидрогелей – это капсулирование внутри гидрогелевых частиц. Такая технология пригодна для культивирования некоторых видов животных клеток, бактериальных и раковых клеток. Важно, чтобы эти клетки могли делиться во внутреннем пространстве частиц, а сами частицы сохраняли бы механическую устойчивость и не разрушались в биореакторе во время ферментации. Кроме того, возникает проблема об извлечении и очистке целевых продуктов ферментации. Как получить продукт и вернуть выращенные живые клетки после ферментации? Здесь возможно несколько технологических подходов. 1) Выделять продукт из культуральной жидкости. 2) Обеспечить мягкое разрушение гидрогеля, чтобы не уничтожить живые клетки и выделить продукт. Для решения второй задачи возможно использование smart-полимеров. Для получения частиц гидрогеля с иммобилизованными в объеме клетками, можно использовать смесь альгината и ПВКЛ, так, что непрерывной фазой является альгинатный гель, а ПВКЛ-гель образует дискретные области в этой фазе. После чего, низкомолекулярный ПВКЛ можно удалить, меняя температуру, вследствие чего появятся полости («дырки»), в которых клетки будут делиться. Так получают крупнопористые капсулы для культивирования. 116 Рисунок 97. Культивирование клеток в крупнопористом гидрогеле, полученном с помощью smart-полимера С использованием smart-полимеров, можно получать и полые капсулы. Для этой цели, на первом этапе получают Ca2+-альгинатные гидрогелевые гранулы с иммобилизованными внутри клетками (например, опухолевыми). На этих гранулах, содержащих поверхностные –COO- группы, методом послойного нанесения (L-b-L) на основе полиэлектролитных комплексов создают полислойную мембрану: [полилизин (хитозан) → полисульфоакриламид (альганат) → полилизин (хитозан) и т.д.]. После получения достаточно прочной оболочки (10-20 слоев), внутреннее гидрогелевое ядро частицы разрушают, связывая Ca2+ комплексонами. Таким образом, внутри полой оболочки оказываются клетки и вода. Деление клеток приводит к заполнению всего внутреннего объема сферической колонией клеток (сфероидом). При необходимости, оболочку можно разрушить, изменив pH среды или ионную силу. Кроме гидрогелей, для получения матриц используют синтетические полимеры. Гидрогели необходимо хранить в определенных условиях в набухшем состоянии, а синтетические полимерные носители можно хранить в виде порошка и легко стерилизовать. Одним из таких материалов является полистирол, имеющий плотность 1.1 (плотность велика). Родственный полимер – поливинилтолуол, имеет плотность 0.9, поэтому, в качестве материала для частиц, используют сополимер, полученный из смеси этих мономеров, которые дают сшитый полимер с плотностью, близкой к 1.0. 117 ПРОБЛЕМЫ МЕДИЦИНСКОГО ИСПОЛЬЗОВАНИЯ ПОЛИМЕРОВ Существует, как ранее обсуждалось, два основных аспекта для современной медицинской науки и практики: диагностика, которая практически совпадает с теми биоаналитическими проблемами и методами их решения, которые были рассмотрены ранее; терапия, которая делится на 2 подраздела: 1) Лекарственная терапия. Осуществляется с помощью различного вида лекарственных соединений, называемых в фармакологии активными фармацевтическими субстанциями (АФС), или биологически активными субстанциями (БАС). Это, как правило, низкомолекулярные соединения, которые либо выделены из природных источников, либо направленно синтезированы в химических лабораториях, и которые, как показывают испытания, оказывают положительное терапевтическое воздействие на пациентов. Сюда же можно отнести и материалы, которые используются для лечения различных травматических и нетравматических повреждений – имплантаты. Когда диагностика сопровождается терапевтическими действиями, то такая диагностика называется тераностикой – важным и перспективным направлением. Начнем с обсуждения терапевтического действия различных низкомолекулярных фармакологически активных субстанций, которые действуют на определенные возбудители и патологии. Эти субстанции начинают действовать только тогда, когда попадают в кровоток, разносятся по всему организму и попадают в так называемые целевые (таргетные) участки, являющиеся соответствующими очагами заболевания. При введении низкомолекулярного АФС путем инъекции, происходит быстрое наращивание концентрации (очень часто появляется эффект сверх необходимых доз, overdose, что оказывает токсическое воздействие), а в точке τ1 соответствующие низкомолекулярные АФС быстро выводятся из организма. Врачебная медицинская практика требует, чтобы ситуация выглядела, как показано на рисунке «б». Также может быть зависимость «в»: быстрое нарастание, а потом спад; и наоборот (зависимость «г»). И, наконец, самое «умное»: когда лекарственное средство находится в депонированном виде и, по 118 мере медицинской необходимости, выделяется в течение заданного времени: зависимость «д». а в б г д τ1 τ2 Рисунок 98. Фармакокинетические зависимости концентрации АФС в кровотоке (см. текст) Поскольку речь идет о низкомолекулярных АФС, то все эти оптимальные зависимости (от «б» до «д») должны обеспечиваться полимерами. Почему именно полимеры? И как ведет себя субстанция в организме и как выводится из организма? Как депонируется (сохраняется в организме)? Хорошо это или плохо? Рассмотрим схему. АФС можно ввести в кровоток перорально или с помощью инъекции. Наиболее прямой способ – инъекционный. Также существует метод введения АФС через кожный покров – трансдермальный способ, обычно используются очень проницаемые участки кожи (носоглотка, рот, мочевой пузырь, легкие). Как при пероральном, так и при трансдермальном введении, препарат обычно находится в иммобилизованном в полимерную матрицу виде (капсуле или гидрогеле) для защиты от биодеградации (см. схему) и контролируемого выделения. 119 Рисунок 99. Поведение АФС в кровотоке (см. текст) Из кровотока АФС могут попасть в центральную нервную систему (ЦНС), в частности, в мозг, но этому препятствует гематоэнцефалический барьер (ГЭБ). Некоторые низкомолекулярные вещества (этиловый спирт, некоторые АФС) легко проникают, в отличие от полимеров. Таким образом, представляется возможность ограничить проникновение введенного одним из этих способов в кровь лекарства в ЦНС, если его конъюгировать с полимером. Как ведут себя АФС в кровотоке. АФС должны попадать в ткани, органы (мишени), или же где-то депонироваться (застревать, накапливаться). Но, вопервых, органов очень много, один крайний случай – либо все будет равномерно «размазываться», если это какой-то цитотоксический препарат, направленный на уничтожение опухоли, то он будет также «успешно» уничтожать все остальные клетки, то есть оказывать сильнейший токсический эффект на весь организм. Во-вторых, есть такие органы как почки и печень (очищают кровь от вредных и ненужных веществ). Почки, являясь фильтрующим органом, содержат в себе биомембраны, избирательно пропуская вещества, в зависимости от химической природы и молекулярной массы. Через эти 120 мембраны выводится большинство низкомолекулярных соединений (НМС) (через мочу). Но, поскольку это мембраны, то ВМС или конъюгаты НМС с полимерами, в зависимости от химической природы и молекулярной массы, линейности или разветвленности, компактной глобулярной структуры или рыхлого клубка, выводятся по-разному. Полимеры выше определенной молекулярной массы не выводятся через почки, тем самым увеличивая время пребывания АФС в кровотоке. Полимеры могут делать более вероятным попадание АФС в мишень, то есть обеспечивать целевую доставку лекарства в орган-мишень («magic bullet»). Печень – это химическая лаборатория ЖКТ, разрушающая не выводимые через почки объекты, занимается борьбой с токсинами и другими вредными частицами. Большую роль тут имеют фагоциты, которые, путем фагоцитоза, поглощают нежелательные вещества по двум механизмам: пассивной диффузией через клеточную мембрану, тогда низкомолекулярные соединения имеют преимущество, либо собственно фагоцитозом (преимущество имеют высокомолекулярные вещества, которые как бы «заглатывают» именно их, тем самым, внутри клетки происходит борьба за уничтожение нежелательных объектов). Получается, что с помощью полимеров можно достигать целенаправленного перемещения различных химически активных веществ не только в межклеточном пространстве (в кровотоке), но и в клетке-мишени, либо на клеточной мембране с рецепторами, либо проникновением внутрь цитоплазмы (где находится множество разных органелл) или целенаправленно в ядро клетки. Таким образом, заключаем, что при лекарственной терапии с использованием низкомолекулярных АФС, можно добиваться ряда позитивных фармакокинетических эффектов, комбинируя АФС с полимерами, и это может быть связано со всеми особенностями взаимодействия введенных соединений с различными системами организма. Капсулированные лекарства Каким образом достигаются эффекты контролируемого выделения АФС? Первый и наиболее распространенный эффект, достигающийся благодаря полимерам, – это капсулирование, когда известную АФС используют не в виде порошка (что было ранее), не в виде растворов, а в виде капсулы, то есть конструкции, имеющей оболочку с внутри находящимся АФС. Оболочка решает все те задачи, которые перечислены выше (контролированное 121 выделение, защита АФС от иммунной реакции организма, от ферментативной или рН-зависимой деградации). Основные эффекты можно разделить на следующие группы: 1. Контролированное разрушение оболочки капсулы или ее набухание. Исходная оболочка служит непроницаемым барьером для выхода АФС, но, по мере пребывания в ЖКТ или в контакте с организмом, скорость диффузии АФС через оболочку увеличивается (ситуация «в»). Во-первых, вследствие набухания, т.е. при превращении стеклообразной пленки соответствующего полимера в набухшую гидрогелевую оболочку, которая, соответствующим образом, становится более диффузионно проницаемой. Такого рода материалы широко используются в медицине. Также оболочка может разрушаться. Например, широко используемая желатиновая (белковая) оболочка под действием протеолитических ферментов в желудке будет разрушаться. 2. рН-эффекты. Есть полимеры, избирательно реагирующие на рН в желудке или кишечном тракте. Например, оболочка из полиоснования (хитозана, некоторых полипептидов) будет легко, при действии рН<7 (кислотная среда), набухать и растворяться именно в желудке. Если использовать оболочки с карбоксильными группами, то они, наоборот, будут набухать и сильнее растворяться в кишечнике (рН>7, щелочная среда) и будут проходить через желудок без изменения целостности оболочки. Кроме гомополимерных систем, обладающих свойством избирательного растворения или сильного набухания в щелочных средах, возможно использование поликомплексов. В СССР была разработана система на основе полиакриловой кислоты и полиэтиленгликоля. CH2 H3C CH C HO CH2 CH2 HO O CH3 HC HC C C O HO H3C CH2 CH2 CH2 O C C C HO CH3 HC HC CH O O HO HO O - OH + CH2 H3C O CH2 CH2 CH2 CH2 O O CH2 H2C CH3 CH3 CH2 O CH2 CH2 CH2 O O CH2 CH3 При кислых и нейтральных рН, за счет кооперативных водородных связей, образуется нерастворимый полиэлектролитный полимер-полимерный комплекс, который в кислых средах остается в виде нерастворимого твердого 122 полимера, но, при изменении рН, происходит ионизация карбоксильных групп. Этот комплекс быстро разрушается, что приводит к изменению проницаемости и к выделению АФС в ЖКТ. Существуют методы и более избирательного биоразрушения полимерных оболочек: оказалось, что, если в макромолекулах есть азогруппировки, то они способны к разрушению с помощью микроорганизмов, находящихся в прямой кишке. Оболочки такого типа будут проходить весь ЖКТ и разрушаться в прямой кишке. 3. Осмотический насос. Капсулу делают из водонерастворимого полимера типа триацетатцеллюлозы. На стадии изготовления, в оболочке делают несколько калиброванных отверстий, внутри капсулы находится АФС, смешанный с хлоридом натрия. Эта полупроницаемая оболочка, не теряя механической прочности, путем диффузии пропускает воду из внешней среды внутрь капсулы, куда она стремится под действием осмотических сил, а именно – из-за концентрированного раствора хлорида натрия (т.к. снаружи плазма крови), соответственно, внутри капсулы возникает осмотическое давление, в результате, внутренний раствор, содержащий АФС и хлорид натрия, будет выбрасываться из капсулы во внешнюю среду. Через указанные отверстия, на протяжении длительного времени, пока практически не исчерпается внутренний запас NaCl капсулы, с постоянной скоростью будут выделяться соответствующие субстанции (ситуация «б»). Рисунок 100. Схема действия «осмотического насоса» Список рекомендованной литературы к разделу: [1], [14], [17], [18], [19], [20]. 123 Стимул-зависимые гели (системы с обратной связью) Использование биологических взаимодействий стимул-зависимых гелей (системы с обратной связью). для формирования Подходы здесь следующие: 1. В настоящее время этот вопрос наиболее проработан на примере систем с контролируемым выделением инсулина для купирования приступов диабета: по мере повышения в крови концентрации глюкозы, должен выбрасываться инсулин. Если концентрация глюкозы мала, то инсулин не выбрасывается. Должна существовать некая обратная связь между концентрацией глюкозы и того медицинского изделия, которое осуществляет процесс контролируемого выделения инсулина по «сигналу» организма. Первый подход основан на системе, когда используется контейнер (капсула), внутри которого содержится инсулин, глюкозооксидаза (ГО) и полимер, представляющий собой гидрогель с NH2-группами на поверхности пор. Глюкозооксидаза, при наличии глюкозы, превращает ее в глюконовую кислоту, при этом выделяется перекись водорода. Глюконовая кислота протонирует NH2-группы, превращая их в (-NH3)+-группы. Степень набухания мембран возрастает и происходит выделение инсулина, который был иммобилизован внутри контейнера. ГО -NH 2 инсулин -NH 2 -NH 2 CH3 + O глюкоза ГО CH2 HO C CH 4 + H 2 O2 OH HO H + N H H 2. Второй подход основан на том, что в мембранах, окружающих капсулу, есть привитые к поверхности макромолекулы, содержащие ионизованные при данном рН карбоксильные группы и иммобилизованную глюкозооксидазу (ГО). Тогда, в присутствии глюкозы, образуется глюконовая кислота, протонируются карбоксильные группы, и при этом, из развернутых конформаций, закрывающих поры, они принимают свернутое состояние, эффективный диаметр пор увеличивается, а инсулин выходит наружу. 124 Рисунок 101. Схема контролируемого концентрацией глюкозы выделения инсулина (см. текст) 3. В данном примере, в присутствии глюкозы, меняется степень набухания геля, образованного за счет молекулярного «узнавания» биомолекул. Гель в виде сополимеров акриламида, или винилпирролидона с N-замещенным акриламидом, с остатком глюкозы. Для того, чтобы этот водорастворимый полимер превратился в гидрогель, надо между собой связать сетку из групп глюкозных остатков. Это делается в виде белка растительного происхождения – конканавалина A. При его смешении с раствором сополимера образуется гидрогель, в который несложно на данной стадии иммобилизовать инсулин. Если этот гидрогель ввести в контакт с раствором глюкозы, то, при определенных пороговых концентрациях, это взаимодействие начинает нарушаться взаимодействиями непосредственно с глюкозой, и густота сшивки резко падает и выделяется инсулин (см. рис. 23). 4. Известно, что остатки борной кислоты реагируют с цисгликольными соединениями (например, с ПВС), образуя комплекс, представленный на схеме ниже (см. также рис. 20). Если смешать ПВС с приведенным на схеме бор-содержащим полимером, то образуется гидрогель, в который можно иммобилизовать инсулин. В присутствии глюкозы, комплексы -B-(OH)2 c ПВС, играющие роль сшивок, разрушаются, и происходит выделение инсулина. 125 H3C OH H2B B H3C + H HO ГЛ OH - O B H2B HO O HO H3C H3C H3C CH2 CH2 HC CH n C HN ПВС + N O CH3 m O OH B OH Методы и технология капсулирования Выше были рассмотрены возможности регулирования выделения и доставки ФАС за счет использования капсулированных препаратов. Кратко обсудим методы их получения. Капсулирование – технология, которая используется не только в медицине, но и в других областях современной технологии, в частности, в сельском хозяйстве (капсулированные удобрения, пестициды), а также для капсулирования жидкого топлива. Химический метод Путем химической реакции необходимо образовать на поверхности капли или кусочка твердого тела некую оболочку. То есть, необходимо закапсулировать лекарственное соединение в соответствующий полимер. Самым простым и понятным способом должна быть реакция полимеризации или поликонденсации на поверхности таких частиц с образованием полимерной оболочки из соответствующих мономеров или олигомеров. Такая задача решается изнутри капель «вода в масле» или «масло в воде», с образованием полимерных оболочек, где надо или из внутренних ресурсов, или из внешней среды поставлять мономеры, осуществлять реакцию полимеризации или поликонденсации, добиваться нужной толщины, стойкости и однородности этого покрытия. Из полимеризационных методов используют радикальную полимеризацию. В зависимости от того, какая должна быть оболочка (гидрофобная или гидрофильная), выбирают мономер(ы). Если гидрофобная – 126 стирол, различные акрилаты, метакрилаты, дивинилбензол. Необходимо организовать адсорбцию мономера и локализацию положительно образующегося полимерного слоя на поверхности. Если это водный раствор (водная капля в масле), то вводятся липидоподобные ПАВ, с большими органическими радикалами, затем вводится мономер (например, акриламид) и, путем полимеризации, все это фиксируется. Если это вода, то обычно капсулируют ферменты или лекарства белковой природы (из-за низких температур денатурации белков, реакции проводят в мягких условиях). Иногда отверждение капель осуществляют тем, что водорастворимый мономер вводится в эту каплю и полимеризуется. Тогда продуктом реакции является капля микрогеля с солюбилизованными веществами. Более «элегантный» метод, который обеспечивает действительно поверхностное образование пленки, связан с тем, что в качестве мономера используются цианоакрилаты. H2C R C N C O C O Если ввести такой мономер в масляную фазу (например, в раствор цианоакрилата в хлороформе), то на границе вода-капля будет происходить инициированная водой полимеризация с образованием полимерной пленки полицианоакрилата. Теперь рассмотрим поликонденсацию. Тут также используется принцип проведения реакций на границе раздела фаз. Больше всего для этого подходит поликонденсация на границе раздела фаз, когда используются маслорастворимый один компонент и водорастворимый другой компонент. Для целого ряда дисперсий как «вода-масло», так и «масло в воде», были использованы в качестве маслорастворимых соединений диизоцианаты или хлорангидриды, а в качестве водной фазы – различные ди- и полиамины (полиэтиленимин, содержащий и первичные, и вторичные, и третичные группы) с образованием соответствующих полимеров. Эта технология используется для капсулирования широкого круга соединений: витаминов, лекарств, а также различных пестицидов, то есть как в медицине, так и в сельском хозяйстве. 127 Большее значение и распространение получили физические методы капсулирования. Эти методы, в силу своей высокой производительности и относительной дешевизны, являются преобладающими в промышленном выпуске капсулированных продуктов различного назначения. Распылительная сушка Простейшей технологией физического капсулирования является распылительная сушка. По этой технологии, вещество, подлежащее капсулированию (фермент, витамин, антибиотик, пищевая добавка и др.), растворяется (диспергируется) в растворе полимера-пленкообразователя в соответствующем летучем растворителе (вода, органические растворители). В качестве полимера-пленкообразователя для капсулирования АФС используют ПВС, сополимеры акриловой кислоты с малеиновым ангидридом, ПЭГ, желатин, казеин, альбумин, крахмал, эфиры целлюлозы и др. Эта смесь впрыскивается через распылительные устройства (форсунки, ультразвуковые распылители) в виде мелких капель в камеру с T ~ 110-120 ºС, где растворитель быстро испаряется и образуется взвесь твердых полимерных частиц с размерами от 1 до 100 мкм, в которых капсулировано АФС. Рисунок 102. Схема капсулирования методом распылительной сушки Недостатками метода являются: Неоднородность частиц по размеру и содержанию АФС. Невозможность капсулирования летучих и термолабильных продуктов. Малое содержание АФС в гранулах (30-50 %). 128 Микрокапсулирование в псевдокипящем слое 1) Разновидностью предыдущего метода можно считать микрокапсулирование в псевдокипящем слое. В этом случае, частицы капсулируемого вещества поддерживают во взвешенном состоянии потоком воздуха сквозь решетку-основание реактора, в который подается распыленный на мелкие капли раствор полимера-пленкообразователя, который обволакивает частицы. Рисунок 103. Схема капсулирования в псевдокипящем слое Метод реализуется практически только для твердых веществ. Испарение летучего растворителя в эмульсиях 2) Испарение летучего растворителя в эмульсиях. Это «щадящий» метод, который можно использовать для капсулирования биопрепаратов (ферментов, АФС и др.). Этапы: а) сначала готовится раствор или дисперсия целевого продукта в летучем растворителе, в котором, в свою очередь, растворен пленкообразующий полимер (фаза 1). б) затем получают эмульсию фазы 1 в нелетучем растворителе (в фазе 2). 129 в) испарение летучего растворителя из капель фазы 1 с получением частиц капсулированного целевого продукта. Рисунок 104. Схема микрокапсулирования методом испарения летучего растворителя в эмульсии Растворитель (органический) из капель фазы 1 может удаляться в фазу 2 (воду) путем диффузии, при этом полимер осаждается и капсулирует АФС. Таким путем можно получать нано- или микроносители для АФС. (Со)экструзия (Со)экструзия. В этом методе соэкструдируются две жидкие фазы: а) расплав (раствор) целевого АФС и б) расплав (раствор) полимерапленкообразователя. Рисунок 105. Схема микрокапсулирования методом соэкструзии На выходе из фильеры экструдера необходимо обеспечить отверждение капель (температурное или химическое воздействие). 130 В настоящее время этот подход приобретает большое значение в связи с развитием микрофлюидных технологий. 3) Нанесение нано-толщинных оболочек с помощью полиэлектролитных комплексов (layer by layer, L-b-L, слой за слоем). Этот метод применяется для получения структур «ядро-оболочка» на микро- и наночастицах путем последовательного осаждения противоположно заряженных полиэлектролитов на заряженной поверхности. Рисунок 106. Нанесение нано-толщинных оболочек с помощью полиэлектролитных комплексов (L-b-L) Таким путем можно получать многослойные оболочки с заданной проницаемостью и прочностью. Список рекомендованной литературы к разделу: [6], [18], [23]. 131 ПОВЕДЕНИЕ ПОЛИМЕРОВ И МОЛЕКУЛЯРНЫХ КОНЪЮГАТОВ НА ОСНОВЕ ПОЛИМЕРОВ И АФС В ОРГАНИЗМЕ Как уже отмечалось выше, низкомолекулярные соединения (НМС) быстро выводятся из организма путем фильтрации через почки, а высокомолекулярные соединения (ВМС) или молекулярные конъюгаты АФС с полимерами – нет. Задачи, которые необходимо решить при помощи полимеров: 1. Увеличение времени пребывания в кровотоке. ВМС нельзя быстро отфильтровать через почки, они подвергаются фагоцитозу – поглощению клетками-фагоцитами в печени. Могут накапливаться в органе-мишени. 2. Стабилизация против биодеградации – разрушения полимера в организме с помощью ферментов. 3. Снижение антигенности. Посторонние биологически активные молекулы могут вызывать иммунную реакцию – гуморальный иммунный ответ (антитела) или клеточный (клетки: Т-лимфорциты, Б-лимфоциты, Т-киллеры и т.д.). Нейтральные полимеры могут уменьшать антигенность («steath»системы). 4. Адресность доставки. Вещество должно попасть в определенную пораженную область, а не оседать в других органах. Для решения этой проблемы конструируются «правильные» полимерные конъюгаты («magic bullet»), обеспечивающие не только увеличение пребывания АФС в кровотоке, но и попадание препарата именно в нужную точку. Например, крупные частицы, которые концентрируются в опухоли из-за того, что там более широкие сосуды и активное деление клеток, где частицы и застревают – эффект повышенной проницаемости и задержки (enhanced permeability and retention effect, EPR-эффект). Однако, здесь возникает проблема доставки АФС из кровеносного сосуда в нужную клетку сквозь стенку кровеносного сосуда. Кратко обсудим вопрос о транспорте различных веществ внутрь клетки сквозь клеточную мембрану. Клеточная мембрана построена из липидного бислоя толщиной 25-30 ангстрем. В мембрану встроены функциональные элементы – трансмембранные клеточные рецепторы, ионные каналы и пр. Обычно белки, внедренные в мембрану, имеют цитоплазматический, трансмембранные и экстрацеллюлярный фрагменты. Последними могут быть гликопротеины, если у белков есть углеводные ветви (в большом количестве 132 имеются у животных клеток). Внутри клетки – ядро и органеллы (митохондрии, рибосомы, лизосомы и пр.). Если посторонняя частица с АФС достаточно маленькая, она может пройти в клетку путем диффузии. Крупные частицы не могут диффундировать сквозь мембрану и попадают внутрь клеток по механизму эндоцитоза. Если на частице есть адресно-активный лиганд, то он «прилипает» к соответствующему клеточному рецептору, затем клеточная мембрана прогибается, замыкается и таким образом захватывает частицу. Получается фагосома или эндосома, которая оказывается в цитоплазме и может либо дальше проникать в ядро, либо разрушаться при взаимодействии с лизосомой с последующим выходом АФС в цитоплазму. В случае опухолевых клеток, проникший в цитоплазму и/или ядро препарат, должен вызывать токсическое поражение, поэтому он должен доставляться адресно. Рисунок 107. Схема эндоцитоза АФС в клетку 133 ПОЛИМЕРЫ С СОБСТВЕННОЙ ФИЗИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ Краткое рассмотрение некоторых аспектов действия полимерных форм лекарственных соединений начнем с обсуждения собственной физиологической активности полимеров. Нейтральные гидрофильные полимеры Нейтральные гидрофильные полимеры. Такие полимеры растворимы в воде, не имеют ионогенных групп. Их растворы используют в качестве заменителей плазмы крови и самой крови. Растворы должны обладать следующими базовыми свойствами: нетоксичность; обеспечение вязкостных и осмотических свойств крови, а в идеале - и более «биологических» свойств крови, таких как перенос кислорода, вывод углекислого газа и токсинов и др. Полимер должен выводиться из организма при естественном восстановлении крови (ангиогенезе) за 1-2 суток. Для этой цели используют природные полимеры: декстран («Полиглюкан», ММ = 60 000; «Макродекс» ММ = 35 000) и другие полиуглеводы. Существуют препараты на основе крахмала, но, поскольку природный крахмал быстро выводится из организма, на гидроксильные группы крахмала прививают моно- и диэтиленгликолевые фрагменты, увеличивая время вывода крахмала из организма. Используются также и синтетические полимеры: поливиниловый спирт (ПВС, «Полидез») и поливинилпирролидон (ПВП, «Гемодез»). Поскольку их углерод-углеродные цепи не разрушаются в организме, требуется снижение молекулярной массы этих полимеров до 10 00012 000 Да. Эти полимеры способны образовывать комплексы с рядом органических и неорганических веществ, и могут выступать в качестве детоксикаторов. Данные свойства позволяют получать водные препараты с йодом менее раздражающего действия, чем водно-спиртовые. Комплексы йода с ПВС («Йодинол»), крахмалом («Амилойодин»), с ПВП («Йодопирон») широко применяются в медицине. Поликатионы Поликатионы. Поликатионы всегда биологически активны в связи с активным воздействием на клеточные мембраны. Эти полимеры обладают антигепаринным действием. Гепарин – полиуглевод с сульфогруппами, антикоагулянт, вводимый перед хирургическими операциями. А после 134 операции для его нейтрализации используют поликатионы. Для демонстрации более специфической биологической активности поликатионов, удобно рассмотреть полиионены, в которых можно менять расстояние между заряженными группами при сохранении общей структуры макромолекул. Эти полимеры получают реакцией алкилирования по Меншуткину: CH3 H3C Br CH2 Br m + H3C CH3 CH3 N CH2 H3C N n CH3 + N CH2 m - Br + N CH2 n CH3 Cl - NH2 CH3 Рисунок 108. Схема алкилирования по Меншуткину Биологическая активность ионенов существенно зависит от расстояния между атомами азота (от величин m и n). Некоторые полиионены обладают бактерицидными свойствами и используются для дезинфекции. Нетоксичными и антигепаринными свойствами обладают ионены с n и m, равными «6 и 6», «3 и 6», «6 и 10», соответственно. Однако, ионен с n и m, равными «10 и 10», очень токсичен, вызывает паралич нервных тканей. По своему действию напоминает знаменитый яд – кураре. Это связано с тем, что на мембранах находятся отрицательно заряженные рецепторы на определенных расстояниях, а молекула ионена с n и m «10 и 10» закрывает их. Препарат с n и m «3 и 6» («Полибрен») применяется в медицинской практике как нейтрализатор гепарина. Недостатком метода получения полиионенов является широкое молекулярно-массовое распределение (ММР), т.к. сложно получить продукты с узким ММР. Однако, были разработаны способы получения поликатионов с узким ММР, на базе которых были созданы важные лекарственные препараты. Причем оказалось, что биологическая активность проявляется выше определенной молекулярной массы. Такого рода полимеры получают путем раскрытия азотсодержащих циклов (конидина и триэтилендиамина) катионной полимеризацией, идущей по механизму живых цепей (см. стр. 24). Чтобы получить водорастворимые поликатионы, их нужно проалкилировать. Для понижения токсичности используют бетаиновые группы или окиси азота. 135 H3C CH2 N CH2 N CH3 n - X H3C CH2 N + N CH2 H3C CH3 n CH2 N N C2H5 CH2-COO H3C + CH2 + N CH2 N CH2 CH3 n O - CH3 n L Рисунок 109. Производные политриэтилендиамина Такими методами, комбинируя заместители у атомов азота и длину цепи полимера, получают уже не токсичные, а обладающие иммуностимулирующими свойствами соединения. Для большей избирательности против вирусов и бактерий, в молекулу можно дополнительно ввести биолиганд, обладающий специфическим сродством к рецепторным группам на поверхности вируса или бактерии. Разработанный на этих принципах препарат «Полиоксидоний» является противовирусным иммуностимулирующим аптечным лекарством. Из других биологически активных поликатионов, отметим полигексаметиленгуанидин (ПГМГ) – поликатион, получивший распространение в ветеринарии и сельском хозяйстве как дешевое нетоксичное бактерицидное и противогрибковое средство. CH2 H3C CH2 CH2 CH2 CH2 NH CH2 NH C HCl HN NH C n CH3 NH Близкие по свойствам к поликатионам – поли-N-оксиды полиаминов, оказались эффективными лекарствами против тяжелого профессионального легочного заболевания шахтеров – силикоза, который вызывается оседающей в легких силикатной пылью. Впервые этот эффект был продемонстрирован на Nоксиде поли-2-винилпиридина. CH3 H3C n N 136 O Полианионы Полианионы. Первой попыткой использовать полианион в качестве лекарственного препарата, по-видимому, следует считать применение полиэтиленсульфоната натрия в качестве заменителя дорогостоящего гепарина (антикоагулянта) в хирургии. CH3 CH2 H3C CH n SO3Na Какое-то время этот полимер выпускался под названием «Пергален». Но впоследствии, из-за высокой токсичности препарата, его применение в медицине было прекращено. Полианионы с карбоксильными группами были предметом подробных исследований в течение ряда лет. Особенное внимание получил так называемый «пирановый сополимер» (ДВЭМА) – продукт чередующейся сополимеризации дивинилового эфира с малеиновым ангидридом. H2C O CH H3C n +2 O O CH O O O O H2C n O O O O O O O O H3C O CH3 O CH3 NaOH H3C n O O ONa NaO O ONa O O O NaO Рисунок 110. Схема реакции сополимеризации дивинилового эфира с малеиновым ангидридом Этот полимер, равно как и ряд других полианионов, обнаружил ряд интересных физиологических эффектов. Он показал противоопухолевое и иммуноадъювантное действие, вызывал активацию макрофагов, проявлял противовирусную и антибактериальную активность. Пирановый сополимер был также успешно испытан как активный носитель низкомолекулярных лекарственных соединений. Примером является конъюгат (через 137 CH3 карбоксильную группу) пиранового сополимера с метотрексатом (известным противоопухолевым препаратом). H3C CH3 O NH HO R O где R: Рисунок 111. Конъюгат пиранового сополимера с метотрексатом Еще большие перспективы имеет использование в качестве носителей физиологически активных веществ биоразложимых полимеров. Примером может служить использование полифосфазенового полимера в качестве носителя известного противоопухолевого препарата цисплатина. Cl O N N H2N X NH2 где X: P P Pt CH2 O X цисплатин NH2 H3C X Cl H3 N NH 3 Cl Cl O NH CH3 H3C X O H3C Pt CH2 O CH2 полифосфазен NH2 H2N NH 2 NH 2 NH2 цепь полифосфазена Рисунок 112. Использование полифосфазенов в качестве носителей цисплатина Сам по себе цисплатин, хотя и очень эффективен, но весьма токсичен и быстро выводится из организма. В комплексе с полифосфазеном с боковыми аминогруппами, цисплатин, не теряя своей противоопухолевой активности, значительно менее токсичен и гораздо дольше удерживается в организме. Продукты биодеструкции комплекса полностью выводятся из организма. Таким образом, конъюгаты фармакологически (биологически) активных субстанций (ФАС или БАС) являются новой перспективной формой лекарственных соединений. В общем виде, такую молекулярную «конструкцию» можно представить в виде так называемой «прививочной» модели. 138 К основной цепи полимера-носителя прикреплены нейтральные гидрофильные группы (для растворимости в водной среде – плазме крови), некоторое количество гидрофобных групп (для сворачивания молекулы в результате гидрофобных взаимодействий в некую глобулу), биолиганд, обеспечивающий целевую доставку к клетке-мишени и/или облегченный эндоцитоз этими клетками, и, собственно, активную фармацевтическую субстанцию (АФС). Такая конструкция типа «ядро-оболочка» должна обеспечить облегченный перенос в кровотоке, в то же время – повышенное время пребывания в кровотоке, повышать вероятность доставки в клеткумишень и защищать АФС от преждевременного биоразрушения. Рисунок 113. Схема полимерного нано-носителя АФС В формировании частицы-носителя АФС может принять участие не одна, а несколько макромолекул. Тогда эта коллоидная частица будет носить название нано- (или микро-) носитель или наногель. В настоящее время интенсивно разрабатываются такого рода препараты. Одним из немногих примеров успешного применения конъюгатов полимеров с АФС, являются полимер-модифицированные ферментативные препараты (протеолитические ферменты, например, на основе химотрипсина). В этих препаратах, к молекулам белка привиты молекулы полиэтиленгликоля (ПЭГ) или других гидрофильных нейтральных неантигенных полимеров. Рисунок 114. Конъюгат «фермент-ПЭГ» 139 Привитые полимеры снижают антигенность белка без потери каталитической активности и увеличивают время пребывания препарата в кровотоке. Такой препарат способен эффективно разрушать тромбы в кровеносных сосудах и может использоваться в постинфарктной терапии. Полимерные антигены и субъединичные вакцины Особым физиологическим эффектом полимеров (полиэлектролитов) следует считать их иммуностимулирующее действие. Было показано, что полиэлектролиты являются неспецифическими иммуномодуляторами, механизм этого эффекта состоит в усилении миграции иммунокомпетентных Tи B- клеток, с мембранами которых взаимодействуют (образуют комплексы с поверхностью клеток) молекулы полиэлектролита. Этот эффект критически зависит от степени полимеризации, т.е. связан с «полимерностью» вещества, но мало зависит от природы полиэлетролита. На этом, как уже указывалось, основано действие иммуностимулирующего препарата «Полиоксидоний». - - X CH2 H3C X - + N CH2 CH3 C2H5 H3C X CH2 n-m CH2 n C2H5 поликатион 1 + CH2 + N N CH3 CH2 m CH2 C6H5 поликатион 2 Рисунок 115. Зависимость силы иммунного ответа у мышей от степени полимеризации полиэлектролита: а) поликатион-1 и поликатион-2; б) полиакриловой кислоты при совместном введении с эритроцитами барана На рисунке (рис. 115) показана зависимость силы иммунного ответа, выражаемая значением относительного числа антителобразующих клеток в 140 селезенке мышей, от степени полимеризации кватернизованных поликонидинов (1 и 2) – рисунок а, и полиакриловой кислоты (рисунок б) при совместном введении полиэлектролитов и антигена (эритроцитов барана) от степени полимеризации полиэлектролитов [21]. Механизм иммуностимулирующего действия полиэлектролитов сложен, но полагают, что он связан с участием полимеров в усилении и кооперации T- и B- клеток и компенсации функций клеток T-хелперов. Следующий шаг состоял в получении химических конъюгатов полимеров с неспецифической иммуностимулирующей активностью со специфическими антигенами конкретных возбудителей. Таким образом, были получены полимер-субъединичные вакцины с высокими протективными свойствами. Примером может служить искусственная вакцина «Гриппол», полученная путем ковалентного связывания гемагглютинина и нейраминидазы – белковых антигенов вируса гриппа с «Полиоксидонием». Этот результат открывает путь к созданию новых высокоэффективных и лишенных негативных побочных эффектов вакцинных препаратов нового поколения. Список рекомендованной литературы к разделу: [2], [7], [14], [21]. 141 СПИСОК ЛИТЕРАТУРЫ 1. Штильман М.И. Полимеры медико-биологического назначения. – М.: ИКЦ Академкнига, 2006. – 399 с. 2. Полимеры в биологии и медицине / под ред. М. Дженкинса. – М.: Научный мир, 2011. – 255 с. 3. Биотехнология: свершения и надежды / под ред. В.Г. Дебабова. – М.: Мир, 1987. – 410 с. 4. Тагер А.А. Физикохимия полимеров. – М.: Химия, 1978. – 544 с. 5. Будтов В.П. Физическая химия растворов полимеров. – СПб.: Химия, 1992. – 381 с. 6. Полимеры для фармацевтической технологии / под ред. С.А. Кедика. – М.: ЗАО ИФТ, 2011. – 511 с. 7. Коршак В.В., Штильман М.И. Полимеры в процессах иммобилизации и модификации природных соединений. – М.: Наука, 1984. – 261 с. 8. Protein Purification: Principles, High Resolution Methods, and Applications / ed. Jan-Christer Janson – New York: Wiley-VCH, 2011. – 522 p. 9. Физико-химические методы исследования биополимеров и низкомолекулярных биорегуляторов / под ред. В.Т. Иванова. – М.: Наука, 1992. – 405 с. 10. Хроматография биополимеров на макропористых кремнеземах / под ред. Е. М. Саминского. – Л.: Наука: Ленингр. отд-ние, 1986. – 188 с. 11. Химия привитых поверхностных соединений / под ред. Г.В. Лисичкина. – М.: Физматлит, 2003. – 589 с. 12. Варфоломеев С.Д. Химическая энзимология. – М.: Академия, 2005. – 471 с. 13. Генералова А.Н., Зубов В.П. Дисперсии полимерных частиц для биоанализа. – М.: Издательство МИТХТ, 2015. – 44 с. 14. Платэ Н.А., Васильев А.Е. Физиологически активные полимеры. – М.: Химия, 1986. – 293 с. 15. Albertsson P.-A. Partition of cell particles and macromolecules: Separation a. purification of biomolecules, cell organelles, membranes, a. cells in aqueous polymer two-phase systems a. their use in biochem. analysis a. biotechnology. – New York: Wiley, 1988. – 346 p. 142 16. Mattiasson B., Galaev I. Smart Polymers for Bioseparation and Bioprocessing. – London: Tayler & Francis, 2001. – 293 p. 17. Полимерные микрочастицы для медицины и биологии / под ред. С.А. Кедика. – М.: ЗАО ИФТ, 2014. – 477 с. 18. Григорьянц И.К., Триханова Г.А. Технология контролируемого выделения: Настольная книга для инженеров, врачей, агрономов, химиков, биологов, экологов. – М.: МГИУ, 2001. – 344 с. 19. Tavassoli H. et al. Large-scale production of stem cells utilizing microcarriers: A biomaterials engineering perspective from academic research to commercialized products // Biomaterials. 2018. № 181. P. 333–346. 20. Hernández R. M. et al. Microcapsules and microcarriers for in situ cell delivery // Advanced Drug Delivery Reviews. 2010. № 62. P. 711–730. 21. Кабанов В.А. От синтетических полиэлектролитов к полимерсубъединичным вакцинам // Высокомолекул. соед.. 2004. Т.46, № 5. С. 759–782. 22. Киреев В.В. Высокомолекулярные соединения. – М.: Юрайт, 2013. – 602 с. 23. Бабак В.Г. Коллоидная химия в технологии микрокапсулирования. – Свердловск: Изд-во Урал. ун-та, 1991. – 171 с. 143 СВЕДЕНИЯ ОБ АВТОРАХ Зубов Виталий Павлович, доктор химических наук, профессор, Заслуженный деятель науки Российской Федерации, профессор кафедры химии и технологии высокомолекулярных соединений им. Медведева С.С. Института тонких химических технологий им. М.В. Ломоносова. Гомзяк Виталий Иванович, кандидат химических наук, старший преподаватель кафедры химии и технологии высокомолекулярных соединений им. Медведева С.С. Института тонких химических технологий им. М.В. Ломоносова. 144