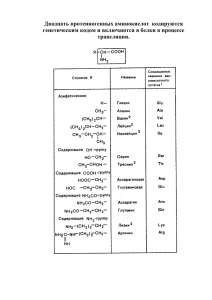
ВНЕШНИЙ ОБМЕН БЕЛКОВ. ВНУТРИКЛЕТОЧНЫЙ ОБМЕН АМИНОКИСЛОТ: ТРАНСАМИНИРОВАНИЕ, ДЕЗАМИНИРОВАНИЕ, ДЕКАРБОКСИЛИРОВАНИЕ. ОБМЕН БИОГЕННЫХ АМИНОВ План лекции: 1. Внешний обмен белков: - биологическая ценность белков, азотистый баланс, - критерии полноценности белков пищи, - переваривание белков в желудке и кишечнике, - образование соляной кислоты в желудке, - всасывание аминокислот в кишечнике, - «гниение» белков в кишечнике. 2. Внутриклеточный обмен аминокислот: - реакции дезаминирования (окислительное прямое и непрямое, цикл ИМФ-АМФ), - реакции трансаминирования, - реакции декарбоксилирования, - реакции превращения аминокислот по радикалу. Порядка 16% азота в организме находится в составе белков. Для восстановления разрушенных белков и построения новых клеток необходимо поступление с пищей белков в организм человека. Аминокислоты, которые находятся в свободном виде или в составе белков, составляют почти 95% всего азота организма, поэтому именно они поддерживают азотистый баланс организма. Азотистый баланс – разница между количеством азота, поступающего с пищей, и количеством выделяемого азота (преимущественно в виде мочевины и аммонийных солей). Азотистое равновесие – количество поступающего азота равно количеству выводимого азота (у взрослых, здоровых при нормальном питании). Положительный азотистый баланс – количество поступающего азота больше, чем выводимого (у здоровых детей, при беременности, у выздоравливающих больных). 1 Отрицательный азотистый баланс – количество выводимого азота больше, чем поступающего (при старении, голодании, тяжелых заболеваниях). Ценность белков. Если белок содержит все незаменимые аминокислоты в необходимых пропорциях и легко подвергается действию протеаз, то биологическая ценность такого белка принимается за 100% (полноценный белок: белки яиц и молока). Существует понятие стандартного (эталонного) белка, к нему наиболее близок белок куриного яйца – содержится 31,4% незаменимых аминокислот. Белки животного происхождения имеют наибольшую химическую и биологическую ценность (близость по составу к стандартному белку и насколько хорошо расщепляются ферментами). Критерии полноценности пищевых белков: - чем ближе аминокислотный состав белка пищи к аминокислотному составу белков организма человека, тем выше его биологическая ценность, белки пищи должны подвергаться расщеплению протеолитическими ферментами организма человека (усваиваемость белков), - наличие в составе белка всех незаменимых аминокислот в определенном соотношении. Внешний обмен белков В желудочно-кишечном тракте белки пищи расщепляются под действием ферментов гидролаз (III класс). Протеазы и пептидазы обладают субстратной специфичностью: расщепляют пептидные связи, образованные определенными аминокислотами в структуре белков и пептидов. Протеазы, гидролизирующие пептидные связи внутри белковой молекулы, относят к группе эндопептидаз. Ферменты, которые гидролизуют пептидную связь, образованную концевыми аминокислотами, относят к группе экзопептидаз. Роль клеток фундальных желез желудка: - главные клетки – секретируют пепсиноген, - обкладочные (париетальные) клетки – секретируют НСl, - добавочные клетки – слизь (мукоидный секрет, представлен гликопротеинами и протеогликанами). Состав желудочного сока: - соляная кислота, - пепсиноген, превращающийся в активный пепсин, 2 - слизь, - гастриксин, - внутренний фактор Касла, - неорганические вещества: вода, хлориды, сульфаты, фосфаты и т.д. У взрослых рН желудочного сока 1,0–2,0; у детей рН желудочного сока 3,0–4,5. Переваривание белков в желудке Регуляция секреции соляной кислоты. Нервная регуляция: стимуляция секреции НСl обкладочными клетками осуществляется холинергическими волокнами n.vagus. Гуморальная регуляция: влияние гастрина и гистамина. Гастрин ‒ стимулирует превращение гистидина в гистамин. Гистамин увеличивает синтез и выделение НСl в обкладочных клетках желудка. Роль соляной кислоты: - превращение неактивного пепсиногена в активный пепсин, - создание оптимума рН для работы пепсина, - денатурация белков пищи, - бактерицидное действие, - участие в обмене железа. Синтез соляной кислоты происходит при участии обкладочных клеток желудка (рис. 68). В обкладочных клетках желудка образуется угольная кислота при действии карбоангидразы. Далее происходит диссоциация угольной кислоты, бикарбонат-ионы поступают в кровь в обмен на ионы хлора, протоны выделяются в просвет желудка в обмен на ионы калия с помощью Н+/К+-АТФазы. Ионы хлора поступают в просвет желудка через хлоридный канал. Рис. 68. Синтез соляной кислоты 3 В главных клетках желудка образуется профермент пепсиноген (неактивный). Механизм активации пепсиногена – частичный протеолиз (рис. 69). Образуется активный пепсин. Кроме того, возможно образование активного пепсина по механизму аутокатализа (рис. 69). Рис. 69. Образование активного пепсина из пепсиногена Оптимум рН для работы пепсина 1,0–2,0. Является эндопептидазой. Специфичность действия: гидролизует пептидные связи, сформированные ароматическими и дикарбоновыми аминокислотами. В результате действия пепсина белок пищи расщепляется до пептидов, но не образуются свободные аминокислоты. Гастриксин. Оптимум рН для работы фермента 3,2–3,5. Является эндопептидазой. Специфичность действия: гидролизует пептидные связи, сформированные дикарбоновыми аминокислотами. Реннин – фермент, локализующийся в желудке у детей грудного возраста. Оптимум рН для работы фермента 3,0–4,5. Необходим для створаживания молока, предотвращения быстрого выхода молока из желудка. Казеин (белок молока) под действием ренина превращается в параказеин, который с ионами кальция образует нерастворимый сгусток. Переваривание белков в тонком кишечнике 4 Кислое содержимое желудка попадая в тонкий кишечник стимулирует продукцию секретина. Секретин с током крови достигает поджелудочной железы и стимулирует выделение панкреатического сока в тонкий кишечник, богатого бикарбонатионами. В результате рН повышается до 7,0‒7,5. Поступление белков и пептидов в тонкий кишечник вызывает секрецию холецистокинина-панкреозимина. Он стимулирует секрецию поджелудочной железой проферментов: трипсиногена, химотрипсиногена, прокарбоксипептидазы А и В, проэластазы. Активация панкреатических проферментов происходит в двенадцатиперстной кишке путем частичного протеолиза (лекция 4 рис. 35). Ключевым моментом является превращение трипсиногена в активный трипсин (рис. 70). Рис. 70. Активация панкреатических проферментов в тонком кишечнике Характеристика ферментов панкреатического и кишечного соков представлена на рисунке 71. Всасывание аминокислот в энтероцитах В результате последовательного действия всех протеаз желудочно-кишечного тракта белки пищи расщепляются до свободных аминокислот. Аминокислоты подвергаются всасыванию в энтероцитах. Механизм транспорта: симпорт с ионом натрия с затратой энергии (рис. 72). Обмен ионов натрия осуществляется первично-активным транспортом с помощью Na+/К+-АТФ-азы. 5 Рис. 71. Характеристика ферментов поджелудочной железы и энтероцитов Рис. 72. Всасывание аминокислот в энтероцитах Транспорт аминокислот в клетках К Na+-зависимым переносчикам аминокислот относят: 1) переносчики нейтральных аминокислот с короткой боковой цепью (аланин, серин, треонин), 6 2) переносчики аминокислот (пролин, оксипролин), 3) переносчик метионина. К Na+-независимым переносчикам аминокислот относят: 1) переносчики для некоторых нейтральных аминокислот (фенилаланин, лейцин), 2) переносчики аминокислот с катионными радикалами (в частности, лизин). Существует специфическая транспортная система аминокислот – ɣ-глутамильный цикл, который представлен в кишечнике, почках, мозге (рис. 73). Рис. 73. Транспортная система аминокислот – ɣ-глутамильный цикл: Е1 – γ-глутамил-трансфераза, Е2 – γ-глутамил-циклотрансфераза, Е3 – пептидаза, Е4 – оксопролиназа, Е5 – γ-глутамил-цистеинсинтетаза, Е6 – глутатион-синтетаза «Гниение» белков в кишечнике При нарушении переваривания белков и всасывания аминокислот, эти молекулы достигают толстого кишечника, где 7 подвергаются воздействию кишечной микрофлоры – такой процесс получил название «гниение» белков в кишечнике. Ферменты анаэробных бактерий в толстом кишечнике из аминокислот образуют токсичные продукты: кадаверин, путресцин, крезол, фенол, скатол, индол, сероводород, метилмеркаптан, метан и т.д. (рис. 74). Рис. 74. «Гниение» белков в толстом кишечнике Обезвреживание продуктов «гниения» белков в кишечнике Образовавшиеся продукты «гниения» белков в кишечнике всасываются и с током крови попадают в печень. В печени аммиак используется для синтеза мочевины, большинство токсических веществ подвергаются реакциям конъюгации при участии ферментов трансфераз: 8 а) сульфотрансферазы – используют 3‘-фосфоаденозин-5‘фосфосульфат (ФАФС), б) УДФ-глюкуронилтрансферазы – используют уридиндифосфоглюкуроновую кислоту (УДФ-ГК) (рис. 75). Рис. 75. Строение 3‘-фосфоаденозин-5‘-фосфосульфата и уридиндифосфоглюкуроновой кислоты В результате реакций обезвреживания в печени из липофильных токсичных молекул образуются гидрофильные менее токсичные молекулы. Если в токсическом веществе есть полярные группы, то сразу идут реакции конъюгации (II стадия биотрансформации) в печени (рис. 76). 9 Рис. 76. Реакции конъюгации в печени (II стадия биотрансформации) Если токсические вещества неполярные (индол, скатол), то сначала они окисляются с участием микросомальной системы печени (цитохром Р450) – I фаза биотрансформации в печени, а затем идут реакции конъюгации – II фаза биотрансформации в печени (рис. 77). Рис. 77. Реакции обезвреживания индола в печени Внутриклеточный обмен аминокислот Аминокислоты в клетках подвергаются реакциям превращения по аминогруппе, карбоксильной группе, радикалу и включаются в состав полипептидной цепи (рис. 78). Реакции трансаминирования Трансаминирование – обратимые реакции переноса аминогруппы от α-аминокислоты на α-кетокислоту без промежуточного образования аммиака. Реакции протекают в 10 цитоплазме с участием ферментов аминотрансфераз, использующих в качестве кофермента пиридоксальфосфат (рис. 79). Реакции протекают постадийно с образованием оснований Шиффа (альдимин и кетимин) (рис. 80). Рис. 78. Пути превращения аминокислот в клетках Рис. 79. Реакция трансаминирования 11 Рис. 80. Образование оснований Шиффа в реакции трансаминирования В норме активность этих ферментов в крови очень низка. Если активность АлАТ и АсАТ в крови значительно возрастает, то можно предполагать повреждение клеток: - преимущественное увеличение активности АлАТ – поражение клеток печени (гепатиты), - преимущественное увеличение активности АсАТ – поражение клеток сердца (инфаркт). Также определяют коэффициент де Ритиса (рассчитывают отношение активности АсАТ к активности АлАТ), в норме он составляет 1,33±0,4. 12 Рис. 81. Реакции, катализируемые аминотрансферазами: АлАТ – аланинаминотрансфераза, АсАТ – аспартатаминотрансфераза, ГОТ – глутаматоксалоацетатаминотрансфераза, ГПТ – глутаматпируватаминотрансфераза Реакции дезаминирования Дезаминирование – реакции отщепления α-аминогруппы у аминокислоты с образованием безазотистого остатка, чаще всего это α-кетокислоты. В этих реакциях высвобождается аммиак, который в последствии подвергается связыванию и обезвреживанию. Различают 4 типа дезаминирования (рис. 82). У человека основной способ дезаминирования – окислительное дезаминирование. У человека неокислительным способом дезаминируются гистидин, серин, треонин и цистеин (рис. 83). Большинство аминокислот подвергаются окислительному дезаминированию: а) прямое окислительное дезаминирование – характерно только для глутаминовой кислоты, идет в два этапа (рис. 84). Дезаминирование окислительным способом могут осуществлять оксидазы L- и D-аминокислот, но их роль в организме человека не велика (оксидазы L-аминокислот – оптимум рН 10,0; оксидазы D-аминокислот – превращает D изомеры, в организме их мало). 13 Рис. 82. Типы реакций дезаминирования Рис. 83. Реакции дезаминирования гистидина, серина и треонина 14 Рис. 84. Реакция прямого окислительного дезаминирования глутаминовой кислоты б) непрямое окислительное дезаминирование (трансдезаминирование) – характерно для различных аминокислот. Реализуется в 2 этапа: 1 этап – трансаминирование различных аминокислот с использованием α-кетоглутарата (фермент – аминотрансфераза, кофермент – пиридоксальфосфат), 2 этап – окислительное прямое дезаминирование глутаминовой кислоты (фермент – глутаматдегидрогеназа, кофермент – НАД+) (рис. 85). Рис. 85. Реакция непрямого окислительного дезаминирования различных аминокислот В мышечной ткани активность глутаматдегидрогеназы низкая, поэтому при интенсивной физической нагрузке в этих клетках функционирует ёще один путь непрямого окислительного дезаминирования – цикл ИМФ-АМФ. Цикл ИМФ-АМФ протекает в четыре стадии (рис. 86): 1. Трансаминирование аминокислоты с α-кетоглутаратом, в результате образуется глутамат. 15 2. Трансаминирование глутамата с оксалоацетатом (фермент АсАТ), в результате образуется аспартат. 3. Реакция переноса аминогруппы от аспартата на ИМФ, в результате образуется АМФ и фумарат. 4. Гидролитическое дезаминирование АМФ. Судьба безазотистого остатка (кетокислот), полученного при дезаминировании аминокислот После реакций дезаминирования безазотистый остаток аминокислот способен вступать в цикл трикарбоновых кислот, окисляться до СО2, Н2О и энергии. Например, аланин превращается в пируват, который с помощью окислительного декарбоксилирования преобразуется в ацетил-S-КоА. Ацетил-S-КоА поступает в реакции ЦТК, далее функционирует цепь переноса электронов и будут синтезироваться молекулы АТФ (рис. 87). Так же безазотистый остаток аминокислот может использоваться в качестве предшественника глюкозы (глюкогенные аминокислоты) и липидов (кетогенные аминокислоты). Рис. 86. Цикл ИМФ-АМФ Рис. 87. Использование безазотистых остатков (пирувата, оксалоацетата и α-кетоглутарата), полученных при дезаминировании аминокислот 16 (аланина, аспартата, глутамата) Реакции декарбоксилирования Декарбоксилирование – необратимые реакции отщепления карбоксильной группы (СО2) с образованием биогенных аминов. В реакциях участвуют ферменты декарбоксилазы, использующие в качестве кофермента пиридоксальфосфат (рис. 88). Рис. 88. Реакция декарбоксилирования Виды декарбоксилирования: 1) α-декарбоксилирование (карбоксильная группа отделяется от αуглеродного атома) – характерно для клеток человека; 2) ω-декарбоксилирование (карбоксильная группа отделяется от ωуглеродного атома), свойственное микроорганизмам; 3) декарбоксилирование, связанное с реакцией трансаминирования; 4) декарбоксилирование, связанное с реакцией конденсации двух молекул (пример: синтез аминолевулиновой кислоты). Реакции декарбоксилирования: синтез биогенных аминов Из глутаминовой кислоты, гистидина и триптофана в реакциях декарбоксилирования образуются биогенные амины – ɣ-аминомасляная кислота (ГАМК), гистамина и серотонин (рис. 89). Биологическая роль биогенных аминов: - ГАМК – медиатор торможения в нервной ткани; - гистамин – повышает тонус гладкой мускулатуры, расширяет капилляры, снижает артериальное давление, повышает секрецию соляной кислоты секрецию соляной кислоты и выделение желчи, участвует в развитии воспаления и боли; - серотонин – повышение аппетита, регуляция памяти, настроения, поведения (действие на уровне ЦНС), регуляция функций сердечно-сосудистой (повышение артериального давления) и эндокринной систем; в периферических нервных окончаниях обуславливает возникновение боли и зуда, активирует 17 перистальтику, повышает агрегацию тромбоцитов, проницаемость мелких сосудов. Рис. 89. Реакции синтеза биогенных аминов – ɣ-аминомасляной кислоты, гистамина и серотонина Пути инактивации биогенных аминов 1. Реакции метилирования (рис. 90). Рис. 90. Инактивация гистамина с помощью метилирования: SAM – S-аденозилметионин, SАГ – S-аденозилгомоцистеин 2. Реакции с участием аминооксидаз: 18 а) моноаминооксидазы (МАО) – функционируют в митохондриях, в качестве кофермента используют ФАД (витамин В2), реакции с участием МАО (Е-ФАД) идут в 2 стадии (рис. 91); б) диаминооксидазы (ДАО) – функционируют в цитоплазме, в качестве кофермента используют ПФ (витамин В6). Рис. 91. Инактивация биогенных аминов с помощью моноаминооксидазы 19