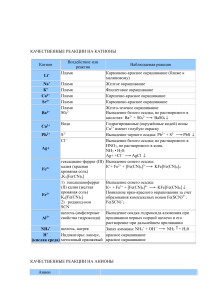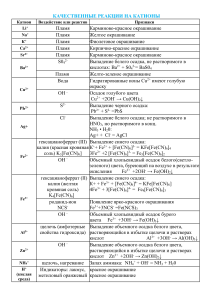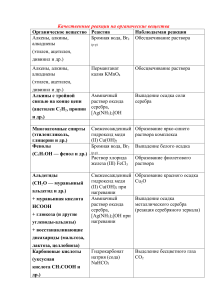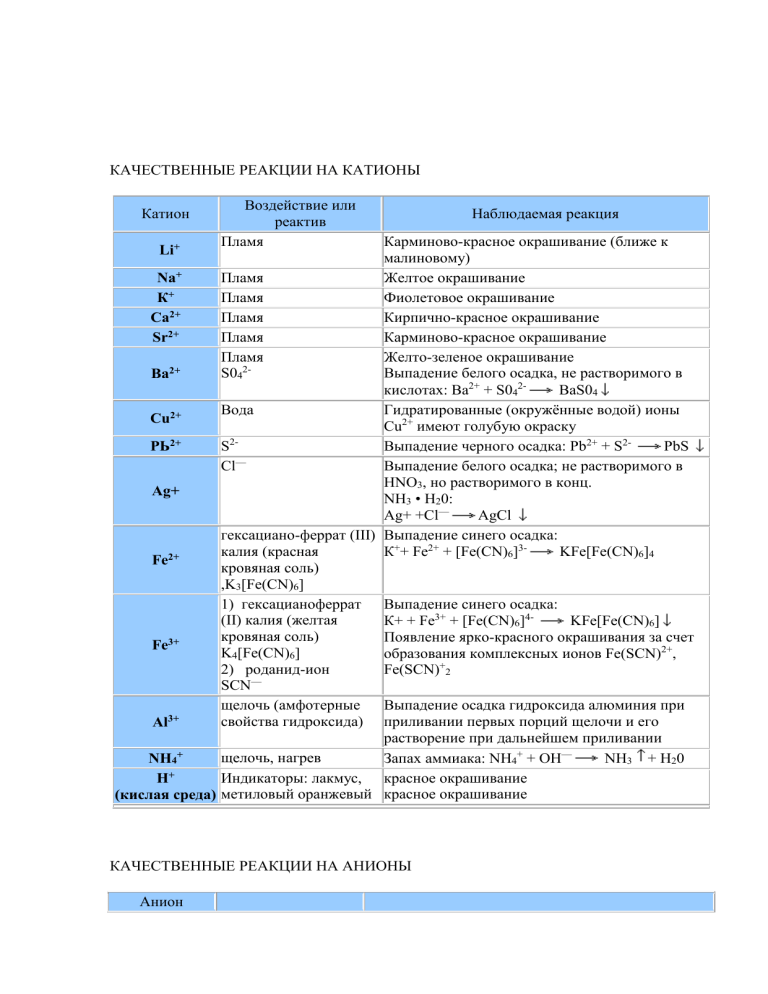
КАЧЕСТВЕННЫЕ РЕАКЦИИ НА КАТИОНЫ Катион Воздействие или реактив Пламя Наблюдаемая реакция Карминово-красное окрашивание (ближе к малиновому) + Пламя Желтое окрашивание Na Пламя Фиолетовое окрашивание К+ Пламя Кирпично-красное окрашивание Са2+ 2+ Пламя Карминово-красное окрашивание Sr Пламя Желто-зеленое окрашивание 22+ S04 Выпадение белого осадка, не растворимого в Ва кислотах: Ва2+ + S042BaS04 Вода Гидратированные (окружённые водой) ионы Сu2+ Сu2+ имеют голубую окраску S2РЬ2+ Выпадение черного осадка: Pb2+ + S2PbS — Cl Выпадение белого осадка; не растворимого в HNO3, но растворимого в конц. Аg+ NH3 • Н20: Аg+ +Cl— AgCl гексациано-феррат (III) Выпадение синего осадка: калия (красная К++ Fe2+ + [Fe(CN)6]3KFe[Fe(CN)6]4 Fe2+ кровяная соль) ,K3[Fe(CN)6] 1) гексацианоферрат Выпадение синего осадка: (II) калия (желтая К+ + Fe3+ + [Fe(CN)6]4KFe[Fe(CN)6] кровяная соль) Появление ярко-красного окрашивания за счет Fe3+ K4[Fe(CN)6] образования комплексных ионов Fe(SCN)2+, 2) роданид-ион Fe(SCN)+2 SCN— щелочь (амфотерные Выпадение осадка гидроксида алюминия при свойства гидроксида) приливании первых порций щелочи и его Al3+ растворение при дальнейшем приливании + щелочь, нагрев NH4 Запах аммиака: NH4+ + ОН— NH3 + Н20 + Индикаторы: лакмус, красное окрашивание Н (кислая среда) метиловый оранжевый красное окрашивание Li+ КАЧЕСТВЕННЫЕ РЕАКЦИИ НА АНИОНЫ Анион Реактив S042- N03— РО43СrO42- S2- , СО32CO2 SO32F— Cl— Br— I— ОН— (щелочная среда) Наблюдаемая реакция Ва Выпадение белого осадка, нерастворимого в кислотах: Ва2+ + S042BaS04 1) добавить конц. Образование голубого раствора, содержащего ионы H2SO4 и Си, нагреть Сu2+, выделение газа бурого цвета (NO2) «2) смесь Возникновение окраски сульфата нитрозо-железа H2S04 +FeSO4 (II) [Fe(H20)5NO]2+. Окраска от фиолетовой до коричневой (реакция «бурого кольца») + ионы Ag Выпадение светло-желтого осадка в нейтральной среде: ЗАg+ + Р043Аg3Р04 2+ ионы Ва Выпадоние желтого осадка, не растворимого в уксусной кислоте, но растворимого в HCI: Ва2+ + СrO42BaCr04 2+ ионы РЬ Выпадение черного осадка: Pb2+ + S2PbS 2+ ионы Са выпадение белого осадка, растворимого в кислотах: Са2+ + С032- = СаСОз известковая вода Са(ОН)2 + С02 СаСО3 + Н20, СаСО3 + С02 + Са(ОН)2 Н20 Са(НС03)2 Выпадение белого осадка и его растворение при пропускании С02 ионы Н+ Появление характерного запаха S02: 2Н+ + SO32Н20 + S02f 2+ ионы Са Выпадение-белого осадка: Са2+ + 2FCaF2 + ионы Аg Выпадение белого осадка, не растворимого в HN03, но растворимого в конц. NH3 • Н20: Аg+ +CI— AgCl AgCI + 2(NH3• Н20) [Ag(NH3)2]+ + CI— + 2Н2О ионы Аg+ Выпадение светло-желтого осадка, не растворимого в HN03: Ag+ + Br— = AgBr осадок темнеет на свету + ионы Аg Выпадение желтого осадка, не растворимого в HNO3 и NH3 конц.: Аg+ + I— АgI осадок темнеет на свету индикаторы: лакмус синее окрашивание малиновое окрашивание фенолфталеин 2+ Таблица качественных реакций по цвету осадка Осадки белого цвета Качественная реакция Белый творожистый Ag+ + Cl— → AgCl↓ нерастворимый в воде; качественная реакция на соли серебра; нерастворимый в HNO3 качественная реакция на хлорид-ионы; Ba2+ + SO4 -2 → BaSO4↓ Белый осадок нерастворимый в кислотах качественная реакция на соли бария; качественная реакция на сульфат-ионы; Сa(OH)2 + SO2 = CaSO3↓ + H2O Белый осадок образуется при пропускании газа без цвета с резким запахом через известковую воду; избыток SO2: CaSO3↓ + H2O + SO2 = Ca(HSO3)2; растворение в кислотах: CaSO3 + 2H+ → SO2↑ + H2O + Ca2+ растворяется при пропускании избытка газа; растворяется в кислотах Белый осадок Al3+ + 3OH— = Al(OH)3↓ образуется при добавлении щелочи; Zn2+ + 2OH— = Zn(OH)2↓ растворяется в избытке щелочи Сa(OH)2 + CO2 = CaCO3↓ + H2O Белый осадок образуется при пропускании газа без цвета и запаха через известковую воду; растворяется при пропускании избытка газа; растворяется в кислотах избыток щелочи: Al(OH)3 + 3NaOH =Na3[Al(OH)6]; избыток щелочи: Zn(OH)2 +2NaOH =Na2[Zn(O H)]4; избыток CO2: CaCO3↓ + H2O + CO2 = Ca(HSO3)2; растворение в кислотах: CaCO3 + 2H+ → CO2↑ + H2O + Ca2+ Осадок светло-желтого цвета Ag+ + Br— → AgBr↓ качественная реакция на бромид-ионы; (осадок кремового цвета) (качественная реакция на соли серебра); образуется при приливании AgNO3; нерастворим в HNO3; Осадок желтого цвета образуется при приливании AgNO3; Ag+ + I— → AgJ↓ качественная реакция на иодид-ионы; (качественная реакция на соли серебра); нерастворим в HNO3; Осадок желтого цвета 3Ag+ + PO43- → Ag3PO4↓ образуется при приливании AgNO3; растворим в кислотах; Осадки коричневых цветов Качественная реакция Осадок бурого цвета Fe3+ +3OH— → Fe(OH)3↓ образуется при качественная реакция на соли железа взаимодействии с растворами щелочей; Осадки синих цветов Качественная реакция Осадок голубого цвета Cu2+ +2OH— → Cu(OH)2↓ (осадок синего цвета) качественная реакция на соли меди (II) образуется при взаимодействии с растворами щелочей Осадок синего цвета образуется при взаимодействии с раствором красной кровяной и желтой кровяной соли 3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓ качественная реакция на соли железа (II) — с красной кровяной солью; 4Fe3+ + 3[Fe(CN)6]4-4 → Fe4[Fe(CN)6]3↓ качественная реакция на соли железа (III) — с желтой кровяной солью; Осадки черного цвета Качественная реакция Осадок черного цвета Fe2+ + S2- → FeS↓ Образуется при взаимодействии с сульфидами или с H2S Ni2+ + S2- → NiS↓ Cu2+ + S2- → CuS↓ Pb2+ + S2- → PbS↓ Hg2+ + S2- → HgS↓ Ag+ + S2- → Ag2S↓ качественная реакция на сульфид-ионы