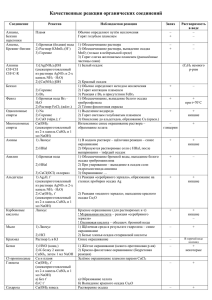
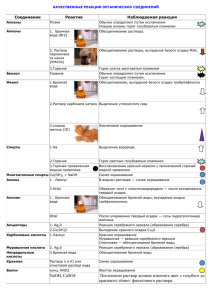
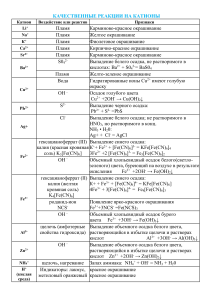
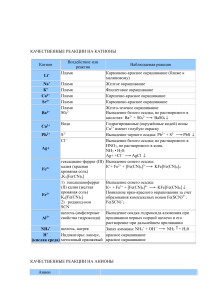
Качественные реакции на органические вещества Органическое вещество Реактив Наблюдаемая реакция Алкены, алкины, Бромная вода, Br2 Обесцвечивание раствора алкадиены (р-р) (этилен, ацетилен, дивинил и др.) Алкены, алкины, алкадиены Перманганат калия KMnO4 Обесцвечивание раствора Аммиачный раствор оксида серебра, [Ag(NH3)2]OH Выпадение осадка соли серебра (этилен, ацетилен, дивинил и др.) Алкины с тройной связью на конце цепи (ацетилен С2Н2, пропин и др.) Многоатомные спирты (этиленгликоль, глицерин и др.) Фенолы Свежеосажденный Образование ярко-синего гидроксид меди раствора комплекса (II) Сu(OH)2 Бромная вода, Br2 Выпадение белого осадка (С6Н5ОН — фенол и др.) (р-р) Раствор хлорида железа (III) FeCl3 Образование фиолетового раствора Альдегиды Свежеосажденный гидроксид меди (II) Сu(OH)2 при нагревании Аммиачный раствор оксида серебра, [Ag(NH3)2]OH при нагревании Образование красного осадка Cu2O Гидрокарбонат натрия (сода) NaHCO3 Выделение бесцветного газа СО2 (СН2О — муравьиный альдегид и др.) + муравьиная кислота НСООН + глюкоза (и другие углеводы-альдозы) Выпадение осадка металлического серебра (реакция серебряного зеркала) + восстанавливающие дисахариды (мальтоза, лактоза, целлобиоза) Карбоновые кислоты (уксусная кислота CH3СООН и др.) Бромная вода, Br2 Анилин (р-р) Аминокислоты (содержащие ароматическое кольцо) Белки Крахмал Азотная кислота, HNO3 Азотная кислота, HNO3 Свежеосажденный гидроксид меди (II) Сu(OH)2 Раствор йода, I2 (р- Выпадение белого осадка 2,4,6-триброманилина Желтое окрашивание Желтое окрашивание (ксантопротеиновая реакция) Образование фиолетового раствора (биуретовая реакция) Синее окрашивание р) Первичные амины (CH3NH2 метиламин и Азотистая кислота HNO2 др.) Вторичные амины Азотистая ((CH3)2NH диметиламин кислота HNO2 Выделение бесцветного газ, не поддерживающего горение (азот) Желтое окрашивание и др.) Анион SO42NO3— РО43- СrO42S2СО32CO2 Качественные реакции на анионы Реактив Наблюдаемая реакция 2+ соли Ва Выпадение белого осадка BaSO4 добавить конц. H2SO4 и Сu, нагреть ионы Ag+ Образование голубого раствора (ионы Сu2+), выделение газа бурого (NO2) Выпадение светло-желтого осадка в нейтральной среде: ионы Ва2+ ЗАg+ + РO43- = Аg3РO4 Выпадение желтого осадка: ионы Рb2+ Ва2+ + СrO42- = BaCrO4 Выпадение черного осадка: ионы Са2+ известковая вода Са(ОН)2 Pb2+ + S2- = PbS выпадение белого осадка СаСО3 Выпадение белого осадка и его растворение при пропускании СO2: Са(ОН)2 + СO2 = СаСО3+Н2O SO3 2- ионы Н + СаСО3 + СO2 + Н2O = Са(НСO3)2 Появление запаха SO2: 2Н+ + SO32- = Н2O + SO2 — ионы Са F Cl— Br— 2+ Сернистый газ обесцвечивает бромную воду. Выпадение белого осадка: ионы Аg+ Са2+ + 2F— = CaF2 Выпадение белого творожистого осадка: ионы Аg+ Аg+ + Cl— = AgCl Выпадение светло-желтого осадка: Ag+ + Br— = AgBr I — ионы Аg + осадок темнеет на свету Выпадение желтого осадка: Аg+ + I— = АgI — ОН осадок темнеет на свету индикаторы: лакмус синее окрашивание фенолфталеин малиновое окрашивание Качественные реакции на катионы Катион Реактив Наблюдаемая реакция + Li Пламя Карминово-красное окрашивание + Na Пламя Желтое окрашивание + K Пламя Фиолетовое окрашивание 2+ Ca Пламя Кирпично-красное окрашивание 2+ Sr Пламя Карминово-красное окрашивание 2+ Ba 1) Пламя 1) Желто-зеленое окрашивание 2+ Cu 2+ Pb Ag+ Fe2+ Fe3+ Al3+ 2) Ион SO421) Вода 2) Ионы ОН— 2) Выпадение белого осадка BaSO4 1) Растворы солей Сu2+ имеют голубую окраску Ион S Ион Cl— 2) Голубой осадок Cu(OH)2 Выпадение черного осадка: PbS Выпадение белого осадка: 2- Красная кровяная соль, K3[Fe(CN)6] 1) Желтая кровяная соль, K4[Fe(CN)6] 2) Роданид-ион SCN— Щелочь (амфотерные свойства гидроксида) Аg+ + Cl— = AgCl Выпадение синего осадка KFe[Fe(CN)6] 1) Выпадение синего осадка: KFe[Fe(CN)6] 2) Появление ярко-красного окрашивания Выпадение белого осадка гидроксида алюминия при добавлении первых порций NH4+ H+ Щелочь при нагревании Индикаторы: лакмус, метилоранж Газ Водород, H2 Азот, N2 Кислород, O2 Озон, O3 щелочи и его растворение при дальнейшем добавлении. Запах аммиака NH3 и окрашивание влажного лакмуса в синий цвет Красное окрашивание (кислая среда) Качественные реакции на газы Качественная реакция Хлопок при поднесении горящей лучинки к источнику водорода Горящая лучинка тухнет в атмосфере азота. При пропускании через раствор Ca(OH)2 осадок не выпадает Тлеющая лучинка ярко загорается в атмосфере кислорода Взаимодействие озона с раствором иодидов с выпадением кристаллического иода I2 в осадок: 2KI + O3 + H2O = 2KOH + I2↓ + O2↑ В отличии от озона кислород в данную Хлор, Сl2 реакцию не вступает При взаимодействии хлора с растворами иодидов в осадок выпадает желтый осадок йода I2: Аммиак, NH3 2KI + Cl2 = 2KCl + I2↓ Резкий запах; влажный лакмус синеет. Реакция аммиака с хлороводородом («дым» без огня): Углекислый газ, CO2 Оксид азота (II), NO NH3 + HCl = NH4Cl Тлеющая лучинка гаснет в атмосфере углекислого газа. Пропускание углекислого газа через известковую воду Ca(OH)2: Ca(OH)2 + CO2 = CaCO3↓ + H2O Дальнейшее пропускание приведет к растворению осадка: CaCO3 + CO2 + H2O = Ca(HCO3)2 Оксид азота (II) очень чувствителен к кислороду воздуха, потому на воздухе буреет, окисляясь до оксида азота (IV) NO2: 2NO+ O2 = 2NO2 Обесцвечивание бромной воды и раствора Сернистый газ, SO2 перманганата калия Сероводород, H2S Чёрный осадок сульфида при пропускании через раствор соли меди или свинца