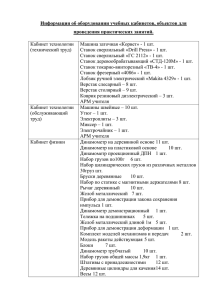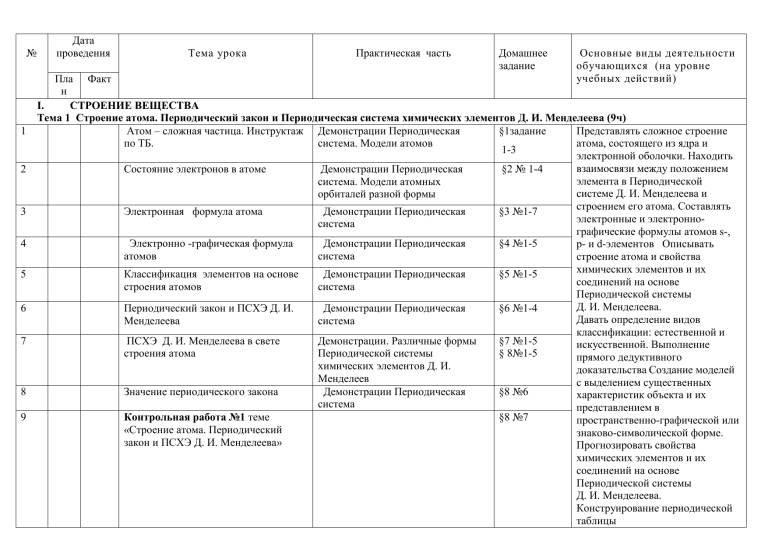
№ 1 2 3 4 5 6 7 8 9 Дата проведения Тема урока Практическая часть Домашнее задание Основные виды деятельности обучающихся (на уровне учебных действий) Пла Факт н I. СТРОЕНИЕ ВЕЩЕСТВА Тема 1 Строение атома. Периодический закон и Периодическая система химических элементов Д. И. Менделеева (9ч) Атом – сложная частица. Инструктаж Демонстрации Периодическая Представлять сложное строение §1задание по ТБ. система. Модели атомов атома, состоящего из ядра и 1-3 электронной оболочки. Находить взаимосвязи между положением Состояние электронов в атоме Демонстрации Периодическая §2 № 1-4 элемента в Периодической система. Модели атомных системе Д. И. Менделеева и орбиталей разной формы строением его атома. Составлять Электронная формула атома Демонстрации Периодическая §3 №1-7 электронные и электронносистема графические формулы атомов s­, Электронно -графическая формула Демонстрации Периодическая §4 №1-5 р­ и d­элементов Описывать атомов система строение атома и свойства химических элементов и их Классификация элементов на основе Демонстрации Периодическая §5 №1-5 соединений на основе строения атомов система Периодической системы Д. И. Менделеева. Периодический закон и ПСХЭ Д. И. Демонстрации Периодическая §6 №1-4 Давать определение видов Менделеева система классификации: естественной и ПСХЭ Д. И. Менделеева в свете Демонстрации. Различные формы §7 №1-5 искусственной. Выполнение строения атома Периодической системы § 8№1-5 прямого дедуктивного химических элементов Д. И. доказательства Создание моделей Менделеев с выделением существенных Значение периодического закона Демонстрации Периодическая §8 №6 характеристик объекта и их система представлением в Контрольная работа №1 теме §8 №7 пространственно-графической или «Строение атома. Периодический знаково-символической форме. закон и ПСХЭ Д. И. Менделеева» Прогнозировать свойства химических элементов и их соединений на основе Периодической системы Д. И. Менделеева. Конструирование периодической таблицы Тема 2 Химическая связь (13 ч) Демонстрации. Коллекция веществ с ковалентным типом химической связи Валентность и валентные возможности Периодическая система Д. И. атома Менделеева Валентность и валентные возможности Демонстрации Периодическая атома система Комплексные соединения Лабораторный опыт №1 Получение катионных Л.о.№1 аквакомплексов и анионных гидроксокомплексов хрома (Ш) Механизм образования комплексных Лабораторный опыт№ 2 соединений Л.о.№2 Гидратная изомерия комплексных соединений Характеристики ковалентной связи §9 №1-5 Пространственное строение молекул. Полярность молекул Демонстрации Периодическая система §13-14 17 Ионная связь. Степень окисления §15№1-5 18 Водородная связь. Металлическая связь, Типы кристаллических решеток Демонстрации. Образцы минералов и веществ с ионным типом связи: оксида кальция, различных солей, твердых щелочей Демонстрации Периодическая система Демонстрации модели кристаллических решток Практическая работа№ 1 Методы очистки веществ 10 11 12 13 14 15 16 19 20 21 22 Ковалентная связь Пр р №1 Методы очистки веществ Итоговый урок. Обобщение по разделу «Строение вещества» Контрольная работа №2 по теме «Строение вещества» §10з.1-3 §10 №4 §11№1-7 §11з8-11 §12№1-3 №1-3 §16№1-4 §17№1-7 §17№8-13 §25 №1-10 Повтор №1-10 Характеризовать ковалентную связь как связь, возникающую за счет образования общих электронных пар путем Характеризовать ионную связь как связь, возникающую путем отдачи или приема электронов. Классифицировать ионы по разным основаниям. Устанавливать зависимость между типом химической связи, типом кристаллической решетки и физическими свойствами веществ перекрывания электронных орбиталей. Классифицировать ковалентные связи по разным основаниям. Классифицировать твердые вещества на кристаллические и аморфные. Устанавливать зависимость между типом химической связи, типом кристаллической решетки и физическими свойствами веществ. Характеризовать металлическую связь как связь между атом-ионами в металлах и сплавах посредством обобществленных валентных электронов. II. ХИМИЧЕСКИЕ ПРОЦЕССЫ Тема 3 Химические реакции и закономерности их протекания (10 ч) 23 Энергетика химических реакций. Демонстрации гашение извести §18 №1-4 24 Термохимические уравнения. Закон Гесс Демонстрации разложение дихромата аммония §18№4-7,§19 25 Скорость химической реакции. Элементарные и сложные реакции №1-4 §21 №1-4,§20 №1-4 26 Факторы, влияющие на скорость химической реакции Демонстрации 1.взаимодействие §22 №1-8 цинка с соляной и уксусной кислотами при разных концентрациях и температурах 2. взаимодействие гранул и порошка цинка или мела с соляной кислотой одинаковой концентрации Демонстрации Опыты, §23 №1-4 иллюстрирующие влияние катализаторов и ингибиторов на скорость химических реакций К.р.2.в.2. №1,9 Практическая работа №2 Скорость химической реакции. 27 Катализ 28 Пр.р № 2 Скорость химической реакции. Т.б. 29 Необратимые и обратимые реакции Химическое равновесие. 30 Роль смещения равновесия в химической промышленности. 31 Итоговый урок. Обобщение по теме «Химические реакции и закономерности их протекания» пов §24 №4-7 32 Контрольная работа №3 по теме «Химические реакции и закономерности их протекания» Повтор §18-25 §25 №4-7 Лабораторный опыт №3 Смещение химического равновесия при изменении концентрации реагирующих веществ §25 №4-7 Классифицировать химические реакции по различным основаниям. . Характеризовать тепловой эффект химических реакций и на его основе различать экзо- и эндотермические реакции. Проводить расчеты на основе термохимических уравнений. Характеризовать скорость химической реакции и факторы Характеризовать катализаторы и катализ как способы управления скоростью химической реакции. Характеризовать состояния химического равновесия и способы его смещения. Наблюдать и описывать демонстрационный химический эксперимент Тема 4 33 34 35 36 37 38 39 40 41 42 Химические реакции в водных растворах (12 ч) Дисперсные системы и их классификация Демонстрации 1. Образцы дисперсных систем с жидкой средой. 2.Образцы пищевых, косметических, биологических и медицинских золей и гелей. 3. Эффект Тиндаля. 4.Таблица «Классификация дисперсных систем» Растворы. Растворимость веществ в Демонстрации1.Графики воде. Л. О №4 зависимости растворимости некоторых твёрдых веществ и газов от температуры 2. Получение насыщенного раствора поваренной соли или сахара 3.Получение пересыщенного раствора Лабораторный опыт№ 4 Тепловые явления при растворении. Способы выражения состава растворов Лабораторный опыт 5 Приготовление раствора заданной Л. О № 5 молярной концентрации Электролитическая диссоциация. Демонстрации Схемы Слабые и сильные электролиты. диссоциации электролитов с ионной, ковалентной полярной связями. Ионное произведение воды. Демонстрации Окраска Водородный показатель индикаторов в различных средах Кислотно-основные свойства Демонстрации Периодическая гидроксидов. Современные представсистема ления о природе кислот и оснований. Реакции ионного обмена Л. О №6 Лабораторный опыт №6 Реакции ионного обмена в растворе Гидролиз солей Демонстрации Гидролиз солей различных типов Степень гидролиза. Гидролиз в свете протонной теории Взаимодействие металлов с Лабораторный опыт№7 §26 №1-6 §27 №1-5 §29 №1-5 §30 № 1-6 §32 №1-6 §33 №1-3 §35 №1-5 §36 №1-5 §37 №1-4 §38 №1-4 Характеризовать различные типы дисперсных систем на основе агрегатного состояния дисперсной фазы и дисперсионной среды. Раскрывать роль различных типов дисперсных систем в жизни природы и общества Определять понятия «электролиты», «неэлектролиты», «электролитическая диссоциация». Формулировать основные положения теории электролитической диссоциации. Записывать уравнения электролитической диссоциации, в том числе и ступенчатой. Наблюдать и описывать демонстрационный химический эксперимент Характеризовать гидролиз как обменное взаимодействие веществ с водой. Записывать уравнения реакций гидролиза различных солей. Различать гидролиз по катиону и аниону. Предсказывать реакцию среды водных растворов солей, образованных сильным основанием и слабой кислотой, слабым основанием и сильной кислотой. растворами гидролизующихся солей Л. О №7 43 44 Тема 5 Взаимодействие металлов с растворами гидролизующихся солей. Необратимый гидролиз солей и Демонстрации полный гидролиз §39 №1-4 бинарных соединений средней солей К §38 39 №8Пр. р.№ 3 Практическая работа №3 Гидролиз солей. Т.б. Гидролиз солей 10 Реакции с изменением степеней окисления атомов химических элементов (12 ч) 45 Окислительно-восстановительные реакции 46 Особые случаи составления уравнений ОВР Метод электронно-ионного баланса Органические вещества в ОВР. Л.О №8 Итоговый урок. Обобщение по разделу «Химические процессы» Контрольная работа №4 по разделу «Химические процессы» Электролиз расплава электролита 47 48 49 50 Демонстрации примеры Окислительно-восстановительных реакций Демонстрации ОВР Лабораторный опыт №8 Окислительно-восстановительные реакции §40 №1-4 Характеризовать окислительновосстановительные реакции как процессы, при которых §42 №1-2 изменяются степени окисления атомов. Составлять уравнения §43 § 44№1-2 ОВР с помощью метода электронного баланса. Проводить, наблюдать и описывать К.Р.В2 №4-8 химический эксперимент с помощью родного языка и языка К.р.2 в6 №1химии Характеризовать 10 электролиз как окислительно§45 №1аб №3 восстановительный процесс. Предсказывать катодные и §45 №1в.,2,4,5 анодные процессы и отражать их на письме для расплавов и водных растворов электролитов. Раскрывать практическое значение §46 №1-3 электролиза Характеризовать и описывать коррозию металлов как §46 № 4 окислительновосстановительный процесс и способы защиты металлов от коррозии. §47 №1-5 51 Электролиз водного раствора электролита Л. О №9 52 Химические источники тока 53 Гальванические элементы Л. О №10 54 Электрохимический ряд напряжений Лабораторный опыт №11 металлов Л. О №11 Восстановительные свойства металлов Коррозия металлов §48 №1-7 55 56 Лабораторный опыт№ 9 Электролиз воды. Лабораторный опыт №10 Гальванический элемент. Пр. р.№ 4 Коррозия и защита металлов Практическая работа №4 К §48 №2-8 от коррозии Т.б. Коррозия и защита металлов от коррозии III. ВЕЩЕСТВА И ИХ СВОЙСТВА Тема 6 Основные классы неорганических соединений (8ч) 57 Оксиды Л. О №12 Лабораторный опыт №12 Распознавание оксидов 58 Гидроксиды. Основания 59 Кислоты 60 Амфотерные гидроксиды Л. О №13 61 Средние и кислые соли Л. О №14 62 Основные, двойные и смешанные соли. Л. О №15 63 64 Тема 7 65 66 §49 №1-7 Демонстрации реакции характерные §50 №1-5 для оснований Демонстрации реакции характерные §51№1-7 для кислот §52 №1-6 Лабораторный опыт №13 Распознавание катионов натрия, магния и цинка §54 №1-7 Лабораторный опыт №14 Получение кислой соли. Лабораторный опыт №15 §56 №1-5 Получение основной соли. Решение задач с использованием стехиометрических схем. Генетическая связь между классами неорганических соединений. Неметаллы и их соединения (10 ч) §53 №1-3 §57 №1-4 Общая характеристика и способы получения неметаллов Физические свойства неметаллов 67 Химические свойства неметаллов Л. О №16 68 Пр. р№ 5 Получение, собирание и распознавание газов Т.б. 69 Водородные соединения неметаллов 70 Кислородные соединения фосфора 71 Кислородные соединения хлора Характеризовать кислоты, соли, основания в свете теории электролитической диссоциации. . Различать общее, особенное и единичное в свойствах гидроксидов и бескислородных оснований. Проводить, наблюдать и описывать химический эксперимент с помощью родного языка и языка химии §58 №1-8 §59 №1-5 Лабораторный опыт №16 Диспропорционирование иода в щелочной среде Практическая работа№ 5 Получение, собирание распознавание газов §59 6-10 §59 №5-10 и §60 №1-8 Демонстрации Образцы §61 №1-5 кислородных соединений фосфора Демонстрации Образцы §61 №6-10 Характеризовать общие химические свойства неметаллов как окислителей и восстановителей на основе строения их атомов и положения неметаллов в ряду электроотрицательности. Наблюдать и описывать химический эксперимент с помощью родного языка и языка химии Оксиды неметаллов и соответствующие им гидроксиды Л. О №17 73 Итоговый урок. Обобщение по темам 4-7 74 Контрольная работа №5 по темам 4-7 Тема 8 Металлы и их соединения (15 ч) 72 75 76 Общая характеристика и способы получения металлов Физические свойства металлов. Взаимодействие с неметаллами 77 Взаимодействие металлов со сложными веществами Л.О. №18 78 Общая характеристика d-элементов 79 Хром и его соединения 80 Окислительно-восстановительные свойства соединений хрома. Применение хрома 81 Практическая работа 6 Соединения хрома т.б. Марганец и его соединения Л.О. №19 82 кислородных соединений хлора Лабораторный опыт №17 Окислительно-восстановительные свойства пероксида водорода. §62 №1-7 К §62 №6-10 Кр 3 в1 №1-10 К.Р.3в9 №1-10 Демонстрации Периодическая система Демонстрации 1.Коллекция металлов с различными физическими свойствами. 2.Взаимодействие металлов с неметаллами и водой Демонстрации 1 Взаимодействие алюминия с растворами щелочи, серной и азотной кислот. Лабораторный опыт 18 Взаимодействие металлов с растворами щелочей Демонстрации Периодическая система Демонстрации Периодическая система. Образцы хрома и его сплавы Демонстрации 1.Минералы, содержащие хром, марганец, железо, медь и цинк. 2 Образцы хрома, марганца, меди, серебра, цинка и их сплавов Практическая работа 6 Соединения хрома Демонстрации 1 Минералы марганец 2. Образцы марганца, меди, серебра, §64№1-5 §65с.314-318 №1 §65 №2-8 §66 №1-2 §67 №2-5 §67 №6-9 №67 №1-10 §68№1-6 Обобщать знания и делать выводы о закономерностях положения и изменений свойств металлов в периодах и группах Периодической системы. Характеризовать общие химические свойства металлов как восстановителей на основе строения их атомов и положения метал лов в электрохимическом ряду напряжения. Проводить, наблюдать и описывать химический эксперимент с помощью родного языка и языка химии 83 Железо и его соединения 84 Практическая работа 7 Соединения железа. Т.Б. Медь и её соединения 85 86 87 88 Практическая работа 8 Соединения меди. Т.Б. Серебро и его соединения Л.О. №20 Цинк и его соединения Л.О. №21 Ртуть Практическая работа 9 Идентификация неорганических соединений. Т.Б. IV. ХИМИЧЕСКАЯ ТЕХНОЛОГИЯ И ЭКОЛОГИЯ Тема 9 Химия и химическая технология (6ч) 90 Производство серной кислоты контактным способом 91 Расчет выхода продукта реакции. Расчётная задача 92 Производств аммиака 93 Производството чугуна 94 Произволство стали 95 Научные принципы химического производства. 89 цинка и их сплавов Лабораторный опыт№19 Соединения марганца Демонстрации §69 №1-7 1Минералы, содержащие железо 2.Горение железа в кислороде и хлоре. 3.Получение гидроксидов железа(П) и (III), их кислотно-основные и окислительно-восстановительные свойства §69 №1-10 Практическая работа 7 Соединения железа. Т.б. §70 №1-6 Демонстрации 1.Взаимодействие меди с конц. и разбавленной азотной кислотой. . Практическая работа 8 Соединения меди. Лабораторный опыт 20 Получение оксида и комплексного основания серебра Лабораторный опыт 21 Получение гидроксида цинка и исследование его свойств. Практическая работа 9 Идентификация неорганических соединений. §70 №4-10 §71 №1-5 § 72№1-5 §73 К Р 4 В2 №1-10 Демонстрации Периодическая §74 №1-5 система Демонстрации Периодическая § 75№1-3 система определение понатич §76 §77 §78 №1-4 §79 №1-8 Анализ схем производства серной кислоты и аммиака, чугуна и стали Проводить расчет на выхода продукта реакции Тема 10 Охрана окружающей среды (7 ч) 96 Охрана атмосферы Л.О. №22 97 98 99 Охрана гидросферы Л.О. №23 Охрана почвы Обобщение материала по темам «Химическая технология и экология» Итоговый урок. Обобщение по темам 8-10 Контрольная работа №6 по темам 8-10 Анализ контрольной работы 100 101 102 Лабораторный опыт 22 Кислотные дожди § 80№1-7 §81 №1-6 §82 №1-5 §82 №5-8 К.р.4 в1 № 110 Повтор §6480 Использовать приобретенные знания и умения в практической деятельности и повседневной жизни для: объяснения химических явлений, происходящих в природе, быту и на производстве; экологически гра-мотного поведения в окружающей среде; оценки влияния химического загряз-нения окружающей среды на организм человека и другие живые организмы; кри-тической оценки достоверности химической информации, поступающей из разных источников.