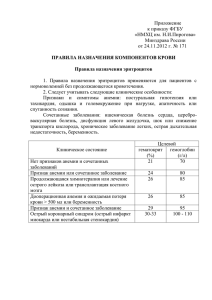
1. Морфологическая классификация анемий Классификация анемий по объему эритроцитов Макроцитарная анемия (MCV> 100 фл, диаметр эритроцитов > 8 мкм) – дефицит витамина В12 и фолиевой кислоты, болезни печени, миелодиспластический синдром (МДС). II. Микроцитарная анемия (MCV<80 фл, диаметр эритроцитов < 6 мкм) – дефицит железа, нарушения синтеза глобина, нарушение синтеза порфирина и гема. III. Нормоцитарная анемия (MCV 80– 100 фл, диаметр эритроцитов 6 – 8 мкм) – острая кровопотеря, гемолиз неизмененных эритроцитов, апластическая анемия, снижение продукции эритроцитов при недостаточности костного мозга (эритропоэтин зависимые анемии) – анемии хронической болезни (АХБ) и хроническая почечная недостаточность. АХБ встречаются чаще всего при инфекционных заболеваниях, системных коллагенозах, злокачественных опухолях (анемия злокачественного заболевания – АЗН). I. Классификация анемий по содержанию гемоглобина в эритроците (показателю МСН,цветовому показателю – ЦП) I. II. III. Анемия гипохромная (МСН цветовой показатель < 0,8) – железодефицитная анемия, сидероахрестическая анемия, талассемии. Анемия нормохромная, цветовой показатель 0,8 – 1,05 – анемия при хронической почечной недостаточности (ХПН), апластическая анемия, анемия при заболеваниях печени, острая постгеморрагическая анемия. Анемия гиперхромная, цветовой показатель > 1,05 – В12-дефицитная анемия, фолиеводефицитная анемия. Классификация анемий в зависимости от способности костного мозга крегенерации I. II. III. Регенераторная форма анемии (с достаточнойкомпенсаторной активацией функции костного мозга) — ретикулоцитов больше12‰ (гемолитические анемии, острая постгеморрагическая анемия,регенераторная стадия железодефицитной анемии, ретикулоцитарный криз при лечении витамином В12 пернициозной анемии). Гипорегенераторная форма анемий (с неадекватной пониженнойрегенераторной функцией костного мозга) – ретикулоциты2 – 12‰ (эритропоэтинзависимые анемии – АХБ, АЗН, гипорегенераторная стадия железодефицитнойанемии). Гипопластическая или апластическая формаанемии (с резким угнетением процессов эритропоэза) – ретикулоцитов менее 2‰ (витамин В12-, фолиеводефицитная анемия, эритропоэтинзависимые анемии – анемия ХПН). Правильное использование показателей МСН или ЦП и МСV помогает наиболее просто и быстро установить причину снижения гемоглобина. В85 – 90% случаев гипохромная анемия свидетельствует о железодефицитной анемии. Анемии с нормальным объемом эритроцитов и нормальным содержанием гемоглобина в эритроцитах позволяют исключить практически все наследственные гемоглобинопатии и мембранопатии. Гиперхромные и макроцитарные анемии наиболее часто встречаются при дефиците витаминов В12 и фолиевой кислоты, иногда требуют исключения МДС. Выраженный ретикулоцитоз (более 100‰), в основном, связан с активным гемолизом, ретикулоцитоз 20 – 100‰,как правило, обусловлен репарационной активностью костного мозга после кровопотери (язвенная болезнь желудка, 12-перстной кишки, менометроррагия). Ретикулоцитоз более 100‰ в сочетании с гипохромией и микроцитозом практически однозначно указывает на наследственные гемолитические анемии (при сочетании с желтухой, повышением непрямого билирубина и спленомегалией). Наоборот, при неадекватной активности эритропоэза – гипо- и арегенераторной анемии наиболее вероятно наличие АХБ, АЗН, ХПН. 2. ЖЕЛЕЗОДЕФИЦИТНАЯ АНЕМИЯ Метаболизм железа Средняя суточная диета содержит 10-15 мг железа, из которого абсорбируется только 5-10%. Обычно в сутки всасывается не более 3,5 мг железа. При некоторых состояниях, например, дефиците железа или беременности доля абсорбируемого железа может увеличиться до 20-30%, но все равно основная часть диетического железа не утилизируется. Ежедневная потребность в железе зависит в основном от пола и возраста, особенно она велика при беременности, у подростков и менструирующих женщин. ЭТИОЛОГИЯ И ПАТОГЕНЕЗ Этиологические факторы ЖДА. Хронические потери крови различной локализации (железо теряется необратимо), не компенсируемые поступлением Fe с пищей. У женщин потери около 40 мг в течение цикла. Риск у женщин выше (маточные кровотечения) ЖКТ кровотечения (язва, геморрой, рак, диафрагмальная грыжа, неспециф язв колит. полипоз) Алиментарный фактор (недосаточное потребление железа). Повышенная потребность в железе (беременность, лактация, интенсивный рост в пубертатный период); Гастроэнтерогенные причины (как мальдигестия, так и мальабсорбция: нарушение процессов полостного и пристеночного пищеварения, ограничения процесса всасывания железа), может быть при резекции желудка или тонкого кишечника; Нарушения транспорта железа в связи с дефицитом трансферрина в случае первичной патологии печени; Конкурентное потребление Fe (при опухолях, глистных инвазиях и так далее). Нарушение утилизации Fe костным мозгом. Пища (трехвалентное - яблоко, гречка. Двухвалентное (гемовое) - мясо, лучше всасывается), основная часть железа всасывается в 12-п кишке. -> связывается с трансферрином (трехвалентное) -> доставляется в костный мозг, в мышцы, в печень (депо), в селезенку. Откладывается железо в виде ферритина в печени(негемовая форма Fe)и в меньшей степени гемосидерина. Железо нужно для миоглобина и гемоглобина, для каталазы и лактопероксидазы, для ферментов дыхательной цепи(цитохромы). Быстрый обмен веществ в эпителиальных тканях. Гемолиз, разрушение собственных тканей -> связь с ферритином и обратно в организм. Часть железа экскретируется (0,7 мг в сутки) КЛИНИЧЕСКАЯ СИМПТОМАТИКА Общий анемический или циркуляторно-гипоксический синдром. Мало Hb, нет переносчика кислорода - циркуляторная гипоксия (уже при Hb <80 г/л): гипоксия ЦНС - головокружение, шаткость походки, потемнение в глазах, сонливость, снижение винмания, сниженная работоспособность, мелькание мушек, шум в ушах компенсаторные механизмы - увеличение частоты и глубины дыхания (дыхательный центр), тахикардия, одышка, усиливающаяся при ходьбе, «ощущение нехватки воздуха», колющая или ноющая боль в области сердца без иррадиации, не связанная с физической нагрузкой; физикально: бледность кожи, слизистых, тахикардия, систолический шум на верхушке (изменение реологических свойств крови), шум «волчка» на яремных венах (изменение реологических свойств крови), мб усилен I тон на верхушке (укорочение диастолы, недостаточное наполнение ЛЖ -> укорочение фазы изометрического напряжения и ускорение изгнания крови в аорту). тенденция к снижению температуры и давления Сидеропенический синдром (железо входит в цитохромы - ферменты дыхательной цепи, поэтому страдают ткани с быстрым делением): сухость кожи, шелушения кожи, ломкость ногтей и волос, исчерченность и изменение формы, раннее поседение, заеды в уголках рта, воспалительный процесс, койлонихии - ломкие слоистые вогнутые (ложкообразные) ногти. слизистые: атрофический глоссит (извращение вкуса), извращение обоняния (пикохлоротика), изменение пищевых пристрастий, затруднение глотания (пищевод) сидеропеническая дисфагия, диареи и запоры (ЖКТ). мышечная слабость - гипоксия мышц, миоглобин Гематологическая характеристика - гипохромная, микроцитарная, гипорегенераторная, ЦП обычно низкий (ниже 0,5), выражена гипохромия эц, анизоцитоз, пойкилоцитоз, незначительно увеличено СОЭ ЛАБОРАТОРНЫЕ ПРИЗНАКИ Лабораторные исследования позволяют выявить все этапы развития дефицита железа. Латентный дефицит железа будет характеризоваться резким уменьшением или отсутствием депозитов железа в макрофагах костного мозга, которые выявляются с помощью специальной окраски. Второй признак истощения запасов железа в организме - снижение ферритина в сыворотке крови ( N: м 30-300 нг/мл, ж - 20-120нг/мл, дети - 7-140нг/мл). Железодефицитный эритропоэз сопровождается появлением умеренного гипохромного микроцитоза при нормальной концентрации гемоглобина. Повышается уровень ненасыщенных трансферринов ( больше 2/3 от общего N=23-45 мкмоль/л), снижается содержание насыщенных трансферринов ( < 2/3 общего) и железа ( 9-31 мкмоль/л) в сыворотке крови. Увеличивается количество свободного протопофирина в эритроцитах в эритроцитах в связи с недостатком железа для его превращения в гем. Для железодефицитной анемии характерны снижение концентрации гемоглобина, более выраженные гипохромия и микроцитоз эритроцитов, появление анизоцитоза и пойкилоцитоза. Содержание ретикулоцитов нормальное или умеренно сниженное, но может увеличиваться после острой кровопотери. Лейкоцитарная формула обычно не меняется, содержание тромбоцитов нормальное или слегка повышенное. Концентрация железа и насыщенных трансферринов снижена, ненасыщенных трансферринов повышена. Клеточность костного мозга нормальная, может быть умеренная гиперплазия эритодного ростка. Количество сидеробластов резко снижено. Наверное одними из самых распространенных ошибок в диагностике анемий являются ошибки в дифферинциальном диагнозе гипохромных микроцитарных анемий. Дифферинциальный диагноз проводится с талассемией, сидеробластной анемией и анемией при хронических заболеваниях. При сборе анамнеза следует обратить внимание на наличие признаков кровотечения, хронических воспалительных заболеваний. Сведения о наследственности или происхождении больного могут вызвать предположение о талассемии. Клиническим отличием железодефицитных анемий от указанных является наличие сидеропеничечкого синдрома. Тщательное клиническое обследование позволяет выявить признаки хронического воспалительного или злокачественного заболеваия, увеличение сезенки при талассемии. 3. Показатели клинического анализа крови при анемии ЛАБОРАТОРНЫЕ ПРИЗНАКИ АНЕМИЙ Лабораторные признаки анемий являются основой диагностики анемий. Особое значение имеют размеры эритроцита и его объем, содержание гемоглобина в эритроците, форма эритроцита, патологические включения в эритроцитах, средний объем эритроцита, среднее содержание гемоглобина в эритроците, среднюю концентрацию гемоглобина в эритроците и индекс анизоцитоза. 1. Размер эритроцита. При анемиях эритроциты могут быть нормального размера (нормоцитарные), а также больше (макроцитарные) и меньше нормы (микроцитарные). Аномальные размеры эритроцитов могут встречаться и при некоторых физиологических состояниях. У новорожденных в течение первых нескольких недель размеры эритроцитов значительно превышают норму, затем они становятся меньше нормы и постепенно в течение нескольких лет достигают нормальных размеров. При нормальной беременности отмечено умеренное увеличение размеров эритроцитов даже при отсутствии других причин макроцитоза например, дефиците фолиевой кислоты. В некоторых случаях можно выявить сочетание микроцитоза и макроцитоза (например, одновременный дефицит железа и витамина В12), при этом средний объем эритроцитов может быть нормальным. Определение размеров эритроцитов с помощью светового микроскопа производится при подсчете кривой Прайс-Джонса ( диаметр эритроцитов) или с помощью автоматического анализатора крови (объем эритроцитов, гистограмма, индекс анизоцитоза). Наличие эритроцитов разных размеров называется анизоцитозом. 2. Определение цветового показателя и содержания гемоглобина в эритроците (MCH) позволяет разделить анемии на гипохромные , нормохромные и гиперхромные. Поскольку гемоглобин составляет основную часть эритроцита , существует отчетливая зависимость между размерами эритроцита и содержанием в нем гемоглобина, т. е. микроцитарные анемии как правило гипохромные, макроцитарные - гиперхромные, а нормоцитарные нормохромные. Определение размеров эритроцитов и содержания в них гемоглобина позволило создать полезную для клинической работы морфологическую классификацию анемий. Эта классификация позволяет с помощью минимального количества признаков с достаточной точночтью определить патогенез анемии и выработать тактику диагностического поиска. Кроме того, аномальные показатели эритроцитов могут выявляться и при номальном или субнормальном содержании гемоглобина, например, макроцитоз на ранней стадии дефицита витаминВ12 или фолиевой килоты. В этих случаях возможно раннее выявление и лечение патологии. 3. Форма эритроцитов имеет важное значение для диагностики анемий, особенно гемолитических. 4. Аномальные включения в эритроцитах, выявляемые при микроскопическом исследовании, также могут помочь в диагностике анемий . 5. Содержание ретикулоцитов в норме составляет 0,5-2,0% или 25-75 х 10*12/л. При сохраненном эритропоэзе снижение количества эритроцитов сорповождается выработкой эритропоэтина, ускоренным выходом ретикулоцитов в периферическую кровь и ретикулоцитозом. Эта рекция особенно выражена при гемолитических анемиях, когда развивается эритроидная гиперплазия. Другими причинами ретикулоцитоза могуть быть: Острая кровопотеря; Восстановление ранее поврежденного эритропоэза, например, ретикулоцитарный криз после начала лечения витамином В12; Метастазы опухолей в костный мозг. Отсутствие ретикулоцитоза у больного с анемией свидетельствует о нарушении эритропоэза или дефекте выраборотки эритропоэтина. У больных с выраженной анемией необходимо производить коррекцию количества ретикулоцитов в зависимовти от количества эритроцитов, иначе возможна диагностическая ошибка. 7. Исследование костного мозга обязательно при обследовании больного с любой неясной анемией. Особенно диагностическая ценность исследования костного мозга при анемии вследствие нарушения продукции эритроцитов. При этом, чем тяжелее анемия, тем выше информативность показателей морфологии костного мозга. Показанием к проведению трепанобиопсии является диагностика апластической анемии, милопролиферативных заболеваний, остеомиелофиброза, метастазов опухолей и пр. 4. Анемии хронических заболеваний. Этиология, патогенез АХЗ– не нозологическая форма, не синдром, а собирательное понятие, характеризующееся общностью патогенеза этого осложнения различных заболеваний. К данным анемиям относят: · анемии при злокачественных опухолях, как с поражением костного мозга (гемобластозы, метастазы в костный мозг), так и без него; Угнетение эритропоэза: - активация ингибиторов эритропоэза, - ингибиция эритропоэза цитостатиками, - конкурентное вытеснение эритрона из костного мозга опухолевыми клетками. + Активация воспалительных и опухолевых цитокинов (фактор некроза опухоли, интерлейкины, интерферон) приводит к подавлению выработки эритропоэтина, нарушению высвобождения железа из макрофагов и подавлению пролиферацию клеток предшественников эритропоэза. · анемии воспаления, в том числе: - при острых инфекциях (сепсис, пневмония, инфекционный эндокардит, перитонит); - при хронических инфекциях (остеомиелит, хр. пиелонефрит, туберкулез); - хр. воспалительных заболеваниях с преобладанием иммунокомплексного механизма (ревматоидный артрит, гепатит, СКВ, болезнь Крона); Сначала концентрация Нb падает из-за кратковременного гемолиза, макрофаги удаляют из крови отжившие эритроциты (перераспределение железа в организме – увеличенное потребление макрофагами), в последующем угнетение эритропоэза идет воспалительными цитокинами. При хроническом воспалении тяжесть и характер анемии зависит от природы основного заболевания. Анемия при воспалительных заболеваниях характеризуется снижением, как сывороточной концентрации железа, так и ОЖСС. Насышение трансфферина уменьшается до 10-20% и на этом фоне повышенный уровень ферритина, а при исследовании костного мозга нормальные или увеличенные запасы железа в сочетании с гипоплазией эритроидного ростка. + Нарушение обмена железа: - повышенное потребление железа неэритроидными клетками, в том числе бактериями, - нарушение высвобождение запасов железа макрофагами, - дефицит железа при хронических кровопотерях. · анемия при острой и хронической почечной недостаточности, в том числе и у больных, находящихся на гемодиализе; Причины: снижение продукции эритропоэтина, укорочение жизни эритроцитов, тромбоцитарная дисфункция, ДВС - синдром с присущей ему кровоточивостью и внутрисосудистым гемолизом, действие уремических токсинов на эритроциты, снижение уровня железа из-за неадекватного всасывания в кишечнике и гемодиализных кровопотерь · анемия при хронической сердечной недостаточности; Важным фактором развития данной анемии является почечная дисфункция, воспаление, резистентность к эритропоэтину, кишечная мальабсорбция, постоянное использование аспирина и протеинурия Характерные черты: · нормохромные эритроциты обычных размеров и форм; · уровень гемоглобина не опускается ниже 100г/л (исключая больных тяжелой почечной недостаточности). · отсутствие лейкоцитопении и тромбоцитопении или разнонаправленные изменения их концентрации, не коррелирующие с анемией; · нормальный или несколько повышенный уровень ретикулоцитов; · нормальный или слегка повышенный уровень эритропоэтина в крови; · наличие в сыворотке крови ингибиторов эритропоэза ( ТNFa ,IL-1 и др) · нормальный уровень в крови витамина В12 и фолиевой кислоты; · нормальный уровень запасов железа, нормальные показатели ОЖСС, ферритина и растворимых рецепторов к трансферрину (если нет выраженного железодефицитного компонента). 5.Анемии, связанные с нарушением синтеза порфиринов Развитие анемии обусловлено недостаточной или аномальной утилизацией внутриклеточного железа при синтезе гемоглобина, несмотря на нормальное или даже повышенное содержание железа в митохондриях эритроидных предшественников. Лабораторные исследования выявляют высокую концентрацию железа и ферритина в сыворотке крови и повышенное насыщение трансферрина железом. В костном мозге отмечается гиперплазия эритроидных клеток. Окраска на железо выявляет патогномоничные изменения, обусловленные накоплением неутилизированного железа в митохондриях эритрокариоцитов - кольцевидные сидеробласты. Наследственные и приобретенные анемии, связанные с нарушением синтеза порфиринов, характеризуются гипохромией, высоким содержанием железа сыворотки и гемосидерозом органов. Наследственные анемии этого типа встречаются сравнительно редко, преимущественно у мужчин, так как наследование сцеплено с Х-хромосомой. Относительно чаще наблюдается форма болезни, вызванная дефектами синтеза δ-аминолевулиновой кислоты. Нарушение образования протопорфирина обуславливает невозможность связывания железа и вследствие этого происходит накопление его в организме. Преимущественное поступление железа в печень приводит к развитию цирроза, в поджелудочную железу - к сахарному диабету, накопление железа в яичках к евнухоидизму, в надпочечниках - надпочечниковой недостаточности. Клинические проявления болезни зависят от выраженности анемии и признаков избыточного отложения железа в организме. У больных в молодом возрасте анемия в большинстве случаев невыраженная (80-90 г/л), однако гемоглобин постепенно падает до 50-60 г/л. Содержание ретикулоцитов нормальное или несколько сниженное. Эритроциты гипохромные, отмечается анизоцитоз, пойкилоцитоз, отдельные мишеневидные эритроциты. Такие дефекты могут быть связаны с наследственными нарушениями, главным образом при синтезе порфиринов или с приобретенным характером поражения, например, в результате отравления свинцом или недостаточности витамина В6. Отличительным признаком этого типа анемий является насыщение организма железом, в связи с чем ранее использовался термин "сидероахрестические", т. е. железонасыщенные анемии. Порфирины используются при синтезе гема. Они синтезируются во всех клетках организма, но основная масса - в ядерных клетках эритроидного ростка костного мозга. Гем также синтезируется в мышцах для образования миоглобина, который связывает кислород и выполняет роль дополнительного его источника при гипоксии. Синтез порфиринов происходит и в клетках печени, он необходим для образования каталазы, пероксидазы, цитохромов, участвующих в электронном транспорте при энергообразовании в клетках. Печень - орган с наиболее выраженной гем-продуцирующей функцией. Гем одинаков для всех видов гемоглобина, последние различаются между собой структурой глобина. Гем крайне неустойчив и легко превращается в гематин с окислением Fе+2 в Fе+3 и присоединением к последнему ОН—. Он также легко превращается в гемин, который вместо ОН— содержит хлор. Гем обладает способностью вступать в обратимую комбинацию с кислородом. При связывании кислорода железо должно быть в активной двухвалентной форме. Основные этапы синтеза тема показаны на рис. 26. Каждый этап контролируется специфическим ферментом. Начинается синтез тема в митохондриях с присоединения сукцинил-кофермента-А (СоА) к глицину, в результате чего образуется δ-аминолевулиновая кислота (АЛК). Этот процесс идет с участием фермента АЛК-синтетазы, в качестве кофермента которого выступает пиридоксаль-5фосфат (производное витамина В6). Активность фермента может быть угнетена химическими веществами, в частности свинцом, алкоголем, снижена глюкозой или гемом. Считается, что АЛКситетаза ограничивает скорость биосинтеза тема в печени. При конденсации двух молекул 5-АЛК образуется порфобилиноген (ПБГ). Эта реакция катализируется дегидразой АЛК, активность которой снижается под действием свинца и гемина. При конденсации четырех молекул ПБГ синтезируется уропорфириноген (УРО). В этом процессе участвуют 2 фермента: уропорфириноген-III-синтетаза и порфобилиноген-дезаминаза. Из УРО образуется копропорфириноген III, синтез которого катализируется ферментом УРО-декарбоксилазой. Копропорфириноген III под действием копропорфириноген-III-оксидазы превращается в протопорфириноген IX. Следующий этап биосинтеза тема - преобразование протопорфириногена IX в протопорфирин IX - осуществляется ферментом протопорфириногеноксидазой. Заканчивается синтез порфиринов включением двухвалентного железа в протопорфирин IX. Процесс катализируется митохондриальным ферментом феррохелатазой (гемсинтетаза), в результате чего образуется гем. Цепь реакций синтеза порфиринов регулируется механизмом обратной связи, где конечный продукт гем регулирует синтез АЛК на уровне транскрипции и трансляции в клетках печени. Биосинтез порфиринов осуществляется в эритрокариоцитах костного мозга и гепатоцитах. Основная часть порфиринов, синтезированных в костном мозге, идет для образования гемоглобина. В результате дефицита одного из ферментов синтеза тема развивается порфирия. При порфирии из-за нарушения синтеза тема снимается механизм обратной связи, прекращается ингибирование скорость-лимитирующего фермента АЛК-синтетазы, поэтому при легких формах порфии удается поддерживать адекватный синтез тема (анемия не развивается), а происходит накопление промежуточных продуктов. АЛК, ПБГ и уропорфириноген - водорастворимы, поэтому при накоплении экскретируются с мочой, при этом моча приобретает темно-красный оттенок. Копропорфирин и протопорфирин не растворимы в воде, они экскретируются с желчью и определяются в кале. 6. Мегалобластные анемии Мегалобластные анемии - большая группа наследственных и приобретенных анемий, связанных с нарушением синтеза ДНК и РНК. Характерный признак: эритроидные клетки имеют больший, чем в норме, размер, нежную структуру ядерного хроматина и диссоциацию созревания ядра и цитоплазмы. В периферической крови выявляются макроциты и мегалоциты. · В12- дефицитная анемия. Причины дефицита витамина В12 : нарушение всасывания (Неадекватная выработка внутреннего фактора при В12-дефицитной анемии, после гастрэктомии, при врожденном отсутствии или дефекте внутреннего фактора, Заболевания подвздошной кишки,которая является основным местом всасывания витамина В12, Синдром малабсорбции), Конкурентное поглощение витамина В12 при инвазии широким лентецом (дифиллоботриоз), дисбактериозе, Прием некоторых медикаментов (неомицин, колхицин, аминосалициловая кислота), Неадекватное поступление с пищей, Нарушение синтеза и структуры транскобаламинов Патогенез. В плазме в основном присутствует активная форма витамина В12 - метилкобаламин, который необходим для образования тетрагидрофолиевой кислоты, участвующей в синтезе тимидина. В ходе этой реакции происходит конверсия гомоцистеина в метионин. При дефиците витамина В12 нарушается нормальный метаболизм фолатов и синтез ДНК, в связи с чем пролиферирующие клетки теряют способность к делению и созреванию. В результате в костном мозге возникает мегалобластический тип кроветворения, появляются гигантские клетки миело- и мегакариоцитопоэза. Витамин В12 участвует также в нормальном обмене жирных кислот. При его дефиците нарушается продукция холина и холинсодержащих фосфолипидов, происходит распад жирных кислот, что ведет к нарушению образования миелина и токсическому поражению нервной системы жирными кислотами, в частности метилмалоновой кислотой. Лабораторные и инструментальные данные. Клинический анализ крови. При мегалобластных анемиях отмечается снижение эритроцитов и в меньшей степени гемоглобина. Гиперхромия проявляется повышением MCH более 35 пг или цветового показателя более 1,1. Отмечается также увеличение среднего объема эритроцита (MCV) свыше 96 фл. При сочетании В12-дефицитной и гипохромной (обычно железодефицитной) анемии MCV может оставаться в пределах нормы. При просмотре мазка крови выявляются макроцитоз (диаметр эритроцитов 9-12 мкм), мегалоцитоз (более 12 мкм), иногда овалоцитоз, анизо- и пойкилоцитоз. Во многих эритроцитах обнаруживаются остатки ядра (тельца Жолли, кольца Кебота, пылинки Вейденрейха) и базофильная пунктация. Нередко в периферической крови отмечаются единичные нормоциты и мегалобласты, полихромазия. Количество ретикулоцитов снижено, реже в норме. Выраженное увеличение количества ретикулоцитов (200-300%о и более) развивается на 5-8-й день лечения витамином В12 и подтвержает диагноз. Миелограмма. Цитологическое исследование аспирата костного мозга - важнейший метод диагностики В12-дефицитной анемии. В миелограмме при нормальном или повышенном количестве миелокариоцитов отмечается выраженная гиперплазия эритроидного ростка и мегалобластический тип кроветворения (клетки эритроидного ряда больших размеров, при этом созревание ядра отстает от гемоглобинизации цитоплазмы, т.е. ядро более “молодое”, чем цитоплазма). Резко уменьшено число оксифильных форм мегалобластов (“синий костный мозг”), увеличено количество ядросодержащих клеток эритроидного ряда, разрушающихся в костном мозге (неэффективный эритропоэз), обнаруживаются полисегментированные и гигантские формы клеток нейтрофильного ряда. Биохимическое исследование. Уровень сывороточного железа в норме или несколько повышен (при сочетании В12-дефицитной и железодефицитной анемии - снижен). Часто выявляется умеренная гипербилирубинемия за счет свободного билирубина. Характерно снижение содержания витамина В12 в сыворотке и повышение уровня метилмалоновой кислоты в моче. При лечении витамином В12 железо сыворотки может снижаться в связи с нарастанием продукции эритроцитов и увеличением потребности в железе для синтеза гемоглобина. Исследование кала необходимо для исключения инвазии широким лентецом. · Фолиеводефицитные анемии. Фолиевая кислота и ее производные (тетрагидрофолиевая, дигидрофолиевая кислоты) участвуют в метаболизме нуклеиновых кислот. В частности, фолиевые коферменты необходимы для образования пуринового ядра, катаболизма гистидина в глютаминовую кислоту, биосинтеза метионина. Всасывание фолиевой кислоты и ее солей происходит в двенадцатиперстной кишке и проксимальной части тощей кишки с помощью активного переноса, а при избыточном поступлении - пассивной диффузией. Образуя нестойкие соединения с глобулинами и беталипопротеидами, фолиевая кислота переносится плазмой. При прохождении через печень происходит метилирование фолиевой кислоты. Печень является основным депо фолиевокислых солей. В клетках печени фолиевая кислота находится в неактивном состоянии (в виде тетрагидрофолиевой кислоты) и переходит в активную форму по мере метаболических потребностей клеток. Выведение фолиевой кислоты из организма происходит преимущественно с мочой, в меньшей степени - через кишечник. Лабораторные данные. Клинический анализ крови. Также как и при В12 дефицитной Определение концентрации фолиевой кислоты. Концентрация фолиевой кислоты может быть определена микробиологическим или радиоиммунологическим методами. У больных фолиеводефицитными анемиями отмечается снижение уровня фолиевой кислоты в сыворотке и эритроцитах. Это наиболее точный способ диагностики данной группы анемий. Кроме того, для фолиеводефицитных анемий характерно повышенное выделение форминглутаминовой кислоты с мочой и нормальная экскреция 7. Гемолитические анемии Классификация: Наследственные: ➢Связанные с нарушениями мембраны эритроцитов: наследственный микросфероцитоз, овалоцитоз, стоматоцитоз и др. ➢Связанные с нарушением активности ферментов эритроцитов: дефицит глюкозо-6фосфат дегидрогеназы, пируват-киназы и др. ➢Связанные с нарушением структуры или синтеза гемоглобина – Нв-патии, талассемии Приобретенные: ➢связанные с воздействием антител: изоиммунные и аутоиммунные ➢связанные с изменением структуры мембраны, обусловленные соматическими мутациями (пароксизмальная ночная гемоглобинурия - болезнь Маркиафавы-Микели) ➢связанные с механическим повреждением оболочки эритроцитов (маршевая гемоглобинурия; разрушение эритроцитов при протезировании клапанов сердца) ➢связанные с химических повреждением эритроцитов (воздействие тяжелых металлов, отравление кислотами, гемолитическими ядами и др.) ➢обусловленные недостатком витаминов – Е и др. ➢обусловленные разрушением эритроцитов паразитом – малярия. Гемолитические анемии с внутриклеточным гемолизом Чаще наследственные заболевания с хроническим течением: нарушения мембран эритроцитов увеличение проницаемости для ионов натрия и воды осмотическое набухание клеток сфероциты разрушение в синусах селезенки увеличение селезенки. Внутриклеточный гемолиз – это селезеночный гемолиз. Клинические признаки гемолитической анемии с внутриклеточным гемолизом – анемия, желтуха, спленомегалия. Лабораторные: билирубин (свободный), стеркобилиноген в кале (кал темного цвета) и моче, осмотическая резистентность эритроцитов. Гемолитические анемии с внутрисосудистым гемолизом Чаще приобретенные заболевания. Развиваются остро под воздействи-ем неблагоприятных факторов – токсинов, лекарств и др. Патогенез: гемолиз проходит в капиллярах почек → избыток (более 1 г/л) Hb →↑ свободного Hb (не связанного с гаптоглобином) → проходит через почечный фильтр (гемоглобинурия) → частичное разрушение Hb при прохождении через почечные канальцы, отложение в эпителии канальцев и образование гемосидерина → гемосидеринурия. Лабораторные признаки: гемоглобинемия за счет счет свободного Нв, гемоглобинурия, гемосидеринурия. Тактика лечения зависит от вида гемолиза: при внутриклеточном гемолизе показана спленэктомия, при внутрисосудистом – не показана. Лаборатория: ●Ретикулоцитоз (при обычном окрашивании полихроматофилы) ●Увеличение концентрации гаптоглобина в сыворотке ●Билирубинемия за счет свободного ●Увеличение стеркобилина в моче ●Раздражение красного ростка КМ ●Изменение морфологии эритроцитов (микросфероцитоз, овалоцитоз, акантоцитоз), ●Тельца Гейнца в эритроцитах ●Гемоглобинурия за счет свободного Нв ●Гемосидеринурия ●Увеличение НвА2 ●Дефицит глюкозо-6-фосфат дегидрогеназы и др ферментов в эритроцитах ●Снижение осмотической резистентности эритроцитов Гемолитические анемии, связанные с нарушением активности ферментов эритроцитов Наследственные (часто с Х-хромосомой) гемолитические анемии с рецессивным типом наследования. Наиболее часто – дефицит глюкозо-6-фосфатдегидрогеназы. Патогенез: нарушается образование восстановленных форм глутатиона (защищает Hb и эритроцитарную мембрану от оксидации) окисление Hb, преципитация Hb внутрисосудистый гемолиз. 8. Апластическая анемия Апластическая анемия (синоним - злокачественная алейкия) - резкое угнетение всех трех ростков кроветворения при отсутствии признаков опухолей кроветворной ткани. Впервые описано Эрлихом в 1888 г. как геморрагический диатез на фоне нервной депрессии кроветворения. Полиэтиологичное заболевание, вызывается экзогенными и эндогенными факторами. Может быть наследственная и приобретенная. Этиология: Химические факторы (бензол, пары ртути, кислот, лаков, красителей и др.) Физические факторы (ионизирующая радиация) Лекарства (цитостатики, антибиотики, противосудорожные) Инфекции, особенно вирусные Эндокринные факторы, например, гипотиреоз Доброкачественные опухоли вилочковой железы Интенсивное кроветворение (гипопластический криз при гемолитических анемиях) Вытеснение нормального кроветворения при лейкозах, метастазах опухолей в КМ Аутоиммунный, изоиммунный механизмы Угнетение синтеза эритропоэтина Спленогенная панцитопения Патогенез: Патоморфологический субстрат–общее угнетение кроветворения – панмиелопатия. Предположительно под влиянием неблагоприятных факторов (или иммунных факторов?) поражается родоначальная стволовая клетка или ее кроветворное микроокружение (обеспечивает регуляцию функций и деление стволовой клетки) → гипопластическая анемия → прогрессирование процесса → вовлечение всех ростков – развивается панцитопения. Иногда в процесс вовлекается только один росток – парциальная красноклеточная аплазия – эритробластофтиз. При этом могут обнаруживаться антиэритроцитарные антитела (чаще G, у некоторых А). Клиника: Слабость, бледность, снижение работоспособности, геморрагический диатез множественной локализации, септические осложнения. При обследовании: учащение пульса, расширение сердца, приглушение тонов, систолический шум преимущественно на верхушке сердца. УЗИ уже в первые месяцы болезни - небольшое увеличение печени, повышение акустической плотности паренхимы и неоднородность ее эхоструктуры. Увеличения селезенки при АА не бывает! При выявлении спленомегалии – пересмотр диагноза. Для подтверждения диагноза обязательно исследование КМ (трепанобиопсия) Прогноз заболевания тем хуже, чем старше пациент. Основное лечение – пересадка КМ. Лаборатория: Периферическая кровь: Нормо- редко гиперхромная анемия Анизо- и пойкилоцитоз незначительный Ретикулоциты отсутствуют, при иммунной природе – небольшой ретикулоцитоз Лейкопения стойкая с нейтропенией (даже при присоединении вторичной инфекции), относительная эозинофилия и/или лимфоцитоз. Тромбоцитопения, макроцитоз тромбоцитов, тромбоцитопатия СОЭ ↑ ( до 30-50 мм/час) Миелограмма: Бедный костный мозг, задержка созревания клеток эритро-, лейкои тромбоцитопоэза. ↓↓↓количество мегакариоцитов(при тяжелой АА не выявляются). ↓ индекс созревания нейтрофилов (N 0,6—0,8, у больных 0,9 до 6,6). Понижается суммарное содержание клеточных элементов нейтрофильного ряда, а процентное содержание лимфоцитов и плазматических клеток повышается. Отмечается задержка созревания эритрои нормобластов. Сидеробласты ↑↑ даже при нормальном содержании железа в сыворотке крови. Исследование трепанобиопата позволяет поставить окончательный диагноз. При ТАА красный КМ почти полностью замещается жировым. 9. Дифференциальная диагностика анемий Гемостаз 1. Какие основные виды гемостаза выделяют? Система гемостаза — биологическая система, обеспечивающая, с одной стороны, предупреждение и остановку кровотечения путем поддержания целостности сосудистой стенки и быстрого локального тромбирования, а с другой — сохранение жидкого состояния крови и ее объема в циркулирующем русле на фоне постоянного обмена плазмы и тканевой жидкости. Функционирование системы гемостаза — сложный саморегулирующийся физиологический механизм, с возможным влиянием на него центральной нервной системы, эндокринной системы, определяющийся в основном взаимодействием следующих компонентов: - сосудистой стенки; - тромбоцитарного звена; - плазменных протеолитических систем — свертывающей, противосвертывающей (фибринолитической), калликреин-кининовой и системы комплемента. «Каскадную» модель процесса свертывания крови была предложена в 1964 г. двумя независимыми группами ученых (E. W. Davie, O. D. Ratnoff, R. G. Macfarlane), где процесс свертывания крови подразделяется на первичный, или сосудисто-тромбоцитарный, гемостаз и вторичный, или коагуляционный, гемостаз, с выделением в последнем «внешнего», «внутреннего» путей активации тромбина и «общего пути». 2. Какие составляющие входят в сосудисто-тромбоцитарный гемостаз и какие функции выполняют? Сосудисто-тромбоцитарный (или первичный) гемостаз обеспечивает остановку кровотечения в сосудах, диаметр которых не превышает 100 мкм. Соответственно в нем участвуют два компонента: 1. Сосудистый: при повреждении сосудов наступает их спазм – самая быстрая первичная реакция системы гемостаза, в результате которой наблюдается временное запустевание капилляров и венул и кровотечение из них в первые 20–30 с не возникает. Спазм вызывают адреналин и норадреналин, выбрасываемые из надпочечников в ответ на боль при травме. Серотонин, адреналин, тромбоксан, которые освобождаются из тромбоцитов в месте повреждения сосуда и факторы, вырабатываемые эндотелием (эндотелин-1 и ангиотензин-II), также оказывают прессорное действие. В норме эндотелий сосудов препятствует тромбообразованию. После повреждения эндотелия (травма, повреждение под влиянием иммунных комплексов, эндо- и экзотоксинов, медиаторов воспаления, протеолитических ферментов, атеросклеротического процесса и т. д.) в эндотелии начинает преобладать прокоагулянтная активность. Тромбогенный потенциал эндотелия обеспечивается: — синтезом тромбоксана А2, фактора некроза опухоли α, VWF, ин- терлейкина-1, F — II, V, XI, эндотелина-I, ингибиторов активатора плазминогена 1-го и 2-го типов. 2. Тромбоцитарный компонент Тромбоциты — кровяные пластинки, вырабатываемые мегакариоцитами костного мозга, представляющие собой безъядерные фрагменты их цитоплазмы. Нормальное содержание тромбоцитов в крови — 150−450 × 109/л. Их диаметр колеблется в пределах от 1 до 5 мкм, а объем составляет около 6–9 мкм3. Средняя продолжительность жизни тромбоцитов — 7–10 дней. Функции тромбоцитов: - Адгезивно-агрегационная (при обнажении субэндотелиального слоя — взаимодействуют с имеющимися в нем коллагеном, VWF и прилипают к краям поврежденного эндотелия, склеиваясь между собой, при этом меняя форму с дискоидной на сферическую и распластываясь с образованием псевдоподий). - Ангиотрофическая (эндотелий постоянно поглощает тромбоциты, используя их для поддержания нормальной структуры и функции стенок сосудов). - Ангиоспастическая (поддерживают спазм поврежденных сосудов, выбрасывая вазоконстрикторные вещества из α-гранул). - Коагуляционная - участвуют в свертывании крови и фибринолизе. - Репаративная -в процессе адгезии выделяют ростовые факторы, которые активируют процессы репарации в месте повреждения сосуда. - Транспортная (на поверхности гликокалиса тромбоцитов могут осаждаться факторы свертывания крови I, V, VIII, X, XI, XII и XIII, транспортируемые тромбоцитами к месту кровотечения. Последовательность событий при образовании тромба при первичном гемостазе: адгезия тромбоцитов, агрегация тромбоцитов, ретракция тромбоцитарного тромба В норме остановка кровотечения из мелких сосудов занимает 2–4 мин. Стимулированные тромбоциты в дальнейшем взаимодействуют с целым рядом F (II, V, VII, VIII, XI, XII), что способствует в дальнейшем формированию фибринового сгустка. Кроме того, на поверхности тромбоцитов формируются комплексы: протромбиназа (состоящий из Xa, Va факторов, кальция и тромбоцитарных фосфолипидов) и комплекс, состоящий из IXa, VIIIa, X факторов. 4. Назовите 2 основные системы плазменного гемостаза. Свертывающая и фибринолитическая? Внутренний (плазменный) путь активации свертывания крови. Все его компоненты находятся в циркулирующей крови. Начинается он с активации фактора XII после контакта с отрицательно заряженной поверхностью субэндотелия при повреждении сосуда. Активации фактора XII способствует также высокомолекулярный кининоген и калликреин, образовавшийся из прекалликреина. Активный фактор ХIIа превращает FIX в активный IХа, который затем активирует FVIII. В последующем активные факторы VIIIa, IXa, ионы Са++ и фосфолипиды мембраны тромбоцитов формируют комплекс, активирующий FX. Внешний (тканевый) путь активации свертывания крови. При повреждении клеточных мембран, в том числе при повреждении эндотелия, в кровь поступает в большом количестве тканевый фактор (тканевый тромбопластин, FIII), который имеет высокую аффинность к плазменному свертывающему фактору VII. Под влиянием тканевого фактора происходит превращение неактивного FVII в активный FVIIa. Далее формируется комплекс тканевый фактор + VIIA + ионы Са++, который активирует FX. Внешний и внутренний пути приводят к образованию активного FХа. Далее формируется протромбиназный комплекс (FХа + FVa+ионы Са++, +тромбоцитарный фосфолипид). 2 фаза — тромбинообразования, или общий путь образования тромбина. Под влиянием протромбиназного комплекса протромбин превраща- ется в тромбин. 3 и 4 фаза — образование фибрина и организация сгустка. Под влиянием тромбина происходит гидролиз фибриногена до фибринопептидов А и В. Кроме того, под влиянием тромбина неактивный FXIII (фибринстаби- лизирующий) превращается в активный ХIIIа, который в присутствии ио- нов Са++ превращает растворимый фибрин-полимер в стабильный фибри- новый сгусток. 5 фаза — фибринолиз. Спустя некоторое время после образования тромба включается система фибинолиза, что приводит к лизису фибринового сгустка и восстановлению проходимости сосуда, заживлению ран. Современная модель вторичного гемостаза включает три фазы: — инициации, или стартового сигнала (образуется комплекс «тканевой фактор (ТФ)/FVIIа» на поверхности субэндотелия в месте повреждения, что сопровождается продукцией тромбина); — усиление процесса (под воздействием тромбина активируется целый ряд коагуляционных факторов); — распространение процесса (формируются теназный (VIIIа/IXа) и протромбиназный (Vа/Xа/кальций/фактор III тромбоцитов) комплексы, что провоцирует так называемый тромбиновый взрыв и образование стабильного сгустка фибрина). Главным компонентом фибринолитической системы является фермент плазмин (фибринолизин), который путем гидролиза отщепляет от фибрина растворимые пептиды, способствуя тем самым непосредственному растворению тромба. - Внутренний механизм активации фибринолиза обеспечивается преимущественно активированным фактором Хагемана (XIIa) и его фрагментом (XIIF) в комплексе с калликреином и высокомолекулярным кининогеном. - Внешний механизм активации фибринолиза происходит посредством тканевых активаторов плазминогена, которые содержатся в сосудистом эндотелии, эритроцитах, тромбоцитах, лейкоцитах, желчи, слюне. Одним из тканевых активаторов является урокиназа (присутствует в плазме крови и моче, синтезируется в юкстагломерулярном аппарате почек). 7. Какие факторы относятся к витамин-К-зависимым и одновременно Са-зависимым? Для чего нужны ионы Са и витамин К? (II, VII, IX, X, Пр С, S) Тромбоцитарные (клеточные, пластинчатые) факторы свертывания крови: · Фактор 1 — тромбоцитарный глобулин-акцелератор. По своему действию идентичен V плазменному фактору свертывания крови. · Фактор 2 — фибринопластический фактор (акцелератор тромбина). Ускоряет превращение фибриногена в фибрин. · Фактор 3 — тромбоцитарный тромбопластин. · Фактор 4 — антигепариновый фактор. Предотвращает ингибирующее действие антитробина III (плазменного кофактора гепарина) на тромбин крови. · Фактор 5 — свертываемый фактор (тромбоцитарный фибриноген). Участвует в формировании рецепторов тромбоцитов к фибриногену плазмы крови. · Фактор 6 — тромбостенин. Сократительный белок тромбоцитов (актимиозиновый комплекс), обеспечивающий ретракцию тромба. · Фактор 7 — антифибринолитический фактор. · Фактор 8 — активатор фибринолиза. · Фактор 9 — фибринстабилизирующий фактор. По действию аналогичен XIII плазменному фактору свертывания крови. · Фактор 10 — серотонин. · Фактор 11 — АДФ. Группа протромбина — II, VII, IX, X. Эти факторы являются витамин К-зависимыми, т. е. содержание их зависит от поступления витамина К в организм. Активность этих факторов угнетается при приеме пероральных антикоагулянтов. Протеин С и его кофактор протеин S синтезируются в печени и являются витамин К-зависимыми антикоагулянтами. Активация комплекса «протеин С-протеин S» происходит под действием комплекса тромбин — тромбомодулин, фиксированного на поверхности эндотелия сосудистой стенки. Как упоминалось ранее, тромбин, после связывания с мембранным тромбомодулином, теряет свою прокоагулянтную активность, но приобретает способность активировать протеин С. Основной функцией комплекса «протеин С–протеин S» является ингибирование факторов свертывания Va и VIIIa за счет протеолиза их тяжелых цепей. Кроме того, данный комплекс тормозит процесс фибринолиза. Карбоксилирование остатков глутаминовой кислоты в проферментах прокоагулянтного пути катализирует карбоксилаза, коферментом которой служит восстановленная форма витамина К (нафтохинона) - дигидрохинон витамина К. Поступивший в организм витамин К (нафтохинон) восстанавливается в печени NADPH-зависимой витамин К редуктазой с образованием дигидрохинона витамина К. В ходе реакции кар-боксилирования остатков глутаминовой кислоты в проферментах прокоагулянтного пути дигидрохинон окисляется и эпоксидируется с образованием 2,3-эпоксида витамина К. Взаимодействие ферментных комплексов с клеточными мембранами происходит с участием ионов Са2+. Все проферменты прокоагулянтного пути (II, VII, IX, X) содержат остатки гамма-карбоксиглутаминовой кислоты, образующиеся в результате посттрансляционой модификации этих белков в ЭР гепатоцитов. Остатки γ-карбоксиглутаминовой кислоты в факторах VIIa, IXa и Ха обеспечивают взаимодействие этих ферментов посредством Са2+ с отрицательно заряженными фосфолипидами клеточных мембран. Фактор IIа фиксируется на мембранном ферментном комплексе Xa-Va-Са2+, взаимодействуя, с одной стороны, остатками γ -карбоксиглутамата с Са2+, а с другой - непосредственно с белком-активатором Va. Таким образом, создаются наилучшие стерические условия для протекания ферментативной реакции. В отсутствие ионов Са2+ кровь не свёртывается. 9. Расскажите о внешнем пути свертывания плазмы крови. Во внешнем пути свертывания крови участвуют тромбопластин (тканевой фактор, фактор III), проконвертин (фактор VII), фактор Стюарта (фактор X), проакцелерин (фактор V), а также Са2+ и фосфолипиды мембранных поверхностей, на которых образуется тромб (рис. 32). Гомогенаты многих тканей ускоряют свёртывание крови: это действие называют тромбопластиновой активностью. Вероятно, она связана с наличием в тканях какого-то специального белка. Факторы VII и X - проферменты. Они активируются путём частичного протеолиза, превращаясь в протеолитические ферменты - факторы VIIа и Xа соответственно. Фактор V – это белок, который при действии тромбина превращается в фактор V', который не является ферментом, но активирует фермент Xа по аллостерическому механизму; активация усиливается в присутствии фосфолипидов и Са2+ В плазме крови постоянно содержатся следовые количества фактора VIIа. При повреждении тканей и стенок сосуда освобождается фактор III – мощный активатор фактора VIIа; активность последнего увеличивается более чем в 15000 раз. Фактор VIIа отщепляет часть пептидной цепи фактора X, превращая его в фермент - фактор Xа. Сходным образом Xа активирует протромбин; образовавшийся тромбин катализирует превращение фибриногена в фибрин, а также превращение предшественника трансглутаминазы в активный фермент (фактор XIIIа). Под влиянием тромбина от фибриногена отщепляются 2 пептида А и 2 пептида В. Фибриноген превращается в хорошо растворимый фибрин-мономер, который быстро полимеризуется в нерастворимый фибринполимер при участии фибринстабилизирующего фактора XIII (трансглутаминаза) в присутствии ионов Са2+ (рис. 33). Этот каскад реакций имеет положительные обратные связи, усиливающие конечный результат. Фактор Xа и тромбин катализируют превращение неактивного фактора VII в фермент VIIа; тромбин превращает фактор V в фактор V', который вместе с фосфолипидами и Са2+ в 104–105 раз повышает активность фактора Xа. Благодаря положительным обратным связям скорость образования самого тромбина и, следовательно, превращения фибриногена в фибрин нарастают лавинообразно, и в течение 10-12 с кровь свертывается. Фибриновый тромб прикрепляется к матриксу в области повреждения сосуда при участии белка фибронектина. Вслед за образованием нитей фибрина происходит их сокращение, для чего необходима энергия АТФ и фактор 8 тромбоцитов (тромбостенин). Протромбиновый тест (ПТ) ПТ является тестом на внешний (быстрый) механизм гемокоагуляции. В свертывании крови по внешнему пути участвуют витамин К-зависимые факторы VII, Х, фактор V, и тканевой фактор (ТФ) или тканевой тромбопластин, который запускает реакцию свертывания крови. При физиологических условиях ТФ попадает в кровь из поврежденных или разрушенных клеток, в том числе лейкоцитов, макрофагов, клеток опухолей, и активирует процесс свертывания крови. Снижение активности наблюдается при недостатке факторов свертывания крови из-за естественного или индуцированного лекарствами снижения синтеза. Проторомбиновый тест в коагулограмме выражается двумя показателями: 1. Активность факторов протромбинового комплекса по Квику в %. Это принятый в мире способ выражения ПТ. Расчет проводится по калибровочному графику, построенному при разведении донорской (контрольной) плазмы. Не соответствует принятому только в России протромбиновому индексу (ПТИ Клиническая интерпретация: Повышение активности (увеличение %) — склонность к тромбофилии. Снижение активности (снижение %): · Наследственный или приобретенный дефицит I, II, V, VII и X факторов. · Идиопатическая семейная гипопротромбинемия. · Приобретенная и наследственная гипофибриногенемия. · Дефицит витамина К в диете (II, VII, IХ и X факторы образуются в гепатоцитах в присутствии витамина К). · Дефицит витамина К у матери (геморрагический диатез у новорожденного). · Прием лекарственных средств — антагонистов витамина К (антикоагулянтов непрямого действия — варфарина и др.), и усиливающих их действие препаратов: анаболических стероидов, клофибрата, глюкагона, тироксина, индометацина, неомицина, оксифенбутазона, салицилатов; гепарина, урокиназы и др.). 2. МНО (международное нормализованное отношение). · Используется только при лечении антикоагулянтами непрямого действия (варфарин и др.). Для скринига и оценки функции печени не используется. · Оптимальные пределы МНО, которые должны быть достигнуты в ходе лечения антикоагулянтами непрямого действия, зависят от терапевтических целей и определяются лечащим врачом. · МНО и протромбин по Квику коррелируют отрицательно — снижение протромбина по Квику соответствует повышению МНО 10. Что относится к непрямым антикоагулянтам? Антикоагулянты непрямого действия (дикумарин, варфарин, неодикумарин, или пелентан, фенилин, синкумар и др.), нарушающие образование протромбина в печени, участвующего в свёртывании крови. Антикоагулянты непрямого действия — производные оксикумарина, индандиона, конкурентно ингибируют редуктазу витамина К, чем тормозят активирование последнего в организме и прекращают синтез К-витаминзависимых плазменных факторов гемостаза — II, VII, IX, X n Контроль за лечением непрямыми антикоагулянтами - Протромбин + МНО, Количество тромбоцитов (клинический анализ крови на гематологическом анализаторе). 11. Расскажите о внутреннем пути свертывания плазмы крови. Свертывание крови по внутреннему механизму происходит значительно медленнее и требует 1015 мин. Этот механизм называют внутренним, потому что для него не требуется тромбопластин (тканевой фактор) и все необходимые факторы содержатся в крови (рис. 32). Внутренний механизм свёртывания также представляет собой каскад последовательных активаций проферментов. Начиная со стадии превращения фактора X в Xа, внешний и внутренний пути одинаковы. Как и внешний путь, внутренний путь свертывания имеет положительные обратные связи: тромбин катализирует превращение предшественников V и VIII в активаторы V' и VIII', которые в конечном итоге увеличивают скорость образования самого тромбина. Внешний и внутренний механизмы свертывания крови взаимодействуют между собой. Фактор VII, специфичный для внешнего пути свёртывания, может быть активирован фактором XIIа, который участвует во внутреннем пути свертывания. Это превращает оба пути в единую систему свёртывания крови. АЧТВ (активированное частичное тромбопластиновое время). Тест на внутренний путь свертывания крови. В свертывании крови по внутреннему пути участвуют 3 витамин Кзависимых фактора (II, IX, X), фактор XII, высокомолекулярный кининоген (ВМК), прекалликреин (ПК), а также антигемофильные глобулины А (фактор VIII:C), В (фактор X) и С (фактор XI). Активация внутреннего пути в организме происходит при повреждении сосудистой стенки, контакте с чужеродной поверхностью, при избытке адреналина, биогенных аминов, циркулирующих иммунных комплексов и др. Снижение активности — при недостаточности факторов, в том числе антгемофильных глобулинов, избытке антикоагулянтов (гепарин, волчаночные антикоагулянты и др.). Клиническая интерпретация Укрочение АЧТВ — признак тромбофилии или синдрома ДВС. Удлинение АЧТВ: ДВС, снижение синтеза факторов свертывания при заболеваниях печени, массивные гемотрансфузии, введение гепарина (удлинение АЧТВ в 1,5-2 раза), дефицит факторов внутреннего пути, дефицит витамина К, присутствие ингибиторов свертывания, наличие волчаночного антикоагулянта (ВА), наличие гемофилии 12. Какова физиологическая роль противосвертывающей системы? Противосвертывающая система крови. В здоровом организме, особенно при заболеваниях, существует угроза внутрисосудистого тромбообразования. Однако кровь остается жидкой, так как существует сложный физиологический механизм, обуславливающий резистивность организма против внутрисосудистого свертывания и тромбообразования. Это противосвертывающая система крови. Это сложная система, основу действия которой составляют химические ферментативные реакции между факторами свертывающей и пртивосвертывающей систем. Вещества, препятствующие свертыванию крови, называются антикоагулянтами. Естественные антикоагулянты вырабатываются и содержатся в организме. Они бывают прямого и непрямого действия. К антикоагулянтам прямого действия относится, например, гепарин (образуется в печени). Гепарин препятствует действию тромбина на фибриноген и угнетает активность — инактивирует целый ряд других факторов свертывающей системы. Антикоагулянты непрямого действия угнетают образование активных факторов свертывания. Работа свертывающей и противосвертывающей систем, их взаимодействие в организме находятся под контролем центральной нервной системы. Факторы, поддерживающие жидкое состояние крови: 1. тромборезистентность эндотелия стенки сосуда; 2. неактивное состояние плазменных факторов свертывания крови; 3. присутствие в крови естественных антикоагулянтов; 4. наличие системы фибринолиза; 5. непрерывный циркулирующий поток крови. Тромборезистентность эндотелия сосудов обеспечивается за счет антиагрегантных, антикоагулянтных и фибринолитических свойств. Антиагрегантные свойства: · синтез простациклина, который обладает антиагрегационным и сосудорасширяющим действием; · синтез оксида азота, обладающего антиагрегационным и сосудорасширяющим действием; · синтез эндотелинов, которые сужают сосуды и препятствуют агрегации тромбоцитов. Антикоагулянтные свойства: · синтез естественного антикоагулянта антитромбина III, который инактивирует тромбин. Антитромбин III взаимодействует с гепарином, образуя антикоагуляционный потенциал на границе крови и стенки сосуда; · синтез тромбомодулина, который связывает активный фермент тромбин и нарушает процесс образования фибрина за счет активации естественного антикоагулянта протеина С. Фибринолитические свойства обеспечиваются синтезом тканевого активатора плазминогена, который является мощным активатором системы фибринолиза. 13.Какими веществами представлены физиологические антикоагулянты? Физиологические антикоагулянты разделяют на первичные и вторичные. Первичные антикоагулянты синтезируются в основном клетками неповреждённого эндотелия и с постоянной скоростью выделяются в кровоток. Там они нейтрализуют факторы коагуляции, поэтому кровь остаётся в жидком состоянии. Вторичные образуются в результате коагуляционных реакций и фибринолиза, тормозят свёртывание по механизму отрицательной обратной связи. К первичным антикоагулянтам относятся: антитромбин III; гепарин; протеин С; протеин S; ингибитор внешнего пути свертывания (TFPI); гепариновый кофактор II. ингибиторы протеаз. 1) антитромбин III - основной универсальный антикоагулянт, являющийся ингибитором протеаз. Синтезируется эндотелием сосудов, угнетает активность всех протеолитических ферментов крови, в том числе тромбина, калликреина, плазмина, ф.ХIIа, ф.ХIа, ф.Ха, ф.IХа; 2) гепарин (антитромбин II) - гликозаминогликан, освобождающийся тканевыми базофилами и базофилами крови при их дегрануляции. Антикоагулянтными свойствами обладает не сам гепарин, а комплекс гепарина с антитромбином III. Благодаря гепарину антитромбин III фиксируется на поверхности эндотелия сосудов, где его антикоагулянтные свойства во много раз возрастают; 3) α1-антитрипсин, α2-макроглобулин, ингибитор С1-компонента комплемента все они являются неспецифическими ингибиторами протеаз, в том числе и факторов свертывания крови. Другим ингибитором свертывания является гепариновый кофактор II. Его действие усиливается во много раз при взаимодействии с гепарином, однако клиническая значимость его невелика. К антикоагулянтам относится ингибитор внешнего пути свертывания (TFPI). Установлено, что он тормозит комплекс VIIа и III тканевого факторов и образование ф.Xа по внешнему пути коагуляции. Плазменные гемостатические и антигемостатические сериновые протеиназы находятся под контролем растворимых ингибиторов, большинство которых принадлежит к семейству так называемых серпинов («serine prоtease inhibitors») и кунинов. Это важные факторы, локализующие фибринообразование и фибринолиз. 14.Что относится к прямым антикоагулянтам? Прямые антикоагулянты (гепарин и его препараты, гирудин, гидроцитрат натрия, концентрат антитромбина III) – вызывают эффект in vitro и in vivo; Гепарин – новогаленовый лекарственный препарат, получаемый из легких и печени крупного рогатого скота. Он является сильнейшей органической кислотой из–за остатков входящей в его состав серной кислоты и наличия карбоксильной групп, что придает ему очень сильный отрицательный заряд. Поэтому он, собственно, и относится к анионным полиэлектролитам. Благодаря отрицательному заряду, в крови гепарин соединяется с положительно заряженными комплексами, сорбируется на поверхности мембран эндотелиальных клеток, макрофагов, ограничивая, тем самым, агрегацию и адгезию тромбоцитов. Действие гепарина во многом зависит от концентрации в плазме антитромбина III. Фармакологические эффекты гепарина: 1) гепарин обладает антикоагуляционным эффектом, так как он активирует антитромбин III и необратимо угнетает IXa,Xa,XIa и XIIa факторы свертывающей системы; 2) умеренно снижает агрегацию тромбоцитов; 3) гепарин снижает вязкость крови, уменьшает проницаемость сосудов, чем облегчает и ускоряет ток крови, препятствует развитию стаза (одного из факторов, способствующих тромбообразованию); 4) снижает содержание сахара, липидов и хиломикронов в крови, обладает антисклеротическим эффектом, связывает некоторые компоненты комплимента, угнетает синтез иммуноглобулинов, АКТГ, альдостерона, а также связывает гистамин, серотонин, проявляя, тем самым, противоаллергический эффект; 5) гепарин обладает калийсберегающим, противовоспалительным, анальгезирующим эффектами. Кроме того, гепарин способствует повышению диуреза и снижает сосудистое сопротивление за счет расширения резистивных сосудов,устраняет спазм коронарных артерий. Показания к применению: 1) при острых тромбозах, тромбоэмболиях (острый инфаркт миокарда, тромбоз ле гочной артерии,почечных вен,илеоцекальных сосудов),тромбоэмболия у беременных; 16. Какой лабораторный показатель и почему надо контролировать при лечении гепарином? Антитромбин III – белок, входящий в систему регуляции свертываемости крови. Он является антикоагулянтом, предотвращает образование тромбов и препятствует избыточному свертыванию крови, замедляя и нейтрализуя действие тромбина и факторов свертывания Xa, IXa и XIa. Синтезируется антитромбин III клетками печени и эндотелием. Активность AT в десятки тысяч раз усиливается в присутствии отрицательно заряженных гликозаминогликанов, таких, как гепарансульфат, входящих в структуру гликокаликса на поверхности эндотелиальных клеток. Аналогичное потенцирующее действие на AT оказывает гепарин. Антикоагулянтное действие гепарина связано с его способностью вызывать конформационные изменения AT. Снижение АТ на 60% повышает риск развития вторичных тромбозов 17. какие составляющие входят в фибринолитическую систему? 18. Как называют основной фермент фибринолиза и в каком состоянии он находится в плазме крови? Урокиназа- фермент, синтезирующийся в эпителии почечных канальцев, превращающий плазминоген в плазмин. Как прямой активатор плазминогена, фермент способен проникать в тромб и превращать в нем плазминоген в плазмин посредством гидролиза аргинин-валиновой связи. Плазмин разрушает фибрин, в результате чего происходит растворение тромба. В плазме крови находится в активном состоянии, т к обратного в литературе сказано не было…. 21. Что входит в понятие тромбофилии? Тромбофилия — врождённое или приобретённое патологическое состояние, которое характеризуется нарушением свёртываемости крови и увеличением риска образования тромбов. Она отличается длительностью течения и внезапными осложнениями в виде формирования тромба в вене, его фиксацией к стенке с развитием воспалительных процессов (флеботромбоз) или закупорки кровеносных сосудов тромбом (тромбоэмболия). Следует учитывать, что не всегда тромбофилия сопровождается тромбозом и тромбоэмболией, однако у больных тромбофилией возрастает риск возникновения тромбоза различной локализации. У лиц, страдающих тромбофилией, отмечается повышенное содержание белков, повышающих тромбообразование и снижение уровня антисвертывающих белков, что обеспечивает склонность к образованию тромботических масс в просвете сосудов. Общепризнанная этиопатогенетическая классификация тромбофилий выделяет три основных типа заболевания: — гематогенная тромбофилия, обусловленная изменениями свертывающих, противосвертывающих и фибринолитических свойств крови; (недостаток антитромбина III, дефицит протромбинов S и С, мутации генов фактора V и протромбина, дисфибриногенемия) — сосудистая тромбофилия, связанная с патологией сосудов (атеросклероз, эндартериит, васкулит); — гемодинамическая тромбофилия, обусловленная нарушением в системе кровообращения. (врожденные аномалии сосудов и др…) 23. Основные причины гиперкоагуляции Гиперкоагуляция — медицинский термин, означающий состояние повышенной активности свертывающий системы крови. Гиперкоагуляция крови может быть вызвана самыми разнообразными причинами, среди которых: Вынашивание ребенка. Кровь сгущается из-за происходящих в организме изменений. · Рвота и диарея, учащенное мочеиспускание на фоне сахарного диабета, патологии мочевыделительной системы, заболевания легких, травмы и ожоги – все эти факторы способны спровоцировать развитие гиперкоагуляции крови. Чем быстрее организм теряет запасы жидкости, тем гуще у него становится кровь. Обезвоживание негативным образом сказывается на работе головного мозга, на состоянии сердечно-сосудистой системы. Чтобы прервать прогрессирование гиперкоагуляции, необходимо прекратить дальнейшее обезвоживание и восстановить водно-натриевый баланс в организме. Прием лекарственных средств, например, гормональных контрацептивов, негативным образом сказывается на текучести крови, сгущая ее. После отказа от препаратов данной группы, концентрация крови нормализуется. Погрешности в питании, употребление слишком жирных продуктов влечет за собой повышение уровня холестерина в крови, что делает кровь густой и вязкой. Чтобы она продолжала течь по сосудам, сердцу приходится работать в усиленном режиме. Проникновение в организм патогенных агентов: вирусов, бактерий, паразитов. Наследственные и приобретенные в течение жизни ферментопатии способствуют замедлению тока крови и ее сгущению. Патологии печени, такие как гепатит и цирроз, вызывают нарушение микроциркуляции и проблемы с питанием тканей. · Раковые заболевания: миома, гемангиома, липома лейкозы, миелома. Наследственная предрасположенность к гиперкоагуляции крови. Патологии кровеносной системы: тромбофилия, атеросклеротическая болезнь, эритремия, варикоз, ДВС-синдром. Вредные привычки и ведение нездорового образа жизни: курение, недостаточная двигательная активность. Проведенные операции на сердечных клапанах. · Системные патологии: системная красная волчанка, васкулит, склеродермия. Механизмы, которые приводят к развитию гиперкоагуляции: Увеличение количества прокоагулянтов в крови, повышение их активности. Подобная ситуация развивается на фоне тромбоцитоза, гиперфибриногенемии, гиперпротромбинемии. · Шок, сепсис, ожог, ДВС-синдром – все эти состояния способствуют увеличению активности антикоагулянтов. Тромботический синдром, поврежденные сосудистые стенки, васкулит, атеросклероз – подобные нарушения вызывают нехватку фибринолитических факторов крови и провоцируют сбои в их работе. 24. Что такое антифосфолипидный синдром. Какие тесты используют для диагностики. Антифосфолипидный синдром (АФС), или фосфолипидный синдром, или синдром антифосфолипидных антител (АФС или САФА) — аутоиммунное состояние гиперкоагуляции, вызванное антифосфолипидными антителами. АФС провоцирует образование тромбов (тромбоз) как в артериях, так и венах, а также связанные с беременностью осложнения, такие как выкидыш, мертворождение, преждевременные роды и тяжелая преэклампсия. Основополагающие причины развития антифосфолипидного синдрома неизвестны. Факторы, предрасполагающие к повышению уровня антител к фосфолипидам. нарастание антифосфолипидных антител наблюдается на фоне вирусных и бактериальных инфекций (гепатита С, ВИЧ, инфекционного мононуклеоза, малярии, инфекционного эндокардита и др.). Высокие титры антител к фосфолипидам у пациентов с системной красной волчанкой, ревматоидным артритом, узелковым периартериитом, аутоиммунной тромбоцитопенической пурпурой. Гиперпродукция антифосфолипидных антител при злокачественных новообразованиях, приеме лекарственных средств (психотропных препаратов, гормональных контрацептивов и др.), отмене антикоагулянтов. (можно не писать) В зависимости от структуры и иммуногенности различают «нейтральные» (фосфатидилхолин, фосфатидилэтаноламин) и «отрицательно заряженные» (кардиолипин, фосфатидилсерин, фосфатидилинозитол) фосфолипиды. К классу антифосфолипидных антител, вступающих в реакцию с фосфолипидами, относятся волчаночный антикоагулянт, Ат к кардиолипину, бета2-гликопротеин-1-кофакторзависимые антифосфолипиды и др. Взаимодействуя с фосфолипидами мембран клеток эндотелия сосудов, тромбоцитов, нейтрофилов, антитела вызывают нарушение гемостаза, выражающиеся в склонности к гиперкоагуляции. Диагностика · Антифосфолипидный синдром диагностируется на основании клинических (сосудистый тромбоз, отягощенный акушерский анамнез) и лабораторных данных. · Основные иммунологические критерии включают выявление в плазме крови средних или высоких титров Ат к кардиолипину класса IgG/IgM и волчаночного антикоагулянта дважды в течение шести недель. · Диагноз считается достоверным при сочетании одного основного клинического и лабораторного критерия. · Дополнительными лабораторными признаками антифосфолипидного синдрома являются ложноположительная RW, положительная реакция Кумбса, повышение титра антинуклеарного фактора, ревматоидного фактора, криоглобулинов, антител к ДНК. Также показано исследование ОАК, тромбоцитов, биохимического анализа крови, коагулограммы. (для справки, можно не читать\писать) 1. Проба Кумбса Прямая проба. Прямая проба в медицинской практике еще называется прямой антиглобулиновый тест и с его помощью удается диагностировать антитела, прикрепленные к поверхности эритроцитов. Непрямая проба. Часто специалисты прибегают к проведению непрямой пробы Кумбса, которая имеет второе название «непрямой антиглобулиновый тест». Основной целью такого исследования является выявление антител к эритроцитам, которые присутствуют в сыворотке крови. 2. Тест Рассела с ядом гадюки Тест с разбавленным ядом гадюки Рассела предназначен для определения волчаночных антикоагулянтов (тип антител,взаимодействующих с фосфолипидами) в человеческой цитратной плазме. 3. Анализ на RW ( ложноположительный RW при АФС) определяет возбудителя сифилиса и специфические антитела к нему, вырабатываемые иммунной системой человека. Ложноположительная реакция У 5% пациентов наблюдается ложноположительная реакция – состояние, когда анализ показывает ++, но пациент не болен. Причинами ложноположительного проявления служат: · туберкулез, системная красная волчанка, лейкемия, проказа, лептоспироз, рак, тиф, скарлатина, ВИЧ и СПИД; · болезнь бери-бери и сонная, гепатит; · у беременных или только что родивших; · во время менструации; · после наркоза, употребления алкоголя, наркотиков, жирной пищи, кофе, сигарет, лекарств, введения некоторых сывороток или вакцинации; · острые инфекции беременных. 25. Что такое геморрагический синдром. Геморрагический синдром – патологическое состояние, характеризующееся повышенной кровоточивостью сосудов и развивающееся как следствие нарушения гомеостаза. Основными причинами появления геморрагического синдрома является: · Нарушение свертывания крови · Повышение сосудистой проницаемости · Тромбоцитопения 5 типов кровоточивости: · Гематомный · Петехиально-пятнистый(синячковый) · Смешанный(синячково-гематомный) · Васкулитно-пурпурный · Ангиоматозный 1. Петехильно-синячковый (микроциркуляторный) тип характеризуется появлением безболезненных точечных (петехии) или мелкопятнистых (экхимозы) кровоизлияний в кожу и «синяков» при незначительных ушибах, в местах давления и трения одежды, в местах инъекций, при измерении артериального давления и т.д. Часто сочетается с повышенной кровоточивостью слизистых оболочек (носовые кровотечения, меноррагии). Петехиально-синячковая кровоточивость характерна для тромбоцитопений, тромбоцитопатий, болезни Виллебранда, гиповитаминоза С, дисфункций тромбоцитов эндокринного (дизовариального) генеза. В связи с вторичной патологией тромбоцитов и их дефицитом отмечается также при острых лейкозах, гипои апластических анемиях, уремии. дефицит II,V,X факторов свёртывания крови. Для диагностики применяются пробы, показывающие повышенную ломкость капилляров – щипок, жгут. Лабораторные анализы показывают увеличение времени капиллярного кровотечения. При этом время свертывания крови не изменяется. Проба щипка. Врач собирает под ключицей кожу и делает щипок. В норме изменений кожи не происходит. При снижении резистентности капилляров на месте щипка появляются петехии или кровоподтеки, особенно через 24 часа. Проба жгута или манжеточная проба (проба Кончаловского). Отступив на 2 см книзу от локтевого сгиба, очерчивают на внутренней поверхности предплечья круг диаметром 5 см. На плечо накладывают манжету тонометра, соединяют с манометром и поддерживают давление на уровне 90-100 мм рт.ст. в течение 5 мин. Затем манжету снимают и ждут восстановления кровотока в руке 5 мин, после чего подсчитывают количество петехий в очерченном круге. · В норме число петехий не превышает 10; · при слабо положительной пробе количество петехий 11-20; · при положительной – 20-30 петехий; · при резко положительной – количество 30 петехий и более. Количество петехий более 10 свидетельствует о снижении резистентности стенки капилляров, что может быть связано с нарушением функционального состояния тромбоцитов, снижением их количества и ангиотрофической функции тромбоцитов, а также с повышением проницаемости капилляров при различных патологических процессах (васкулиты, вазопатии). 2. Гематомный тип характеризуется обширными, болезненными кровоизлияниями в подкожную клетчатку, мышцы, суставы, под надкостницу, отсроченными геморрагиями после травм и хирургических вмешательств, в том числе при порезах, после экстракции зубов, а также носовыми, почечными и желудочнокишечными кровотечениями. Особенно характерно поражение опорно-двигательного аппарата - деформация суставов, ограничение подвижности в суставах, атрофия мышц конечностей и т.д. Такой тип кровоточивости типичен для гемофилий. дефицит VIII,IX,XI факторов свёртывания крови Лабораторные методы диагностики, Чаще всего это увеличение: · а) времени свертывания крови по Ли-Уайту более 10 мин.; · в) АЧТВ более, 50 сек.; · г) времени рекальцификации плазмы более 120 сек.; · д) количество тромбоцитов нормальное. · Наиболее надежными методами исследования при коагулопатиях являются методы определения концентрации в плазме факторов свертывания крови, участвующих в реализации I, II и III фаз коагуляционного гемостаза (VIII, IX, V, VII, I, II, X, XI, XII). · В общем анализе крови, в случае обширных гематом могут быть выявлены признаки анемии (чаще нормохромной), а в первую неделю после возникновения гематом или гемартрозов – нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы влево. · В общем анализе мочи – гематурия, различная по интенсивности (при травмах или обострениях заболевания почек и мочевыводящих путей). 1. Смешанный (петехиально-гематомный) тип характеризуется петехиально-синячковыми высыпаниями, сочетающимися с обширными кровоизлияниями и гематомами (чаще в подкожную и забрюшинную клетчатку, нередко с парезом кишечника) при отсутствии поражений суставов и костей (в отличие от гематомного типа) либо с единичными геморрагиями в суставы. Отмечается при дефиците факторов протромбинового комплекса (факторов II, V, VII, Х), передозировке антикоагулянтов непрямого действия, передозировке гепарина и препаратов фибринолитического действия (стрептокиназа и др.), болезни Виллебранда и синдроме диссеминированного внутрисосудистого свертывания (ДВС) крови. Развивается при тяжелом дефиците факторов протромбинового комплекса и фактора XIII, Главным лабораторным маркером служит выраженное снижение протромбинового индекса коагулограммы. 4. Васкулитно-пурпурный тип проявляется симметричной папулезно-геморрагической сыпью диаметром до 0,5-1 см на нижних или (реже) верхних конечностях и в области нижней части туловища (ягодицы), формирующейся в результате диапедеза эритроцитов через стенку сосуда в связи с повышенной проницаемостью последней. Одновременно могут возникать крапивница, артралгии, острая боль в животе с кишечным кровотечением - меленой (абдоминальная форма), признаки гломерулонефрита. Такой тип кровоточивости специфичен для геморрагического васкулита (болезни Шенлейна-Геноха) и некоторых других системных васкулитов иммунного и инфекционного генеза. Характерной чертой является длительно сохраняющаяся на месте геморрагий синюшно-коричневая пигментация. 5. Ангиоматозный тип характеризуется рецидивирующей кровоточивостью постоянной несимметричной локализации из телеангиэктазов (ангиом мелких сосудов). Такой тип кровоточивости отмечается при телеангиэктазиях (болезнь Рандю-Ослера), при которых сосудистая стенка утрачивает способность к активации факторов гемокоагуляции и тромбообразованию in vivo. При этом сохраняется способность крови к образованию сгустков при контакте с чужеродной поверхностью in vitro. 26. Каковы причины гипокоагуляции. В основе снижения свертываемости крови лежат следующие механизмы: 1. снижение концентрации в крови прокоагулянтов (может быть обусловлен тромбоцитопенией, тромбоцитопатией, недостаточным или нарушенным синтезом различных плазменных факторов свертывания, чрезмерно повышенным потреблением данных факторов в процессе коагуляции); 2. недостаточная активация прокоагулянтов; 3. повышенная концентрация или чрезмерная активация антикоагулянтов; 4. повышенная концентрация или чрезмерное усиление активности фибринолитических факторов. 28. ДВС-синдром. ДВС-синдром (диссеминированное внутрисосудистое свёртывание, коагулопатия потребления, тромбогеморрагический синдром) — это патологический неспецифический процесс, характеризующийся образованием диссеминированных тромбов (фибринных, эритроцитарных и гиалиновых) в сосудах микроциркуляторного русла в сочетании с несвёртываемостью крови, приводящей к множественным массивным кровоизлияниям. Может протекать бессимптомно или в виде остро развившейся коагулопатии. Часто встречается при различной акушерской патологии, различных видах шока, тяжёлых травмах, бактериальном сепсисе. ГЕМОСТАЗ. ПРАКТИКА 1. Чем отличаются понятия гемостазиограммы и коагулограммы? Коагулограмма – исследование только свертывающей системы, входят показатели – АЧТВ, протромбин, МНО, фибриноген, тромбиновое время. Гемостазиограмма является более полным исследованием, включает помимо исследования свертывающей системы еще и противосвертывающую систему, агрегацию тромбоцитов. 2. Чем отличается сыворотка от плазмы крови? Что из них используется для проведения коагулограммы? Сыворотка крови — плазма крови, лишённая фибриногена. Сыворотку получают либо путём естественного свёртывания плазмы (нативные сыворотки), либо осаждением фибриногена ионами кальция. В сыворотках сохранена большая часть антител, а за счёт отсутствия фибриногена резко увеличивается стабильность. Гемостаз смотрят в плазме, соответственно для проведения коагулограммы используется плазма. 3. Что такое обогащенная, бедная тромбоцитами плазма? Каковы способы их получения и области применения? Богатая тромбоцитами плазма – плазма крови с повышенным содержанием тромбоцитов (в норме от 150 до 400 тыс/мкл, в обогащенной около 1 млн/мкл). Из лабораторных исследований на богатой тромбоцитами плазме оценка клеточного звена. проводятся оценка агрегационной способности тромбоцитов, Бедная тромбоцитами плазма – плазма крови со сниженным содержанием тромбоцитов. На бедной тромбоцитами плазме проводятся такие лабораторные исследования как определение факторов свертываемости, коагулограмма. Способы получения отличаются только числом оборотов: богатая – 1500 об/мин, бедная – 3000 об/мин. 4. Какой антикоагулянт используется для оценки гемостаза и почему? Для оценки гемостаза используется цитрат натрия (механизм действия - связывает ионы кальция в крови, тем самым предотвращает процесс свертывания). 5. Назовите основные правила забора и хранения образцов крови на гемостаз, а также сроки проведения анализов. Важно, чтобы при забое крови пробирка была набрана полностью до отметки, тогда будет сохраняться соотношение кровь-цитрат 9 к 1. При нарушении соотношения возможен неправильный результат исследования. Бракуются пробирки, если в них обнаружен сгусток или микросгусток, пробирки с обнаруженным гемолизом. Также бракуются иктеричные пробы, т.е. с высоким билирубином (на хромогенные методы, которые основаны на образовании окрашенных продуктов). Сроки выполнения: 6 часов – максимум, обычно 4 часа. При отсрочке (удаленном исследовании) кровь центрифугировать, отобрать плазму и заморозить при минус 40 (мгновенная заморозка). Но так никто особо не делает, ибо все равно происходит денатурация, при белковой патологии плохо, так как быстрая заморозка и разморозка вызывает отклонения в результатах. Цельная кровь исследуется в течение часа – позже образуются агрегаты, происходят взаимодействия клеток и т.п. 7. какими методами происходит подсчет тромбоцитов? Какими методами оценивается функции тромбоцитов? Выделяют три методики для подсчета кровяных пластинок в капиллярной крови: использование камеры Горяева; методика по Фонио; использование полуавтоматического анализатора. Для исследования выбирать венозную кровь. К крови добавляют раствор ЭДТА, который препятствует образованию сгустка. В пробирку наливают 0,02 мл крови, добавляют 4 мл раствор оксалата аммония 1%. Получившуюся массу перемешивают. В течение 30 минут должен произойти полный гемолиз красных кровяных телец. Пипеткой отбирают полученную жидкость, добавляют в камеру Горяева. Тромбоциты считают в 25 больших квадратах. X=a×250×200/25 X – число тромбоцитов на 1 мкл биологической жидкости; a - количество тромбоцитов в 25 квадратах; 200 – разведение крови; 25- количество квадратов; 1/250 – объем одного квадрата. Подсчет тромбоцитов в мазке крови (по Фонио) Для методики используют капиллярную кровь, взятую из пальца. Ее помещают в капилляр, добавляют один из следующих реактивов, препятствующих образованию сгустка: раствор ЭДТА 2, 6%; Жидкость необходимо тщательно перемешать. Каплю разведенной крови добавляют на предметное стекло, размазывает пластиковым шпателем. Полученный мазок фиксирует с помощью метода по Романовскому-Гимзе. Подсчет тромбоцитов в анализаторе Для метода подсчета количества тромбоцитов используют капиллярную или венозную кровь. Добавляет антикоагулянт, чтобы она не свернулась. Если это произойдет, потребуется повторное изъятие биологической жидкости. Жидкость подносят к полуавтоматическому анализатору, который забирает объем жидкости, равный 1 мл. К скрининговым тестам изучения функции тромбоцитов: времени кровотечения определения адгезивности тромбоцитов Ретракция кровяного сгустка Агрегация ( АДФ и тд) Тромбоэластограмма 8. с какой целью используется тромбоэластограмма? Основная суть тромбоэластограммы – оценка гемостаза посредством интегрального характера. Основной принцип работы аппарата, который называется тромбоэластограф, основан на оценке главных физических свойств кровяного сгустка. Исследование позволяет установить повышенный риск для появления тромбоза, тромбов или других патологий свертывающей системы крови. Небольшое количество крови (обычно около 0,4 мл) помещается в кювету, которая совершает медленные (6 раз в минуту) вращательные колебания на несколько (4,5º) градусов. В камеру помещается стержень датчика и добавляются активаторы свертывания. Когда в кювете формируется сгусток, стержень начинает вращаться вместе со сгустком. Амплитуда отклонения стержня регистрируется как функция времени. На типичной кривой тромбоэластографии можно выделить разнообразные параметры, характеризующие как скорость формирования сгустка, так и его финальные характеристики. 9. какие методы используются для оценки плазменного звена гемостаза? Ч.т. клоттинговые тесты? Скрининговые тесты: АПТВ (активированное парциальное тромбопластиновое время Методика заключается в смешивании исследуемой плазмы с каолином (активатором свертывания) и фосфатидилэтаноламином и измерении времени до образования сгустка. Снижение времени АЧТВ свидетельствует о гиперкоагуляции, а повышение – о гипокоагуляции протромбиновое время (по Квику) определения ак-тивности фактора VII, контроля за лечением антивитамин К-препаратами, общем скрининге системы гемостаза. Измеряется время образования сгустка после добавления к плазме тромбопластина, фосфолипидов и хлорида Ca2+. тромбиновое время заключается в определении времени свертывания цитратной плазмы при добавлении раствора тромбина со стандартной активностью. Показатель характеризует конечный этап свертывания крови – скорость превращения фибриногена в фибрин под влиянием тромбина, и зависит от концентрации фибриногена и продуктов его деградации в крови. Фибриноген активируют свертывание точного объема плазмы добавлением избытка хлорида кальция, после чего образованный сгусток отжимают и взвешиваю Клоттинговые (3.22) - определение клоттингового времени или времени образования сгустка: мануальное определение по конечной точке автоматическое определение по конечной точке В клоттинговых исследованиях конечной точкой для определения времени свертывания (клоттингового времени) является трансформация фибриногена в фибрин. Макроскопически видный сгусток состоит из фибриновых нитей. Образование фибринового сгустка, как индикатора свертывания, представляет собой основу клоттинговых тестов как в прошлом, так и в настоящее время. Клоттинговые(от англ. clot –сгусток) методы основаны на измерении промежутка времени с момента внесения реагента, запускающего ферментативный процесс свертывания плазмы (каскад реакций), до момента коагуляции – образования фибринового сгустка (нитей фибрина). При скрининговых исследованиях системы гемостаза применяются клоттинговые методы – протромбиновый тест (ПВ, МНО, процент по Квику), концентрация фибриногена (по Клаусу, в г/л), активированное частичное тромбопластиновое время (АЧТВ), тромбиновое время (ТВ), а также, при расширенном обследовании, – активность факторов II, V, VII, IX, X, XI, XII, активность антитромбина, активность системы протеина С. Для измерения времени образования сгустка в клоттинговых тестах используют приборы, называемые коагулометрами, анализаторами свертывания крови (АСК) или анализаторами показателей гемостаза (АПГ).Они бывают полуавтоматическими и автоматическими. В автоматических коагулометрах все элементы аналитического процесса выполняются без участия человека. В полуавтоматических анализаторах дозирование плазмы и реагентов осуществляет лаборант, а измерение времени образования сгустка и расчеты результатов анализа выполняет прибор. На основе принципа регистрации момента выпадения сгустка - выделяют оптические, механические и оптико-механические типы коагулометров. 7)Какими методами осуществляется подсчет тромбоцитов? Какими способами оценивается функция тромбоцитов? Подсчет количества тромбоцитов в крови осуществляется преимущественно 3 методами: в счетной камере с использованием фазово-контрастного устройства, в окрашенных мазках крови по Фонио и с помощью гематологических анализаторов. Подсчет в камере Горяева Метод подсчета тромбоцитов в камере Горяева является самым точным, но достаточно трудоемким. Подсчет тромбоцитов в 1 л проводится по стандартной методике с учетом разведения крови и объема большого квадрата счетной сетки Горяева с применением фазово-контрастного микроскопа для лучшего контрастирования тромбоцитов. Исследуемую кровь разводят в 200 раз раствором аммония оксалата или раствором, содержащим кокаина гидрохлорид, натрия хлорид, фурациллин и дистиллированную воду. Разведенную кровь перемешивают и оставляют на 30 минут для гемолиза эритроцитов. Заполняют камеру Горяева и подсчитывают тромбоциты в 25 больших квадратах. Практически для расчета количества тромбоцитов в 1 л крови число сосчитанных в 25 больших квадратах кровяных пластинах умножают на 2х106. Метод подсчета тромбоцитов в окрашенных мазках крови основан на подсчете числа тромбоцитов на 1000 эритроцитов с последующим пересчетом на 1 л крови. Кровь смешивают с раствором магнезии сульфата или ЭДТА. Мазки готовят на предметных стеклах и окрашивают их по Романовскому-Гимзе. В каждом поле зрения микроскопа подсчитывают число эритроцитов и тромбоцитов, передвигая мазок до тех пор, пока не будут просчитаны 1000 эритроцитов. Зная число эритроцитов в 1 л крови, рассчитывают количество тромбоцитов в этом объеме. Использование гематологических автоанализаторов существенно облегчает подсчет тромбоцитов крови, повышает точность и ускоряет процедуру подсчета. Несмотря на преимущества автоматического счета тромбоцитов, существует ряд особенностей, требующих внимания персонала лабораторий. Автоанализаторы подсчитывают тромбоциты и эритроциты в одной камере без предварительного лизиса эритроцитов. Это создает проблему дифференцирования крупных форм тромбоцитов (макротромбоцитов) и сравнимых с ними по объему эритроцитов (микроцитов), эритроцитарных фрагментов (гизоцитов), а также отшнуровавшихся фрагментов цитоплазмы лейкоцитов (псевдопластинок). Ложное снижение числа тромбоцитов могут давать агрегация или слипание тромбоцитов при наличии агглютининов и при прилипании тромбоцитов к лейкоцитам (тромбоцитарный "сателлизм")либо при взятии крови с гепарином в качестве антикоагулянта. От появления артефактов не спасает и использование ЭДТА, который может индуцировать агрегацию при наличии аутоантител к тромбоцитам. 8) С какой целью используется тромбоэластография? Тромбоэластография, как метод исследования системы гемостаза, позволяет в течение одного теста оценить все звенья свертывающей системы крови – плазменное, тромбоцитарное и систему фибринолиза. Полученные данные о времени образования сгустка, скорости его роста, величине, упругости и растворении сгустка в процессе фибринолиза лежат в основе оценки всех ключевых моментов в системе гемостаза, что позволяет своевременно назначить патогенетически обоснованную терапию либо проверить эффективность назначенных пациенту препаратов (антикоагулянтов, антиагрегантов, ингибиторов фибринолиза) и адекватность подобранной дозировки. R - время с момента когда образец был помещен в анализатор до момента образования первых нитей фибрина. Представляет собой характеристику энзиматической части коагуляционного каскада. K - время с момента начала образования сгустка до достижения фиксированного уровня прочности сгустка (амплитуды = 20 мм). K отражает кинетику увеличения прочности сгустка. α - угол, построенный по касательной к тромбоэластограмме из точки начала образования сгустка. Отображает скорость роста фибриновой сети и её структурообразование (увеличение прочности сгустка). Характеризует уровень фибриногена. MA Максимальная амплитуда -характеризует максимум динамических свойств соединения фибрина и тромбоцитов посредством GPIIb/IIIa и отображает максимальную прочность сгустка. На 80% МА обусловлена количеством и свойствами (способностью к агрегации) тромбоцитов, на 20% - количеством образовавшегося фибрина. LY30 - изменение площади под кривой тромбоэластограммы в течение следующих за достижением MA 30 минут, по отношению к площади под кривой тромбоэластограммы без признаков лизиса (прямоугольник с высотой МА), выраженное в процентах . Представляет собой характеристику процесса растворения сгустка - лизиса. 9) Какие основные методы используются для оценки плазменного звена гемостаза? Что такое клоттинговые методы? Основные методы: АЧТВ Активированное частичное тромбопластиновое время (АЧТВ) является показателем измерения эффективности «внутреннего» (путь контактной активации) и общего пути свертывания. Помимо выявления нарушений в процессе свертывания крови, АЧТВ также используется для контроля эффективности лечения гепарином, основным антикоагулянтом. Тест используется в сочетании с тестом протромбинового времени(ПВ), который измеряет внешний путь свертываемости. Протромбиновое время(ПТВ) Протромбиновое время – коагулологический тест, который используется для оценки внешнего пути свёртывания крови. Показатели, определяемые в ходе анализа – протромбиновый индекс по Квику и МНО - выражают протромбиновое время. ПТВ отражает активность факторов протромбинового комплекса. Результаты исследования дают возможность врачу контролировать состояние пациентов во время терапии непрямыми антикоагулянтами, своевременно принять меры для предотвращения кровотечения. Также анализ используется для определения активности VII фактора. МНО Отношение ПТВ у пациента к ПТВ в норме. Фибриноген по Клауссу Тромбиновое время Одно из лабораторных коагулологических исследований крови, данные которого отражают нарушения конечного этапа свертывания. Тест измеряет скорость превращения фибриногена в фибрин под действием тромбина. При этом скорость образования фибринового сгустка зависит, главным образом, от количества и функциональной полноценности фибриногена и присутствия в крови антикоагулянтов. Коагуляционные, или клоттинговые, методы основаны на определении промежутка времени от добавления стартового реактива, запускающего каскад свертывания плазмы, до момента образования сгустка (выпадения фибрина). При постановке коагуляционных тестов необходимо перемешать плазму с реактивом до гомогенной суспензии и поддерживать стабильной температуру реакции. Коагуляционные тесты - в настоящее время наиболее распространенный методический подход для оценки плазменного гемостаза в клинико-диагностических лабораториях. Необходимо подчеркнуть, что коагуляционные методы являются скрининговыми, тем не менее на их основе сконструирован ряд методов для оценки активности факторов плазмы. Ручные методы Ручные методы обнаружения момента выпадения сгустка проводятся на водяной бане. Автоматическая регуляция температуры воды только частично решает проблему поддержания постоянной температуры. Частое вынимание пробирки во время исследования для наблюдения за появляющимся сгустком является причиной того, что температура реакции не соответствует температуре водяной бани. При визуальной оценке времени появления сгустка даже опытному лаборанту невозможно точно установить момент появления сгустка, что является главной причиной плохой повторяемости результатов. Однако следует помнить, что в ситуациях, в которых отсутствуют или подводят автоматические методы (формируется неплотный сгусток), применение этого метода обоснованно. Точность определения времени больше зависит от исследователя, чем от типа используемого в исследованиях секундомера. Удовлетворительной следует считать точность определения времени до 0,5 с. К недостаткам этого метода можно отнести длительность его выполнения и необходимость максимального внимания во время проведения исследования 16. Как и с какой целью определяется МНО? Какой тромбопластин необходим при расчете МНО? Что такое МИЧ? МНО (Международное нормализованное отношение) применяется для контроля антикоагулянтного эффекта при применении антикоагулянтов непрямого действия. Позволяет более точно подобрать дозу антикоагулянта и уменьшить риск кровотечений, связанных с его передозировкой. МНО –это попытка математически скорректировать разницу, даваемую тромбопластинами с различной чувствительностью, т.е. привести результат к данным, полученным с референтным тромбопластином. При определение МНО расчеты проводят в 2 этапа: 1. Определяют протромбиновое отношение (ПО) в единицах по формуле: ПО = ПВ больного/ ПВ контрольной плазмы (N 0,85-1,2) Где ПВ – протромбиновое время ( характеризует первую (протромбинообразование) и вторую (тромбинообразование) фазы плазменного гемостаза и отражает активность протромбинового комплекса (факторов VII, V, X, II (протромбин). Определение ПВ: плазму подогревают до 37оС, вносят тканевой тромбопластин с СаСl2 и определяют время образования фибринового сгустка ( на коагулометре или в ручную). Используется цитратная венозная кровь. В качестве контроля используют: свежеразведеную лиофилизированную нормальную пулированную плазму, свежую смешанную плазму от нескольких здоровых доноров (не менее 10). При исследовании параллельных проб разброс результатов не должен превышать 1 с. N ПВ = 10 – 20 с (зависит от типа реагента и условий определения). _____________________________________________________________________________ 2. Расчет МНО по формуле: МНО = (ПО)МИЧ Так же МНО можно определить по таблице. Вне приема антикоагулянтов значение МНО 0,7 – 1,3. Терапевтический диапозон МНО от 2,0 до 3,5 МИЧ - Международный индекс чувствительности тромбопластина (прилагается к описанию каждого набора). За эталон (Международный референтный препарат ВОЗ) принят тромбопластин из мозга человека МИЧ которого равен 1,0. Все другие коммерческие тромбопластины калибруются по нему. МИЧ различных тромбопластинов варьирует от 0,9 – 2,8. Лабораториям рекомендуется работать с тромбопластином, имеющим МИЧ<1,5. Кроличьи тромбопластины МИЧ = 2,0 – 3,0, плацентарный человеческий тромбопластин МИЧ = 1,0. Чем выше значение МИЧ, тем менее чувствителен тромбопластин к изменению содержания компонентов протромбинового комплекса и тем больше ошибка в определении ПВ. 17. Какой тест контролирует внутренний путь свертывания крови? АЧТВ (активированное частичное тромбопластиновое время) это функциональный тест, который оценивает внутренние механиз-мы (прекаликреин, кининоген, факторы XII, XI, IX, VIII) и общие процессы свертывания (факторы X, V, II, I). Определяют время свертывания бедной тромбоцитами цитратной плазмы при 37оС, в условиях стандартной активации контактной фазы, в присутствии фосфолипидов и при добавлении ионов Са2. Заменителем тромбоцитарной фосфолипидной матрицы для сборки ферментных комплексов служат фосфолипиды мозга, эритроцитов или сои. коагуляционных Заменителем активационной контактной поверхности – каолин или эллаговая кислота. Благодаря отсутствию тромбоцитов в плазме и добавлению их заменителя – парциального тромбопластина – на результаты теста практически не влияют тромбоцитарные факторы. Преаналитические особенности: Соблюдение условий взятия венозной крови (с добавлением цитрата) и получения бедной тромбоцитами плазмы. Параметры АЧТВ стабильны до 4 ч при комнатной температуре; при лечении гепарином исследование необходимо провести в течении 1 ч после взятия материала. Возможно хранение замороженной бедной трмбоцитами плазмы до 10 – 20 дней, но допустимо лишь однократное размораживание. Референтные пределы: N 20 – 40 c Результаты теста зависят от точности соотношения кровь/цитрат, вида и свойств фосфолипидного компонента и каолина, температуры, от типа и чувствительности прибора. Для снижения влияния интерферирующих факторов возможна оценка результата в виде индекса АЧТВ. индекс АЧТВ = АЧТВ пациента/АЧТВ контрольной нормальной плазмы (N 0,8-1,2) Контрольная плазма: смесь плазм не менее чем от 10 здоровых людей, полученных в тех же условиях, что и плазма пациентов; лиофилизированная референтная нормальная пулированная плазма, которую следует разводить за 30 мин до исследования. Обеспечение и контроль качества: Соблюдение рекомендаций производителя оборудования для выбора контрольных иатериалов. Для контроля качества чаще используют лиофилизированную референтную нормальную пулированную плазму, срок годности 2 -4 ч после разведения с аттестованным значением АЧТВ. Разброс при исследовании одного образца плазмы и использовании реактивов одной серии не должен превышать 10%. Нельзя исследовать плазму, имеющую сгустки или следы гемолиза, поскольку из-за активации гемостаза АЧТВ такой пробы может быть уменьшено. Для исключения эффекта гепарина используют реагент с инактиватором гепарина (при введении пациенту или при попадании из катетера гепарина). Интерпритация результатов: 1.Увеличение АЧТВ: Врожденное или приобретенное снижение количества/активности факторов внутреннего гемостаза ( XII, XI, IX, VII, X,V, II< фибриногена), их снижение возможно при приеме непрямых антикоагулянтов Избыток в пробе цитрата – абсолютном или относительном (неполное заполнение кровью пробирки со стандартным количеством цитрата) Наличие в пробе гепарина ( при введении пациенту или при попадании из катетера) или гирудина. Наличие в пробе декстранов Продукты деградации фибрина/фибриногена, патологических ингибиторов плазменных факторов или антикоагулятов волчаночного типа. 2.Уменьшение АЧТВ: клинического значения не имеет, поскольку часто связано с погрешностями взяия и обработки крови. 20.Какие методы используются для оценки содержания фибриногена? 1.Метод Клаусс (хронометрический метод). Определение времени образования фибринового сгустка при добавлении избытка высокоактивного тромбина к разведенной в 10 раз буфером плазме (для снижения влияния антитромбиновых компонентов) при 37оС. В этих условиях время реакции зависит от концентрации фибриногена, которая определяется по калибровочной кривой построенной в логарифмических шкалах. Преаналитические особенности: Соблюдают общие условия взятия венозной крови для исследования гемостаза и получения бедной тромбоцитами цитратной плазмы. При взятии капиллярной крови ее сразу перемешивают в пропорции 1:1 с антикоагулянтом. Материал для исследования стабилен в течение 8 ч при хранении в закрытой пластиковой или силиконированной стеклянной пробирке. Во избежание возможного искажения результатов нежелательно исследовать плазму, имеющую сгустки, следы гемолиза, а также полученную более чем за 8 ч до анализа. Методика исследования: Хронометрический метод требует предварительного построения калибровочного графика путем разведения стандартной нормальной плазмы буферным раствором для получения калибровочных проб, эквивалентных плазме с содержанием фибриногена от 1 до 6 г/л. Исследование проводят на коагулометре при 37 °С; к калибровочным пробам и разведенной буферным раствором в 10 раз исследуемой плазме добавляют раствор тромбина и определяют время до образования сгустка. Концентрацию фибриногена в исследуемой плазме находят по калибровочному графику. Если она превышает 5-6 г/л, для получения корректных данных рекомендуют повторить определение, разведя плазму буферным раствором не в 10, а в 20 раз, полученный результат умножить на 2. 2.Турбидиметрический метод: Характеристика теста: Определяют время образования фибринового сгустка в цитратной плазме под действием тромбиноподобного ферментного препарата змеиного яда — батроксобина или анцистрона, напрямую отщепляющего фибринопептид А от фибриногена и образующего активные фибринмономеры, которые в ходе полимеризации формируют сгусток. Тест нечувствителен к гепарину и его комплексу с антитромбином. Методика исследования: К плазме добавляют один из указанных препаратов змеиного яда, содержащих ферменты прямого фибринообразования. Определение проводят аналогично тесту тромбинового времени; сравнивают время свертывания исследуемой и нормальной плазмы. Исследование проводят не на коагулометре, а на фотометрическом анализаторе, позволяющем определить кинетику нарастания мутности среды. Скорость помутнения при образовании фибрина зависит от исходной концентрации фибриногена в плазме, которая определяется по результатам исследования калибровочных проб (требуется многоточечная калибровка). Турбидиметрический метод используют в некоторых автоматических анализаторах гемостаза, в этом же тесте можно одновременно определить протромбиновое время. Референтные пределы: У взрослых — 1,8-4,0 г/л, у новорожденных — 1,2-3,0 г/л. Интерференции: Хронометрический метод может давать некорректные результаты при дисфибриногенемии, а также при попадании в кровь большого количества гепарина (например, из венозного катетера). При исследовании капиллярной крови результат зависит от действия множества дополнительных интерферирующих факторов (форменных элементов крови, разного гематокрита), что снижает точность метода. Обеспечение и контроль качества: Для контроля качества определения фибриногена используют контрольную РНП-плазму, для калибровки - разведения стандартной плазмы либо стандартные растворы фибриногена. Разброс результатов при работе с одной и той же пробой плазмы не должен превышать 5%. Показания разных методов на одной и той же пробе плазмы могут существенно отличаться друг от друга, особенно при гипо- или гиперфибриногенемии. Именно поэтому в лаборатории рекомендуют придерживаться какого-либо одного метода, тщательно отладив его и регулярно проводя калибровку и контроль качества. 3.Определение содержания фибриногена в плазме (гравиметрический метод) практически не используется. крови по методу Рутберг Принцип. Образовавшийся в результате свертывания плазмы крови фибрин быстро высушивают и взвешивают. По его массе судят о количественном содержании фибриногена. Количество образовавшегося фибрина эквивалентно содержанию фибриногена в плазме. Ход определения. К 1,0 мл плазмы добавляют 0,1 мл 0,45 моль/л раствора хлорида кальция, перемешивают стеклянной палочкой. Палочку оставить в пробирке. Ставят в термостат с прозрачными стенками (ТПС) при 37 °С на 10 мин. За этот период происходит образование сгустка. Далее сгусток переносят на обеззоленный бумажный фильтр и просушивают другим фильтром до сухого состояния, т. е. до тех пор, пока на фильтре не останется влажного пятна. Сгусток высушенного фибрина немедленно взвешивают на торсионных весах. Норма. Масса сгустка составляет 9—15 мг. Расчет. Для определения концентрации фибриногена, выраженной в г/л, массу сгустка фибрина умножают на экспериментально установленный коэффициент 0,222. Норма в плазме: 2 – 4 г/л Примечание. Для ускорения превращения фибриногена в фибрин и более полного образования сгустка в реакционную смесь вносят 0,2 мл раствора тромбопластина, который используется в методике определения протромбинового времени. Возможные ошибки. Ошибки метода могут быть связаны с потерей части сгустка на фильтре, недостаточным высушиванием фибрина, что ведет к завышению результатов; либо пересушиванием сгустка с ошибочным сдвигом в сторону снижения уровня фибриногена. Метод мало информативен, когда образуется рыхлый сгусток (при ДВС синдроме), при замедлении свертывания крови, например, при гемофилии, лечении гепарином или гирудином. Недостатком метода также является большой расход крови исследуемого больного. Интерпритация результатов: Фибриноген синтезируется в печени и относится к группе белков острой фазы. Повышение концентрации фибриногена возможно при любой острофазовой реакции (воспалении, инфекциях, ожогах, травмах, в послеоперационном периоде, остром инфаркте миокарда), а также при болезнях почек, системных заболеваниях соединительной ткани, злокачественных новообразованиях и др. У здоровых женщин уровень фибриногена возрастает при беременности, введении эстрогенных препаратов и во время менструации. Снижение содержания фибриногена — гиперпотребление при образовании большого количества микросгустков, распад в результате действия фибринолитических препаратов (стрептокиназы и т. п.) или нарушение синтеза при тяжелой патологии печени (циррозе, острой дистрофии), а также значительная гемодилюция. Необходимо учитывать, что тяжелые гнойновоспалительные процессы, приводящие к развитию синдрома диссеминированного внутрисосудистого свертывания, могут способствовать повышению уровня фибриногена как острофазного белка и тем самым маскировать его усиленное потребление. 24. Что такое волчаночный антикоагулянт? При каких заболеваниях и состояниях он появляется? Волчаночными антикоагулянтами (ВА) называются аутоантитела (относятся к иммуноглобулинам класса IgG), вырабатываемые иммунной системой против собственных отрицательно заряженных фосфолипдов и/или связанных с фосфолипидами белков. Фосфолипиды играют жизненно важную роль в процессе тромбообразования. Они находятся на поверхности тромбоцитов и способствуют активированию нескольких коагуляционных факторов в ответ на повреждение кровеносных сосудов или тканей. Волчаночный коагулянт ингибирует фосфолипазу А2 и протеин S, тем самым снижая продукцию простациклина (ингибитор агрегации тромбоцитов) эндотелиальными клетками, что создает условия для тромбообразования. ВА является вероятным фактором тромбозов неясного генеза. Как следствие, антифосфолипидный синдром (АФС) не имеет особенных клинический проявлений, его можно заподозрить при невынашивании беременности (из-за тромбоза сосудов плаценты), гемодинамические нарушения в виде инсультов или тромбозов, при наличии аутоиммунных заболеваний. Они также могут присутствовать у пациентов со СПИДом, при воспалениях, при онкологических заболеваниях, а также у тех, кто принимает фенотиазины, прокаинамид или фансидар. Для АФС характерно парадоксальное удлинение АЧТВ (Активированное частичное тромбопластиновое время) и склонность к тромбозам, в то время как другие показатели коагулограммы не имеют отклонений. Единого анализа на определение волчаночного антикоагулянта не существует. Их обычно выявляют путем комбинаций различных тестов. Начальное тестирование включает в себя один или несколько анализов с использованием фосфолипидных реагентов. Причины выявления волчаночного антикоагулянта Аутоиммунные нарушения: системная красная волчанка, антифосфолипидный сидром, ревматоидный артрит, множественная миелома, язвенный колит, злокачественные опухоли. Вторичный антифосфолипидный синдром. Осложнения после приема некоторых лекарств. 26. Что такое продукты деградации фибрина/фибриногена (ПДФ)? Какие реальные тесты используются для оценки содержания ПДФ? Продукты деградации фибриногена/фибрина (ПДФ), также известные как продукты расщепления фибриногена/фибрина, образуются при разрушении сгустка крови при действии плазмина на депозиты фибрина. Продукты деградации фибриногена/фибрина обладают антитромбопластиновым, антитромбиновым и антиполимеразным действием. Активный плазмин вызывает последовательное асимметричное расщепление фибриногена/фибрина. Образующиеся фрагменты очень гетерогенны: продукты, происходящие из фибрина, растворимые продукты распада фибриногена и нестабилизированного фибрина. Вначале от α- и β-цепей фибриногена/фибрина отщепляются низкомолекулярные фрагменты. После их отщепления в плазме крови остаётся крупномолекулярный фрагмент Х, который еще сохраняет способность образовывать фибрин (свёртываться) под влиянием тромбина. Затем под влиянием плазмина фрагмент Х расщепляется на фрагменты Y и D, а фрагмент Y - на фрагменты D и Е. Крупномолекулярные фрагменты фибринолиза (фрагменты Х и Y) получили название «ранние», а фрагменты D и Е - «поздние» или конечные. Эти фрагменты расщепления фибриногена и фибрина и называют продуктами деградации фибриногена/фибрина. Уровень ПДФ повышается после любого эпизода тромбоза и может использоваться как тест на диссеминированное внутрисосудистое свертывание (ДВС). В нормальных условиях фибринолитический процесс локализован на сгустках фибрина, так как альфа-2-антиплазмин и ингибиторы активатора плазминогена предотвращают распространение фибринолиза. При ДВС фибринолиз распространяется и становится системным, и в этом случае будет иметь место деградация циркулирующего фибриногена. образование фибрина. Увеличение уровня ПДФ бывает при лёгочной тромбоэмболии, инфаркте миокарда, тромбозах глубоких вен, в послеоперационный период, при осложнениях беременности (отслойка плаценты, эклампсия), у больных с различными злокачественными новообразованиями, лейкозами, при острой и хронической почечной недостаточности, обширных травмах, ожогах, шоке, инфекционных заболеваниях, сепсисе, коллагенозах, парапротеинемиях и др. Многократное обнаружение ПДФ имеет значение в диагностике хронической формы ДВС-синдрома. Среди методов определения ПДФ можно выделить: 1. Тесты паракоагуляции: этаноловый и протаминсульфатный тесты качественно обнаруживают комплексы мономеров фибрина с ПДФ за счет того, что комплексы мономеров фибрина и ПДФ в присутствии этилового спирта или протаминсульфата способны полимеризоваться и образовывать гель. Тесты характеризуются высокой чувствительностью и низкой специфичностью. Это значит, что их положительный результат свидетельствует об активации системы тромбинообразования и/или фибринолиза. В это же время отрицательные результаты этих тестов диагностического значения не имеют. 2. Иммунологические полуколичественные тесты выявления ПДФ: основаны на использовании латексных частиц (тесты агглютинации латекса) или стандартных эритроцитов (реакция гемагглютинации) с адсорбированными на них антителами к фибриногеновым антигенам (fibrinogen-fibrin related antigen - FRA). Этот полуколичественный тест характеризуется высокой чувствительностью к патологии, связанной с активацией процессов тромбообразования, и особенно фибринолиза. Специфичность теста значительно выше по сравнению с тестами паракоагуляции. У здоровых людей диапазон концентрации ПДФ составляет 1 – 5 мкг/мл. Диагностическим порогом для диагностики синдрома ДВС является уровень более 500 мкг/мл. При тромбозах глубоких вен и ТЭЛА (Тромбоэмболия лёгочной артерии) уровень ПДФ обычно находится в диапазоне 5 – 500 мкг/мл. Рост ПДФ наблюдается также при лечении тромболитиками, при инфаркте миокарда, заболеваниях печени. 3. Определение уровня Д-димеров. На сегодняшний день Д-димеры являются наиболее приемлемым диагностическим маркером развития синдрома ДВС, а также эффективным диагностическим тестом в ведении пациентов с подозрением на наличие тромбоза глубоких вен (ТГВ) и тромбоэмболии легочной артерии (ТЭЛА). Синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) и тромбэмболия легочной артерии (ТЭЛА) являются одними из наиболее опасных осложнений, с которыми врачи - клиницисты сталкиваются в повседневной практике. Определение объективных диагностических критериев этих осложнений позволяет быстро поставить правильный диагноз и рано начать адекватную терапию. Одним из таких критериев может быть уровень Д-димера в плазме крови.