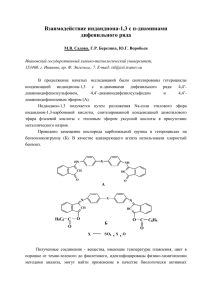
Лабораторная работа Омыление ацетоуксусного эфира и определение энергии активации реакции Цель работы: определение среднего значения константы скорости реакции омыления ацетоуксусного эфира раствором едкой щелочи при двух температурах и определение энергии активации реакции CH3-C-CH2-C-O-C2H5 + NaOH CH3-C-CH2-C-ONa + C2H5OH. O O O O Омыление сложного эфира протекает по уравнению AcR + OH- Ac- + ROH и относится к реакции второго порядка: скорость ее пропорциональна концентрации эфира и щелочи dc 0 0 k (cùåë ñx0 )(cýô c x0 ) d и определяется уравнением (8) 0 0 cýô (ñùåë ñõ ) 1 k lg 0 0 0 0 (cùåë ñýô ) ñùåë (ñýô ñõ ) , (8) где с0щел – начальная концентрация ионов ОН– (практически равная начальной концентрации щелочи); с0эф – начальная концентрация эфира; сХ – концентрация ионов Ас-, образовавшихся к данному моменту времени (практически равна концентрации соли); (сщел–сХ) – концентрация щелочи в момент времени ; (сэф–сХ) – концентрация эфира, не прореагировавшего к данному моменту времени . Зависимость константы скорости k от температуры Т для реакций описывается уравнением Аррениуса d ln k E dT RT 2 , (9) где Е – аррениусовская (экспериментальная) энергия активации. Если Е=const, то интегрирование (9) дает: lnk = lnA - E/RT (10) Следовательно, lnk линейно зависит от обратной абсолютной температуры (Рис.1.). Рис.1. Аррениусовская диаграмма температурной зависимости константы скорости реакции. Для расчета энергии активации Е по экспериментальным данным используют уравнение (10): Е = –Rtg Если имеются данные при двух температурах, то из (10) получают ER T1T2 k ln 2 T2 T1 k1 (11) Методика проведения работы Берут две колбы на 100 мл. В одну наливают 50 мл 0,025н щелочи, в другую — 50 мл 1/60н ацетоуксусного эфира. Колбы плотно закрывают резиновыми пробками и помещают на 15-20 мин в термостат при t 20-25С. Когда растворы в колбах приобретут заданную температуру, содержимое одной колбы переливают в другую, взбалтывают, отбирают 10 мл смеси в коническую колбу, куда заранее добавлено 25 мл дистиллированной воды, и титруют 0,01н HCl с индикатором фенолфталеином. Начальный момент титрования принимают за начало реакции и замечают на часах. Затем отбирают по 10 мл смеси через 5, 10, 15, 20, 25 мин от начала опыта, записывая количество HCl пошедшее на титрование. После последнего титрования колбу со смесью вынимают из термостата и нагревают на водяной бане при t 80-90С с обратным холодильником в течение 30 мин. Охлаждают до 20-25С, отбирают пробу 10 мл и титруют HCl. Этот титр рассматривают как конечный, соответствующий уравнению реакции. По полученным данным опыта вычисляют константу скорости реакции для каждого значения времени, кроме 0 и ∞. Аналогично проводят опыт при повышенной температуре (40-45С). Константу скорости реакции вычисляют по уравнению (12) k V (V V ) V ln 0 V C V0 (V V ) , (12) где k-константа скорости реакции; - время в мин; V0 - количество HCl мл (V10-3 л), пошедшее на первое титрование; V - количество НCl мл (V10-3 л), пошедшее на титрование через 5, 10, 15, 20, 25 мин; V∞ - количество HCI мл (V10-3 л), пошедшее на последнее титрование; С – концентрация раствора кислоты моль/л; V – объем пробы в мл (V10-3 л). Результаты измерений заносят в таблицу: № пробы Промежуток времени от начала реакции , мин Объем кислоты, Константа израсходованный на скорости k титрование пробы, мл kср = По результатам работы вычисляют константы скорости по уравнению (12) и определяют величину kср. Энергию активации рассчитывают по уравнению Аррениуса аналитически, используя формулу (11), и графически в координатах lnk – f(1/T) по уравнению (10).