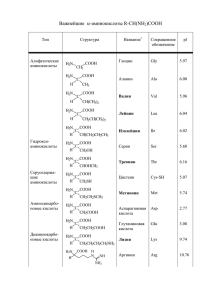
АНАЛИЗ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРОИЗВОДНЫХ БЕНЗОЛСУЛЬФОНИЛАМИДА к производным бензолсульфониламидов относится большая группа ЛВ, обладающих антибактериальной, диуретической, гипогликемической, антисептической и другими видами фармакологического действия. Бензолсульфониламиды - это производные амидов сульфокислот ароматического ряда. R R SO3H HN SO 2NH2 сульфокислота R O 2S амид сульфокислоты NH R R1 -сульфанил O 2S NH -сульфонил C NH O (названия радикалов) в зависимости от химической структуры и характера биологического действия бензолсульфониламиды подразделяются на 4 группы производных: SO 2NH 2 SO 3H амид бензолсульфокислоты Cl SO 2NH 2 амид хлорбензолсульфокислоты H2N SO 2NH 2 п-аминобензолсульфамид O R SO 2 NH NH R1 бензолсульфонилмочевина СУЛЬФАНИЛАМИДЫ H2N SO 3H сульфаниловая кислота Сама сульфаниловая кислота не применяется в медицине, но ее амид уже является ЛВ и служит основой целой группы ЛП, объединенных по CH3 химическому строению и характеру фармакологического действия в большую группу сульфаниламидных препаратов. История создания в 1908 г. французский химик Гельмо в поисках лучших красителей для ткани синтезировал амид сульфаниловой кислоты, ставший основой для синтеза целого ряда азокрасителей для красильной промышленности. В 1932 г немецкий ученый Герхард Домагк получил один из таких азокрасителей – сульфамидохризоидин – пронтозил, и установил его высокую терапевтическую активность при тяжелых стрептококковых инфекциях. Мыши, получившие 10 смертельных доз гемолитического стрептококка, после введения пронтозила, остались живы, а все контрольные погибли. H2NO 2S N N NH2 H2N пронтозил В 1935 г. в печати появилось первое сообщение Домагка о проведенных испытаниях и их результатах. Это послужило началом нового этапа в развитии химиотерапии и широких исследований в области создания химиотерапевтических средств, производных амида сульфаниловой кислоты. Уже в 1935 г. сотрудниками института Пастера было установлено, что самые различные азокрасители, содержащие сульфаниламидный фрагмент пронтозила, обладают почти одинаковой противострептококковой активностью in vivo. Однако, любые модификации сульфаниламидной части молекулы (замещение сульфамидной части молекулы на карбоксамидную или нитрильную) приводило к потере антибактериальной активности. В нашей стране первые работы в области синтеза и изучения терапевтических свойств с/а проводились во ВНИХФИ под руководством химика-органика О.Ю. Магидсона в 1935-36 гг. Первым был синтезирован близкий по структуре к пронтозилу красный стрептоцид: H2NO 2S N N NH2 HCl H2N Вслед за первым важным открытием о том, что антибактериальная активность пронтозила и красного стрептоцида обусловлена сульфамидной частью молекулы последовало второе: в организме животного происходит метаболическое расщепление азогруппы с образованием следующих веществ: N H2NO 2S N NH2 NH2 H2NO 2S H2N + H2N NH2 H2N 1 2 I – высокоактивный в терапевтическом отношении с/а II – 1,2,4 – триаминобензол – физиологически не активный, токсичный продукт. Этот вывод заставил отказаться от соединений типа пронтозила (азокраситель) и начала формироваться группа ЛС на основе паминобензолсульфамида. Уже в 1936 г.в нашей стране начал выпускаться белый стрептоцид: NH2 H2NO 2S Механизм антимикробного действия с/а основан на теории конкурентного антогонизма. Для нормальной жизнедеятельности и роста микроорганизмам необходимы факторы роста – фолиевая, дигидрофолиевая кислота и другие вещества, в состав которых входит п-аминобензойная кислота: ФОЛИЕВАЯ КИСЛОТА OH COOH N N CH2 C NH NH CH CH2 CH2 COOH O H2N N N остаток ПАБК птерин остаток глютаминовой к-ты П-аминобензолсульфамид имеет близкое структурное сходство с ПАБК: H2N H2N 0,69 нм O S 0,67 нм O HO O NH R 0,2 нм 0,23 нм При наличии в бактериальной среде с/амидов они конкурируют с ПАБК на стадии образования птероевой кислоты и связываются с птеридиновым фрагментом, образовавшееся соединение, лишенное ПАБК, не может далее усваиваться микробной клеткой и рост микроорганизмов тормозится: OH COOH N N H2N CH2 N NH SO 2 NH CH CH2 CH2 COOH N остаток сульфаниламида На этом основан механизм бактериостатического действия сульфаниламидов. Для того, чтобы «выиграть» в конкурентной борьбе за место в молекуле фолиевой кислоты, с/а должны применяться в больших (ударных) дозах, что является одним из недостатков препаратов данной группы. Кроме того, при назначении препаратов необходимо помнить, что ЛС, производные ПАБК – новокаин, анестезин, являются антагонистами с/а. Назначать их вместе нельзя. ОБЩАЯ ФОРМУЛА R1 NH SO 2 NH R Создание группы препаратов проводилось на основе изучения взаимосвязи изменений в химической структуре с характером физиологического действия. При этом были выявлены следующие основные закономерности: 1. первое и основное условие – наличие сульфанильного радикала в молекуле 2. какие-либо манипуляции с аминогруппой в п-положении (перемещение в о- или м-положение; замещение водородных атомов радикалами, при которых в организме не может снова образовываться свободная ароматическая аминогруппа) приводят к полной потере активности. 3. введение заместителя в ароматическое кольцо приводит либо к снижению, либо к полной потере физиологической активности 4. лишь введение радикалов в сульфамидную группу позволяет получать вещества, физиологическая активность которых, в зависимости от радикала, может меняться не только в сторону уменьшения, но и в сторону увеличения 5. отмечено особое влияние метокси-группы на продолжительность действия препарата. Почти все препараты пролонгированного действия содержат эту группу в составе радикала сульфамидной группы Группа ЛС, с/амидов, в своем формировании прошла несколько этапов. В первое десятилетие с момента открытия (1935-1944 гг) интерес к данным препаратам был очень велик, велись интенсивные работы по их синтезу как в нашей стране, так и за рубежом. В это время группу формировали: Сульфаниламид (стрептоцид) Sulfanilamide(МНН) Streptocidum(ЛН) NH 2 SO 2NH 2 n-Аминобензолсульфамид Сульфацетамид натрий ( сульфацил-натрий) Sulfacetamide sodium(МНН) Sullfacylum-natrium(ЛН) CH3 Na O 2S * H2O N C CH3 п-Аминобензолсульфонил- ацетамид- натрий O Сульфатиазол (норсульфазол) Sulfathiazole (МНН) Norsulfazolum(ЛН) NH 2 N3 O 2S NH 2 4 1 S 5 4-амино- N-(2-тиазолил)- бензолсульфонамид Фталилсульфатиазол (фталазол) Phthalylsulfathiazole(МНН) Phthalazolum (ЛН) COOH O HN C N O 2S NH 2 3 1 6 5 4 3 2 4 5 1 S 2-( п-Фталиламинобензол- сульфамидо )-тиазол В 1944-45 гг. в связи с появлением антибиотиков (пенициллин, стрептомицин) интерес к с/а был потерян. Во многом это было связано с тем, что они быстро выводятся из организма, в связи с этим возникала необходимость приема больших доз через небольшие промежутки времени. Синтез препаратов группы с/а, обладающих длительным, пролонгированным действием, снова привлек интерес практической медицины и этим препаратам. Это следующие препараты: Сульфадиметоксин Sdimethoxine(МНН) Sulfadimethoxinum (ЛН) NH 2 4 1 3 2 O 2S OCH 3 NH N 3 4 2 5 6 1N OCH 3 4-Амино-N-(2,6- диметокси-4- пиримидинил)- бензолсульфонамид Сульфален Sulfalene(МНН) Sulfalenum(ЛН) NH 2 4 1 O 2S 3 2 NH N 3 4 5 2 1. 6 N H3OC 4-Амино-N-(З- метоксипиразинил )-бензолсульфонамид В последующем исследователи вновь вернулись к азосоединениям на основе сульфаниловой кислоты. Были созданы препараты группы салазосульфаниламидов. Особенностью их действия является выраженный лечебный эффект у больных неспецифическим язвенным колитом. Накапливаясь в соединительной ткани кишечника, они постепенно распадаются по азогруппе, образуя продукты, оказывающие одновременно антибактериальное и противовоспалительное действие. Салазопиридазин Salazopyridazinum (ЛН) N N 4 3 6 2 1 5 OH COOH O 2S N 1 6 NH 5 N 2 3 OCH 3 4 5-(п-[N-(З- метоксипиридазинил -6)- сульфамидо]-фенилазо)-салициловая кислота В 70х годах прошлого века разработан высокоэффективный Комбинированный препарат Сульфаметоксазол + Триметоприм Sulfamethoxasolum + Trimetoprimum (ЛН) синонимы – Бактрим Bactrim, Бисептол Biseptol, «Ко-тримоксазол» Со- Trimoxazole (МНН) NH 2 ( 1) H2N N OCH 3 ( 2) N O 2S NH CH 2 . OCH 3 NH2 N O сульфаметоксазол CH3 OCH 3 + триметоприм 4-амино-N –(-5-метил-3-изоксазалил)- бензолсульфонамид Сочетание этих двух веществ с бактериостатическим действием обеспечивает бактерицидное действие. Количество переходит в качество. Получение 1.Общая схема синтеза. Исходные продукты синтеза – ацетанилид и хлорсульфоновая кислота 1. получение хлорангидрида сульфаниловой кислоты – общая для всех с/а стадия. 2. получение соответствующего аминопроизводного – отличается в зависимости от характера радикала в сульфамидной группе 3. омыление ацетамидной группы для освобождения аминогруппы. Проводится в щелочной среде HO H3C N H O O H3C S + Cl O O N H SO2Cl + NH3 (R NH2) HCl NaOH H3C O N H SO2 N H R(H) H2N SO2 N R(H) Na Гидролиз, t = 250C HOH - CH3OH, - Na2CO3 NH2 HCl - NaCl CO2NH R 2. Синтез из N-фенилметилуретана (не касается салазопиридазина и бессептола): синтез с/амидов в промышленности наиболее рациональным |способом может осуществляться на основе одного из фенилуретанов – Nкарбометоксианилина. Например, стрептоцид: HO H3C O O N H O H3C O S + Cl O + NH3 O NaOH H3C O O N H SO2 NH2 H2N N H SO2Cl SO2 NH2 На стадии амидирования используют различные амины. Структура аминов представлена в таблице. Лекарственные вещества Сульфаниламид СvлыЬацетамид-натрий Сульфатиазол, фталилсульфатиазол R-NН2 Название амина NНз Аммиак 2-Аминотиазол N H2N S Сульфадиметоксин OCH 3 N H2N 4-Амино-2,6диметоксипиримидин N OCH 3 Сульфален N H2N . 2-метокси-3-аминопиразин N H3CO Салазопиридазин N 3-метокси-6аминопиридазин N H2N OCH 3 Например, при получении сульфацетамида-натрия на стадии амидирования используют аммиак: HN C OCH3 O Амидирование NH3 HN C O OCH3 Ацилирование (CH3CO)2O HN C OCH3 O - CH3COOH - HCl SO 2Cl SO 2NH2 Хлорангидрид N-карбометоксисульфаниловой кислоты SO 2NHCOCH3 Амид N-карбометоксисульфаниловой кислоты NH2 Гидролиз, t = 250C HOH, 3NaOH - CH3OH - Na2CO3 Na O 2S N C CH3 O Описание Белые или с желтоватые кристаллические порошки без запаха. Салазопиридазин имеет, красно-оранжевое окрашивание, т.к. по химическому строению является азокрасителем. Растворимость ЛВ все кроме сульфацила натрия мало растворимы в воде, растворимы в полярных растворителях (например, в ацетоне), мало растворимы или практически нерастворимы в липофильных растворителях (хлороформе и эфире). Натриевые соли сульфаниламидов растворимы в воде и не растворимы в органических растворителях. Физико-химические свойства l. поглощение света в УФ-области спектра (250-320 нм), что обусловлено наличием хромофорных групп, главным образом, ароматического кольца. 2.Поглощает свет в видимой области салазопиридазин за счет наличия азогруппы. 3. в ИК-области все ЛВ имеют характерные спектры поглощения. Химические свойства 1. кислотно-основные свойства. Кислотные формы сульфаниламидов обладают амфотерными свойствами с преобладанием кислотных. Из-за отрицательного индуктивного эффекта SO2-группы бензолсульфониламиды обладают NH-кислотностью. Ацилирование сульфамидной группы приводит к образованию имидов с более выраженной NH-кислотностью по сравнению с амидами. Такие бензолсульфониламиды растворяются не только в щелочах как амиды, но и в карбонатах щелочных металлов. O H2N S .. NHR O Натриевые соли с/амидов хорошо растворимы в воде, их растворы имеют щелочную реакцию среды. - Кислотные свойства с/амидов обусловлены наличием замещенной (кроме стрептоцида) имидной группы (в составе сульфамидной) и выражены сильнее. За счет NH-кислотных свойств ЛВ образуют соли со щелочами и карбонатами щелочных металлов, а натриевые соли с солями тяжелых мeтaллов. Стрептоцид как очень слабая кислота не ацилированная по сульфамидной группе натриевых солей и комплекса не образует. - Слабые основные свойства обусловлены наличием ароматической аминогруппы и выражаются в способности растворяться в кислотах с образованием солей. Однако с/а – это слабые основания, поэтому их соли неустойчивы и в водной среде легко гидролизуются. SO2 N R H H2 N + NaOH + HCl O ( H2 N SO2 N R )Cl H H2 N +3 S N R O Na или O H2N S .. NHR O NaOH H2N S HCl O NR ONa + H2O NH2 S O NH2 NH2 NR ONa S CuSO4 - Na2SO4 O R R N N O Cu O S O 2. Сульфаниламиды дают реакции, характерные для ароматических соединений (реакция электрофильного замещения), первичной ароматической аминогруппы (реакция образования азокрасителя, конденсации с альдегидами, окисления и др.) Подлинность 1. Температура плавления. 2. ИК-спектры, снятые у субстанций ЛВ, должны соответствовать спектрам, приведенным в ФС. 3. УФ- спектры поглощения водных (для натриевых солей) или щелочных (для кислотных форм) растворов или в видимой (салазопиридазин). Значения максимумов поглощения должны соответствовать значениями, приведенным в ФС. 4.ТСХ метод на пластинках «Силуфол». Общие реакции подлинности 1. ФС Реакция диазотирования и азосочетания. На ЛВ, содержащие первичную ароматическую аминогруппу, а также фталилсульфатиазол (фталазол) после кислотного гидролиза. Образуется красное окрашивание или оранжево-красный осадок азокрасителя. Является общегрупповой для с/а и для доказательства подлинности ее используют только в сочетании со специфическими для каждого вещества реакциями. N NH N HCl COOH SO2 NH + H2N SO2 NH S S O COOH фталевая к-та COOH норсульфазол Далее проводят реакцию диазотирования и азосочетания по общим правилам. 2.Реакция конденсации с ароматическими альдегидами образуются основания Шиффа. На ЛВ, содержащие первичную ароматическую аминогруппу. При взаимодействии с ванилином окрашивание в желтый цвет, с п-диметиламинобензальдегидом в желто-оранжевый, с фурфуролом – в красный. O R O O NH S NH2 + R OH H O CH3 OH CH желтое OCH 3 O N H N O OCH 3 O NH S CH3 H красное или малиновое желтое или оранжевое Можно использовать капельный вариант реакции – «лигниновая проба» реакция Овчинникова на газетной бумаге. Образуется желто-оранжевое окрашивание. С/а, как и все вещества с ПАА, способны вступать в реакции конденсации с ароматическими альдегидами с образованием оснований Шиффа. 3.Реакции, обусловленные наличием ароматического ядра и ПАА – это реакции галогенирования, сульфирования, нитрования. Нитропроизводные с/а окрашены в желтый цвет, бромпроизводные выпадают в виде белого или желтоватого осадка дибромпроизводных: Br H2N SO2NH R + Br2 H2N R Br + 2НВr 4.Реакции окисления на ПАА. При окислении сульфаниламида водорода пероксидом и железа (III) хлоридом образуется красное окрашивание, переходящее в коричневое. Если использовать в качестве окислителя хлорамин, то в щелочной среде при сочетании с фенолом образуются соединения по типу индофеноловых красителей (синий цвет). 5.ФС Реакция образования комплексных солей (дают все кроме стрептоцида), обусловлена наличием подвижного атома водорода сульфамидной группы. Проводят комплексообразование с солями меди и кобальта (сульфадиметоксин) в слабощелочной среде (с натриевыми солями сульфаниламидов). Кислотные формы предварительно растворяют в растворе натрия гидроксида (без избытка). Избыток щелочи опасен тем, что образующийся гидроксид меди или кобальта маскирует эффект. Данная реакция является и общей и реакцией отличия, т.к. образуются осадки различной окраски и устойчивости. Особенности химической структуры каждого вещества, сила кислотности определяют свойства продукта реакции. O O H2N S NH R NaOH H2N O S N R O Na CuSO4 O H2N S N O R Cu O H2N S N R O Стрептоцид как очень слабая кислота устойчивого комплекса не образует и этой реакции НЕ ДАЕТ. С солями серебра образуются белые осадки только по сульфамидной группе (например, норсульфазол): H2N S O N O N O + AgNO3 NH S H2N S N O Ag + HNO3 S Сульфадиазин серебра ЛВ «Дермазин» 6.Реакция на ковалентно связанную серу сульфамидной группы. Для обнаружения серы ЛВ подвергают минерализации кипячением с азотной кислотой концентрированной, при этом ковалентно связанная сера переходит в сульфат-ион, который доказывают по реакции с раствором бария хлорида: + NO↑ + NO2↑ SО42- + ВаСI2 → ВаSО4↓+2СI- Специфические реакции подлинности 1. ФС Пиролиз - термическое разложение ЛВ при высоких температурах с доступом кислорода воздуха. Основана на разложении и окислении. Сухой порошок сульфаниламида помещают в сухую пробирку, нагревают – образуется плав характерного цвета, выделяются газы, идентифицировав которые можно сделать вывод о структуре вещества. Газообразные продукты обнаруживаются по запаху (ФС) или аналитическими реакциями. Так, при пиролизе стрептоцида ощущается запах аммиака и анилина. В состав с/а входит сера – в составе сульфамидной группы и у некоторых в составе гетероцикла. 1) сера сульфамидной группы (у всех) при пиролизе дает оксид серы (IV) – определяют - по обесцвечиванию раствора йода или SO2+ Y2 + 2H2O 2 HY+ H2SO4 обесцвечивание йода - по синему окрашиванию после прибавления раствора йодата калия и крахмала. 5 SO2+2KYO3 Y2 + 4 SO3+ K2SO4 крахмал синеет 2)сера тиазолового цикла (норсульфазол, фталазол) при пиролизе образует сероводород: - характерный резкий запах или - черное пятно на бумаге смоченной ацетатом свинца H2S + Pb(CH3COO)2 PbS черный + 2 CH3COOH 2. ФС Реакция образования флуоресцеина для фталазола (фталилсульфатиазола). Фталазол и резорцин сплавляют в тигле с несколькими каплями конц серной кислоты. После охлаждения остаток обрабатывают раствором натрия гидроксида и выливают в воду. Появляется желтое окрашивание и интенсивная ярко-зеленая флуоресценция. O COOH C H2SO4 O H2O COOH C O O C O C O O C HO O + H OH C H HO OH COONa + NaOH C COONa H2O O C OH O HO OH O HO O O HO флуоресцеин 3. ФС Натриевые соли окрашивают бесцветное пламя горелки в жёлтый цвет (доказательство натрия). 4. ФС Восстановление азогруппы до диазогpуппы цинковой пылью в присутствии хлороводородной кислоты (для салазопиридазина). Происходит обесцвечивание раствора. N N HN OH NH OH [H] Zn + HCl COOH COOH - ZnCl2 N SO 2 HN оранжевый N N OCH3 SO 2 HN бесцветный N OCH3 5.Реакция гидролитического расщепления по сульфамидной группе. В сульфациле-натрия при гидролизе Н2SO4 конц. – запах уксусной кислоты O H2N H2SO4 S N O Na O C CH3 O H2N S HO NH2 + C o tC O CH3 + Na2SO4 O CH3COOH + C2H5OH → CH3COOC2H5 Другой вариант определения. Сначала выделяют осадок сульфацила Т°пл уксусной кислотой. Затем растворяют осадок в этаноле и добавляют Н2SО4конц. образуется этилацетат с фруктовым запахом. При гидролизе фталазола образуется 2-аминотиазол, определяют его Т°пл. Качественный анализ каждого из препаратов группы проводится на основе сочетания общих и специфических реакций. Общие закономерности реакций подлинности на с/амидные препараты: реакция на образования азокрасителя (все, фталазол – после гидролиза); реакция образования комплексных солей с ионами меди и кобальта – реакции отличия (все кроме стрептоцида и фталазола) пиролиз Стрептоцид: 1. образование азокрасителя 2. пиролиз – плав сине-фиолетового цвета с запахом аммиака и анилина реакция с сульфатом меди не проводится (из-за слабых кислотных свойств стрептоцида устойчивого комплекса не образуется) Сульфацил-натрий: 1. образование азокрасителя 2. с сульфатом меди образуется осадок голубовато-зеленоватого цвета, не изменяющийся при стоянии (реакция отличия) 3. реакция на ион натрия (окрашивание пламени) 4. при гидролизе Н2SO4 конц. – запах уксусной кислоты Норсульфазол: 1. образование азокрасителя 2. с сульфатом меди – осадок грязно-фиолетового цвета 3. пиролиз – плав темно-бурого цвета с резким запахом сероводорода (отличие от всех, кроме фталазола) Фталазол: 1. образование азокрасителя после кислотного гидролиза 2. сплавление с резорцином (доказательство остатка фталевой кислоты) Сульфадиметоксин: 1. образование азокрасителя 2. с хлоридом кобальта – ярко-розовый с лиловым оттенком аморфный осадок Сульфален: 1. образование азокрасителя 2. с сульфатом меди – осадок зеленого цвета 3. УФ-спектр в интервале от 230 до 340 нм имеет 2 характерных максимума Салазопиридазин : 1. с сульфатом меди – зеленый осадок. 2. цинковой пылью в серной кислоте, раствор обесцвечивается 3. Спектр в видимой области от 400 до 600 максимум 457 нм. Сульфаметоксазол в бисептоле: 1. Комплексообразование с сульфатом меди – желтовато-зеленоватый осадок 2. реакция образования азокрасителя 3. УФ-спектр в хлороформе максимум 246нм и плечо 262-276нм 4. ТСХ – 2 пятна на уровне веществ-свидетелей. Чистота Определяются следующие показатели: 1. Физическую константу - температура плавления. 2.Примеси, характеризующие общую степень очистки – Cl-, SO42-,тяжёлые металлы и т.д. в пределах эталона. 3. Прозрачность и цветность растворов. Солевые формы ЛВ растворяют в воде, а кислотные - в растворе натрия гидроксида. 4. рН водных растворов (для натриевых солей). В сульфациле-Na (солевая форма) – pH водного раствора должен быть 8,5 – 9,5. 5. Кислотность водного извлечения для кислотных форм ЛВ. Стрептоцид, норсульфазол, определяют кислотность индикаторным методом (водное извлечение, индикатор бромтимоловый синий). В натриевых солях с/амидов регламентируется предел щелочности, источники которой – примеси от получения и гидролиз. В кислотных формах с/амидов, соответсвенно, регламентируется кислотность. В натриевых солях с/амидов регламентируется предел щелочности, источники которой – примеси от получения и гидролиз. В кислотных формах с/амидов, соответсвенно, регламентируется кислотность. 6. Потеря в массе при высушивании для гидратов (сульфацетамид-натрий). 7.В препарате фталазол определяется примесь его составных частей – фталевой кислоты и норсульфазола. Фталевая кислота – водное извлечение титруют 0,05 и NaOH по фенолфталеину (не более 0,35 мл). COOH COONa +2NaOH COOH + 2H2O COONa fэкв (фталиевой кислоты) = 1/2 Норсульфазол со свободной ПАА растворяется в HCl, фталазол – нет. Титруют нитритометрически солянокислое извлечение – не более 0,2 мл NaNO2 или 0,5%. Из результатов количественного определения фталазола вычитают % содержание норсульфазола x 1,58 (соотношение молекулярных масс фталазола и норсульфазола). Во фталилсульфатиазоле определяют специфические примеси его составных частей: фталевую кислоту и норсульфазол (сульфатиазол). Для определения фталевой кислоты готовят водное извлечение при нагревании (фталазол в воде нерастворим, а фталевая кислота растворима в горячей воде) и титруют раствором натрия гидроксида. На титрование должен расходоваться определенный объем титрованного раствора. Для определения примеси сульфатиазола ЛВ взбалтывают с хлороводородной кислотой. Примесь растворима, а фталилсульфатиазол(фталазолд) не растворим в хлороводородной кислоте; фильтруют, в фильтрате определяют сульфатиазол(норсульфазол) нитритометрическим методом. На титрование должен расходоваться определенный объем титрованного раствора натрия нитрита. 4. Посторонние примеси: определяют методом ТСХ тонкослойной хроматографии на пластинках «Силуфол». Хроматограмму проявляют в УФ свете, должно быть одно пятно, соответствующее веществу. Количественное определение 1. ФС Нитритометрuческий метод – общий метод для препаратов группы. Метод основан на свойстве ЛВ, содержащих первичную ароматическую аминогруппу, количественно взаимодействовать с натрия нитритом в присутствии хлороводородной кислоты с образованием солей диазония. Фталазол (фталилсульфатиазол) определяют после кислотного гидролиза. Определение проводят с учетом особенностей нитритометрического титрования и указаниями частных статей (КВr – катализатор, температура – стабилизатор, медленно, в среде НCI разв.). Стрептоцид, сульфацил-натрий, норсульфазол титруют по внутреннему индикатору (соответственно тропеолин 00 + метиленовый синий; нейтральный красный; тропеолин 00), при температуре 15-20оС. Сульфадиметоксин и сульфален – по внешнему индикатору (йодкрахмальная бумага), сульфаметоксазол (в бисептоле) – индикатор внешний или потенциометрически с охлаждением до 0-5оС. 2.Ацидиметрический метод вытеснения (для натриевых солей). Метод основан на свойстве сильной минеральной кислоты вытеснять слабую кислоту из её соли. Среда – спирт + ацетон. Индикатор смешанный (метиловый оранжевый и метиловый синий) или метилоранж. SO2 N CO H2N CH3 + HCl CH3 + NaCl SO2 N CO H H2N Na fэкв.(ЛВ) = 1. 3.Алкалиметрuческuй метод нейтрализации, вариант обратного титрования для с/а с выраженными кислыми свойствами. Среда – вода + ацетон (для с/а с Кдис= 10-7-10-8: норсульфазол, фталазол) для подавления гидролиза. К навеске ЛВ прибавляют избыток титрованного раствора натрия гидроксида, остаток титруют хлороводородной кислотой, индикатор тимолфталеин. N H2N SO2 N H N S NaOH H2N SO2 N S + H2O Na Fэкв. норсульфазола = 1, fэкв фталазола = 1/2. O HN O C HN COOH C COONa + 2NaOH N SO 2 + 2H2O N HN S SO 2 N S Na Для с/а с Кдис < 10-9 используют кислотно-основное титрование в неводном растворителе. Если К дис ещё меньше - их кислотные свойства выражены очень слабо (стрептоцид), то в среде ДМФА не может быть оттитрован, но он титруется в среде н-бутиламина раствором метилата натрия, индикатор – азафиолетовый. 4.Метод кuслотно-основного титрования (алкалиметрия) в среде протофильного растворителя (диметилформамида). Титрант - раствор натрия гидроксида в смеси метилового спирта и бензола. Индикатор тимоловый синий. Метод основан на свойстве диметилформамида, обладающего способностью присоединять протон, усиливать кислотные свойства сульфаниламидов. Для кислотных форм сульфаниламидов реакция солеобразования протекает по сульфамидной группе (см. раздел «Химические свойства» ), fэкв.(лв) = 1. Метод ФС для веществ с блокированной ароматической амино-группой фталазол (фталилсульфатиазол). В этом случае реакция солеобразования основана на кислотных свойствах, обусловленных карбоксильной группой ароматического кольца остатка фталевой кислоты и подвижного водорода сульфамидной группы, fэкв.(фталилсульфатиазола) = 1/2. растворитель – ДМФА (диметилформамид) титрант – раствор гидроксида натрия в смеси метанол + бензол инд. – тимоловый синий. N CO N H + 2 H SO2 N H C N S CH3 CH3 O COOH N CO N H SO2 + H N C S + CH3 N CH3 OH COO N NaOH CO N H COONa SO2 N Na S + H C N CH3 CH3 + H2O O Кстех = 1/2 fэкв = Кстех Э = 1/2 М С*Э Т= 1000 VKT С% = a *100 титрант РЧ(1) 5.Броматометрия или йодхлорметрия (вариант обратного титрования) для ЛВ, содержащих первичную ароматическую аминогруппу на основе реакций галогенирования. А) броматометрическое титрование KBrO3 + 5 KBr + 6HCl 3 Br2 + 6 KCl+ 3H2O Br SO2 N R + H H2N 2 Br2 SO2 N R + H H2N 2 BrH Br Br2 + 2 KY Y2 + 2 KBr Y2 + 2Na2S2O3 2 NaY + Na2S4O6 Б)йодхлорметрия 6.Аргентометрический метод, вариант прямого титрования по Мору. Метод основан на свойстве сульфаниламидов образовывать серебряные соли по сульфамидной группе. Для уменьшения концентрации водородных ионов, растворяющих осадок, реакцию проводят в присутствии натрия тетрабората. Индикатор – хромат калия. В точке эквивалентности образуется оранжево-желтый осадок серебра хромата. H2N S O N O N O + AgNO3 NH H2N S S N O Ag + HNO3 S 2HNO3 + Na2B4O6 + 5H2O → 4H3BO3 + 2NaNO3 2AgNO3 + K2CrO4 → Ag2CrO4↓ + 2KNO3 7. Фотоколориметрический метод. ФС метод для салазопиридазина – по собственной окраске. Метод основан на свойстве окрашенных растворов веществ поглощать полихроматический свет в видимой области спектра. Для получения окрашенных соединений используют реакцию образования азокрасителя или реакцию конденсации с ароматическими альдегидами . 8. Спектрофотометрический метод в видимой области спектра для салазопиридазина. Определение проводят при длине волны 457 нм. Расчёт проводят по величине оптической плотности РСО. Метод основан на свойстве растворов веществ поглощать монохроматический свет в УФобласти спектра. 9. Рефрактометрия (10 и 20% растворы сульфацил-натрия). Хранение По списку Б, в хорошо укупоренной таре, в защищённом от света месте При хранении с/а легко окисляются, особенно в водных растворах (сульфацил-натрия). Раствор приобретает желтую окраску. Поэтому при приготовлении растворов добавляют стабилизатор – антиоксидант сульфит или метабисульфит натрия. При окислении образуются различные соединения, содержащие системы сопряженных связей. Например, доказано, что одним их основных продуктов окисления с/а кислородом воздуха на свету являются гидроксиаминопроизводные. В растворах возможны процессы гидролиза – ощущается запах уксусной кислоты. Стабилизируют 1М NаОН до рН 7,5 – 8,5. Применение Сульфаниламиды антибактериальные средства обладают бактериостатическим действием, . применяются при инфекционных заболеваниях, вызванных менингококками, стафилококками, пневмококками. По характеру действия их можно подразделить на несколько групп: создающая высокую концентрацию в крови и органах (стрептоцид, норсульфазол, сульфадиметоксин, сульфален, бисептол и др). Применяются при пневмонии, трахеобронхитах, воспалительных заболеваниях. создающая высокую концентрацию в кишечнике (трудно всасываются), оказывающие здесь своё антибактериальное действие – фталазол, сульгин, салазопиридазин. Применяется фталазол при инфекционных заболеваниях желу дочно-кишечного тракта. Салазопиридазин применяется при неспецифическом язвенном колите. создающая высокую концентрацию в мочевых путях – сульфален, уросульфан; в желчи – сульфален. Сульфален хорошо проникает в жидкости и ткани организма. Применяется при заболеваниях органов дыхания, желчевыводящих путей, мочевыводящих путей. Скорость выведения отдельных групп препаратов из организма определяет частоту приема. В соответствии с этим сульфаниламиды делят на препараты: короткого действия (по 0,5 -1,0 г через 4-6 часов) длительного действия (сульфадиметоксин – интервал между приемами может достигать 24 часа) сверхдлительное – сульфален 2,0 г один раз в 7-10 дней. Сульфаниламиды нельзя назначать с производными n – аминобензойнойкислоты (местные анестетики) Салазопиридазин Salazopyridazinum (ЛН) Салазопиридазин Salazopyridazinum (ЛН) N N 4 3 6 2 1 5 OH COOH O 2S N 1 6 NH 5 N 2 3 OCH 3 4 5-(п-[N-(З- метоксипиридазинил -6)- сульфамидо]-фенилазо)-салициловая кислота Синтез из сульфапиридазина и салициловой кислоты NaNO2 N N H2N SO2 N H CH3O N N (N N SO2 N H HCl CH3O ) Cl COOH N N OH HO N N SO2 N H CH3O HOOC Описание мелкокристаллический порошок оранжевого цвета без запаха, практически не растворим в воде, мало растворим в спирте, растворим в щелочах. Подлинность 1. Комплексообразование с сульфатом меди – зеленый осадок. 2. Восстановление азогруппы до диазоrpуппы цинковой пылью в среде серной кислоты, раствор препарата обесцвечивается Zn R1 N N R оранжевый цвет H2SO4 R1 N N R H H обесцвечивание раствора 3. Спектр в видимой области от 400 до 600 максимум 457 нм. Количественное определение 1. ФС Фотоколориметрический метод по собственной окраске. Метод основан на свойстве окрашенных растворов веществ поглощать полихроматический свет в видимой области спектра, с использованием раствора стандартного образца. 2. ФС Спектрофотометрический метод в видимой области спектра для салазопиридазина. Определение проводят при длине волны 457 нм. Расчёт концентрации проводят по величине оптической плотности РСО. 3. Полярографический метод (метод исключен из ХII ГФ). Применяется для салазопиридазина. Метод основан на электровосстановлении вещества на микроэлектроде. Определение проводят на полярографе. Снимают полярограммы для серии стандартных растворов и строят калибровочный график. Затем снимают полярограмму исследуемого раствора, определяют высоту полярограммы и по калибровочному графику находят концентрацию. I мкА h (мм) Е, В Полярограмма h (мм) hx C, г/мл Cx Калибровочный график Концентрацию раствора можно также определить по формуле: cст. • hx cx = hст. Хранение: ХУТ, сухое, защищенное от света место. Применение: антибактериальное средство, при неспецифических язвенных колитах. Комбинированный препарат Сульфаметоксазол + Триметоприм синонимы – Бактрим Bactrim, Бисептол Biseptol , Ко-тримаксазол» Со- Trimoxazole H2N H2N + SO2NH2 N сульфаметоксазол O CH3 N N OH CH3O C H2 CH3O CH3O триметоприм 4-амино-N –(-5-метил-3-изоксазалил) - бензолсульфонамид Описание Белый с кремовым оттенком кристаллический порошок, не растворим в воде, растворим в этаноле и ацетоне, мало в хлороформе ми эфире. Растворим в разбавленных растворах натрия гидроксида. Подлинность (на сульфаметоксазол) 5. Комплексообразование с сульфатом меди – желтовато-зеленоватый осадок 6. реакция образования азокрасителя 7. УФ-спектр в хлороформе максимум 246нм и плечо 262-276нм 8. ТСХ – после проявления реактивом Драгендорфа должны обнаруживаться 2 пятна на уровне веществ-свидетелей. Здесь же определяют допустимые посторонние примеси, стрептоцид и сульфаниловую кислоту. 9. Хлороформное извлечение таблеток с водным раствором бромфенолового синего окрашивается (нижний слой) в интенсивно красный цвет. Количественное определение: отдельно для каждого компонента. 1.Сульфаметоксазол – нитритометрически (индикатор внешний или потенциометрически, при охлаждении). 2. Триметоприм – КОТ в среде неводного растворителя – смеси ледяной уксусной и уксусного ангидрида. Титрант хлорная кислота, индикатор – кристаллический фиолетовый. 3.Раствор д/ин– СФМ по удельному показателю поглощения Хранение ХУТ, прохладное, сухое, защищенное от света место Применение антибактериальное средство.