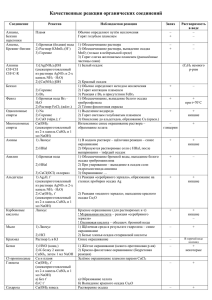
13x6 Команда гимназии №44 10 класс «Химипузики»
реклама

13x6 Команда гимназии №44 10 класс «Химипузики» г. Иркутск Руководитель : Иевлева Ирина Фёдоровна II тур Интернет-проекта «Путешествие в мир химии» 2012-2013 Творческое задание Часть 1 – Теоретическая. Таблица № пробирки (Набор Б) Реактивы Индикаторная бумажка CuSO4•NaOH (изб) (при to = 25oC) CuSO4•NaOH (изб) 1 (Нет изменений) Тёмно-синий раствор (Нет изменений) 2 Синее окрашивание 3 (Нет изменений) 4 (Нет изменений) 5 Красное окрашивание 6 Красное окрашивание (при ↑ to) (Вещество идентифицировано) Синий раствор ↑ газ, окрашивающий влажную индикаторную бумажку в синий цвет Возможно: ↓ осадок бирюзового цвета Вывод Осадок красного цвета (Нет изменений) (Нет изменений) Сорбит C6H14O6 Крбонат натрия Na2CO3 Глюкоза C6H12O6 Мочевина (NH2)2CO Сульфат аммония (NH4)2SO4 Янтарная к-та COOH-(CH2)2-COOH Часть 1 – Теоретическая. Уравнения реакций I) Индикаторная бумажка: 2. Na2CO3 + H-OH ↔ NaHCO3 + NaOH 2Na+ + CO32- + H-OH ↔ Na+ + HCO3- +Na+ + OH5. (NH4)2SO4 + H-OH ↔ NH4OH + NH4HSO4 2NH4+ + SO42- + H-OH ↔ NH4OH + NH4+ + H+ + SO426. HOOC-(CH2)2-COOH (aq) ↔ OOC-(CH2)2-COO2- + 2H+ Наличие избытка данных ионов приводит к изменению цвета индикатора II) CuSO4•NaOH(изб.): CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 1. 2HO-CH2-(CH(OH))4-CH2-OH + Cu(OH)2 → 2H2O + HO-CH2 CH2-O Cu Тёмно-синее окрашивание O-CH CH-OH раствора. При нагревании не (HO-CH)3 произойдёт ни каких изменений. (CH-OH)3 CH2-OH HO-CH2 Часть 1 – Теоретическая. Уравнения реакций 3. 2HO-CH2-(CH(OH))4-CH=O + Сu(OH)2 → 2H2O + CH2-O CH-OH (CH-OH)3 HO-CH2 Cu O-CH (HO-CH)3 CH CH O O CH2-O Тёмно-синее окрашивание раствора HO-CH2 o t Cu O-CH + 3 Сu(OH)2 → 2Cu2O↓ + 2H2O + CH-OH 2HO-CH2-(CH(OH))4-COOH (HO-CH)3 (CH-OH)3 CH CH O O Осадок красного цвета Часть 1 – Теоретическая. Уравнения реакций 4. (NH2)2CO + NaOH → NH3↑+ H2NCOONa NH3 + H2O ↔ NH4OH NH4OH ↔ NH4+ + OH5. (NH4)2SO4 + 2NaOH → Na2SO4 + 2NH4OH NH4OH ↔ NH3↑ + H2O NH4OH ↔ NH4+ + OH↑ - выделяющийся газ Наличие избытка данных ионов приводит к изменению цвета индикатора O 6. Возможно: CH2-C O HOOC-(CH2)2-COOH + Cu(OH)2 → 2H2O + Cu ↓ O CH2-C O Осадок бирюзового цвета Часть 2 – Экспериментальная. План Для экспериментальной часть были взяты: Щавелевая кислота (HOOCCOOH), Хлорид аммония (NH4Cl) и Фруктоза (С6H12O6) из набора Г. Реактивы: Индикаторная бумага, NaOH, CuSO4, AgNO3 1. Добавить в бюксы с веществами воду до полного растворения веществ. 2. Пробу раствора каждого вещества (1-2 капли) поместить в углубление планшета и опустить туда индикаторную бумагу – в одном случае даст красное окрашивание. 3. Взять в чистые пробирки пробы каждого определяемого вещества (по 2-3 капли) и добавить гидроксид натрия. Над пробирками расположить смоченную водой индикаторную бумагу – в одном случае синее окрашивание. 4. В эти же пробирки добавить сульфат меди – в одном случае образуется синий раствор. 5. К свежим пробам веществ добавить нитрат серебра. В одном случае выпадет мелкодисперсный белый осадок, в другом белый творожистый осадок. Часть 2 – Экспериментальная. Уравнения I) Индикатор: 1. HOOC-COOH (aq) ↔ OOC-COO2- + 2H+ 2. Раствор NH4Cl не даст окрашивание индикатора, т.к. раствор свежеприготовленный, а для гидролиза требуется время. II) NaOH: NH4Cl + NaOH → NaCl + NH4OH NH4OH ↔ NH3↑ + H2O NH4OH ↔ NH4+ + OHНаличие избытка данных ионов приводит к изменению цвета индикатора III)CuSO4: CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 2C6H12O6 + Cu(OH)2 → 2H2O + (C6H11O6)2Cu Придаёт раствору тёмно-синее окрашивание Часть 2 – Экспериментальная. Уравнения IV) AgNO3: 1. 2AgNO3 + H2C2O4 → Ag2C2O4↓ + 2HNO3 Белый, мелкодисперсный 2. AgNO3 + NH4Cl → NH4NO3 + AgCl↓ Белый, творожистый Вывод: 1) Вещество, дающее красную окраску индикатора (I), и выпадение белого мелкодисперсного осадка (IV) – Щавелевая к-та 2) Вещество, дающее выделение газа, окрашивающего индикаторную бумагу в синий цвет (II), и дающее выпадение белого творожестого осадка (IV) – Хлорид аммония 3) Вещество дающее тёмно-синее окрашивание раствора (III) – Фруктоза. Часть 2 – Экспериментальная. Фотоотчёт Часть 2 – Экспериментальная. Фотоотчёт Часть 3 – Педагогическая. Таблица Вещества: С6Н4(ОН)СООН и C12H22O11 Реактив: NaOH и CuSO4 № CuSO4 → NaOH (изб) бюкса Вывод O 1 Образуется раствор зелёного цвета C OH Салициловая кислота OH CH2OH (Нет изменений) → 2 Образуется тёмносиний раствор H H OH O H H OH H Сахароза OH CH2OH H O H HO O CH2OH OH H Часть 3 – Педагогическая. Уравнения реакций 1. 2С6Н4(ОН)СООН + CuSO4 → [Cu(С6Н4(ОН)СООН)2] SO4 Комплексное соединение, окрашивающее раствор в зелёный цвет 2. CuSO4 + 2NaOH → Cu(OH)2↓ + Na2SO4 CH2OH CH2OH H O H H O H H + Cu(OH)2 → 2H2O + 2 H HO OH (C12H21O11)2Cu O OH CH2OH Придаёт раствору H OH OH H тёмно-синее окрашивание Часть 3 – Педагогическая. Фотоотчёт Часть 3 – Педагогическая. Фотоотчёт Часть 3 – Педагогическая. Фотоотчёт Часть 3 – Педагогическая. Оценка работы одноклассников Во время проведения урока по качественному определению органических веществ наши одноклассники, в целом, успешно справились с практической составляющей. Анализ на наличие салициловой кислоты не вызвал ни каких проблем, в отличии от определения сахарозы – здесь у одной группы учащихся плохо пошла реакция из-за малого количества определяющего реактива (Cu(OH)2), в результате того, что не была соблюдена пропорция объёмов веществ вступающих в реакцию по образованию данного реактива – гидроксид натрия следовало брать в большом избытке. Часть 3 – Педагогическая. Оценка работы учителем Оценка творческой части работы – отличная: команда ребят «Химипузики» в составе Половникова Ильи, Бархатовой Виктории и Максимова Влада полностью самостоятельно спланировали и организовали эксперимент для своего класса, подготовили необходимые растворы, написали инструкцию по проведению идентификации предложенных веществ (салициловой кислоты и фруктозы). Построили грамотные выводы для своих исследований, на основе проведенных опытов в школьной лаборатории и полного рассмотрения учебных пособий. Экспериментальная задача, конечно, выходит за рамки общеобразовательной школьной программы, но, тем она и оказалась интересной для самой творческой инициативной группы учащихся, а также для всего класса. Безусловно, результаты всех трех этапов этого творческого задания могут быть использованы во внеурочной деятельности, а также на уроках обобщения знаний об органических веществах. С П А С И Б О З А Po V В Н И М А Н И Е !!!