6. Фенолы
реклама

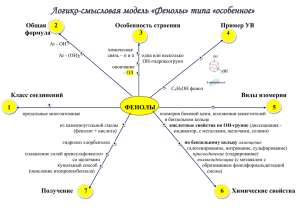
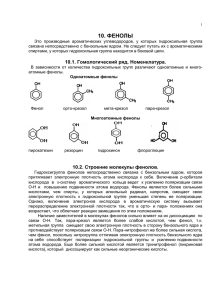
Лекция 6 Одноатомные фенолы Двухатомные фенолы Трехатомные фенолы 1. Щелочное плавление сульфонатов (солей сульфокислот), 1890 г. Механизм SNAr 2. Замещение галогена в арилгалогенидах, Dow-процесс, 1928 г. 3. Окисление изопропилбензола (кумольный метод) П.Г. Сергеев (СССР), 1949 г. Г. Хок (Германия), 1944 г. 4. Из аминов через соли диазония 1. Кислотно-основные свойства 2. Нуклеофильное замещение с участием фенолят-ионов 2.1 Получение простых эфиров, O-алкилирование (реакция Вильямсона) 2.2 Получение сложных эфиров, O-ацилирование Реакция Шоттена–Баумана (1884 г.) 3. Электрофильное замещение Реакции электрофильного замещения протекают очень легко, особенно – в щелочной среде 3.1 Карбоксилирование (реакция Кольбе-Шмитта) 3.2 Алкилирование и ацилирование (по Фриделю-Крафтцу) С фенолами реакции не идут, так как происходит дезактивация катализатора AlCl3 Необходима защита гидроксильной группы 3.3 Галогенирование Идет легко без катализаторов. Например, бромирование сразу идет до трибромпроизводного. Моногалогенпроизводные удается получить только при низкой температуре в сильнокислой среде или малополярных растворителях 3.4 Нитрование 3.5 Сульфирование кинетический контроль термодинамический контроль 3.6 Нитрозирование таутомерное равновесие 3.7 Конденсация с ацетоном Таутомерия – явление обратимой изомерии, при которой два или более изомера (таутомера) легко переходят друг в друга. Этот переход чаще всего связан с миграцией атома водорода из одной группы в другую 3.8 Получение фенолформальдегидных смол Катализаторами являются как кислоты, так и основания активируется фенол активируется карбонильная группа 3.9 Перегруппировка Фриса Межмолекулярная перегруппировка 3.10 Перегруппировка Кляйзена Внутримолекулярная сигматропная перегруппировка – происходит образование новой s-связи между ранее не связанными атомами и разрыв существующей s-связи. Число s- и p-связей остается неизменным. 3.11 Формилирование (реакция Раймера-Тимана) 4. Окисление фенолов Окисление имеет радикальный механизм 5. Восстановление фенолов