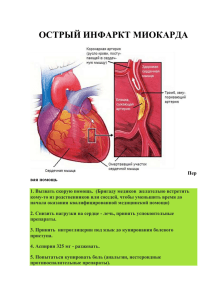
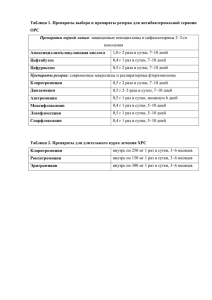
"ОБ ОБРАЩЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ" (С
advertisement

ВЗАИМОЗАМЕНЯЕМОСТЬ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ: ГДЕ БЛАГА ПРЕВРАЩАЮТСЯ В ПОРОК ? Дорофеев Владимир Львович Профессор, доктор фармацевтических наук Советник по научным вопросам, AIPM Фармацевтический форум стран СНГ, 15 февраля 2012 г. φάρμακον (фармакон, греч.) – лекарство, яд В ФЕДЕРАЛЬНОМ ЗАКОНЕ ОТ 12 АПРЕЛЯ 2010 Г. N 61-ФЗ "ОБ ОБРАЩЕНИИ ЛЕКАРСТВЕННЫХ СРЕДСТВ" (С ИЗМЕНЕНИЯМИ ОТ 27 ИЮЛЯ, 11 ОКТЯБРЯ, 29 НОЯБРЯ 2010 Г., 6 ДЕКАБРЯ 2011 Г.) НА ВСЕХ ЕГО ПРИМЕРНО 50 СТРАНИЦАХ СЛОВО «ТОВАР» В ЛЮБЫХ ПАДЕЖАХ И ЛЮБЫЕ ЕГО ОДНОКОРЕННЫЕ СЛОВА НЕ ВСТРЕЧАЮТСЯ НИ ЕДИНОГО РАЗА. Мы будем говорить о лекарственных средствах, то есть о продукции, обладающей уникальными свойствами, для которой первоочередными понятиями являются качество, эффективность и безопасность. GENERIC vs INNOVATOR INNOVATOR: ВРЕМЯ, ДЕНЬГИ, РИСКИ ТОЛЬКО ВЕРШИНА АЙСБЕРГА: Поиск действующего вещества 1. Предположения, моделирование, синтез кандидатов. 2. Исследование кандидатов (химия, токсикология, фармакология …), 3. Отсеивание кандидатов и иногда многократный возврат на первый этап. Расширенное исследование действующего вещества 1. Химия, токсикология, фармакология …. 2. Наработка лабораторных серий. 3. Исследование стабильности, анализ примесей. 4. Отработка масштабного производства. 5. Стандартизация как фармацевтической субстанции. 6. Повтор исследований на разных сериях. 7. … … … GENERIC vs INNOVATOR INNOVATOR: ВРЕМЯ, ДЕНЬГИ, РИСКИ ТОЛЬКО ВЕРШИНА АЙСБЕРГА: Разработка лекарственной формы 1. Выбор вспомогательных веществ, наработка лабораторных серий. 2. Исследование стабильности, анализ примесей … 3. Отработка более масштабного производства. 4. Стандартизация как лекарственного препарата. 5. Повтор исследований на разных сериях. 6. … … … Доклинические и клинические исследования Большой объем, различные фазы. GENERIC vs INNOVATOR GENERIC: FAST, GOOD AND CHEAP? Действующее вещество Молекула уже известна. Разработка лекарственной формы Большее (branded generic) или меньшее число исследований. Доклинические и клинические исследования В основном – исследование биоэквивалентности. Существенно быстрее и дешевле разработка. Финансовая доступность пациенту. ЧТОБЫ БЫЛА ЯСНА ПОЗИЦИЯ: ДЖЕНЕРИК НЕ ЕСТЬ ПЛОХО. НО ЦЕНА – ТОЛЬКО ВЕРШИНА АЙСБЕРГА. MULTISOURCE PHARMACEUTICAL PRODUCT ЧТО ПОД ВОДОЙ ? СУБСТАНЦИИ Китай Индия Европа США ПРЕПАРАТ конструктор США Европа Азия MULTISOURCE Тенденция Уже закончился или заканчивается срок действия патентов и периода data exclusivity для большого числа терапевтически важных лекарственных средств. Фармацевтический рынок будет всё более активно пополняться за счет дженериков. ОДНО ИЗ РЕШЕНИЙ ПРОБЛЕМЫ ЗАКОН ХЭТЧА-ВАКСМАНА, США, 1984 Drug Price Competition and Patent Term Restoration Act, «Hatch-Waxman act» Закон «О ценовой конкуренции лекарств и продлении срока действия патентов» Дополнил Federal Food, Drug, and Cosmetic Act 1938 года касательно взаимоотношений производителей оригинальных и дженериковых препаратов. Соломоново решение 1. Установлен период data exclusivity для оригинальных препаратов. 2. Утверждена упрощенная процедура регистрации для дженериков: не требуется проводить доклинические и клинические исследования, допускается только биоэквивалентность. Но закон Хэтча-Ваксмана не снимает другие требования к дженерикам. ТРИ ИСТОЧНИКА «Все правительства должны предпринять шаги к обеспечению качества, безопасности и эффективности всех лекарственных средств, доступных в соответствующих государствах, согласно принятым международным стандартам. Это относится как к оригинальным, так и воспроизведенным лекарственным средствам, к частному и государственному секторам и к импортируемой и производимой на местном рынке продукции». Joint Statement between The International Pharmaceutical Federation (FIP) and the International Federation of Pharmaceutical Manufacturers and Associations (IFPMA): Ensuring Quality and Safety of Medicinal Products to Protect the Patient. – Barcelona: FIP, IFPMA, 1999. Целое есть нечто большее, чем простая сумма его частей. Платон ЛЕКАРСТВЕННОЕ СРЕДСТВО ЭФФЕКТИВНОСТЬ БЕЗОПАСНОСТЬ КАЧЕСТВО Терапевтические свойства Побочное действие Подлинность Чистота Количество ВЗАИМОЗАМЕНЯЕМОСТЬ (INTERCHANGEABILITY) ? ВЗАИМОЗАМЕНЯЕМОСТЬ Термин касается замены оригинального препарата на дженерик или замены одного дженерика на другой С ТЕМ ЖЕ ДЕЙСТВУЮЩИМ ВЕЩЕСТВОМ. Термин не касается замены препарата с одним действующим веществом на препарат с другим действующим веществом. Последнее является терапевтической заменой, непосредственное участие в которой должен принимать специалист здравоохранения, работающий в конкретном лечебном учреждении и знающий свою группу пациентов. Любая автоматическая замена без участия такого специалиста недопустима. FAQ ЯВЛЯЮТСЯ ЛИ ВСЕ ДЖЕНЕРИКИ ВЗАИМОЗАМЕНЯЕМЫМИ? НЕТ Проблема эквивалентности дженериков известна более 60 лет КАК УЗНАТЬ, ЧТО ЯВЛЯЕТСЯ ВЗАИМОЗАМЕНЯЕМЫМ? БИОЭКВИВАЛЕНТНОСТЬ Замена оригинального лекарственного средства на воспроизведенное «должна проводиться только в том случае, когда воспроизведенное лекарственное средство соответствует принятым международным стандартам, включая биоэквивалентность…». Joint Statement between The International Pharmaceutical Federation (FIP) and the International Federation of Pharmaceutical Manufacturers and Associations (IFPMA): Ensuring Quality and Safety of Medicinal Products to Protect the Patient. – Barcelona: FIP, IFPMA, 1999. КАК ОЦЕНИТЬ БИОЭКВИВАЛЕНТНОСТЬ? 1. Сравнительные исследования in vivo («на живом»), в данном случае на людях: Чаще сравнительное изучение содержания лекарственного вещества в крови, в других жидкостях, а также в органах человека после приема препаратов – фармакокинетические исследования. Сравнительные клинические исследования – изучение лечебного (терапевтического) действия препаратов. Основной вариант для биоаналогов. Сравнительное изучение отдельных эффектов, вызываемых приемом лекарственных препаратов (фармакодинамические исследования). КАК ОЦЕНИТЬ БИОЭКВИВАЛЕНТНОСТЬ? 2. Сравнительные исследования in vitro («в пробирке») c использованием приборов, позволяющих оценить высвобождение действующего вещества из препарата. Обычно – тест «растворение». Эта процедура известна как BIOWAIVER. Время, мин Время, мин ТЕРАПЕВТИЧЕСКАЯ ЭКВИВАЛЕНТНОСТЬ ? ТЕРАПЕВТИЧЕСКАЯ ЭКВИВАЛЕНТНОСТЬ В ОГНЯХ «СВЕТИЛЬНИКА ДЖЕКА» FDA США (FOOD AND DRUG ADMINISTRATION) «ОРАНЖЕВАЯ КНИГА» Использование соответствующих кодов терапевтической эквивалентности может служить ориентиром при замене одного препарата на другой и помочь, в частности, в снижении стоимости лечения. Октябрь 1980 г., FDA, Office of Generic Drugs: «It's almost Halloween. How about orange?» FDA: КРИТЕРИИ ТЕРАПЕВТИЧЕСКОЙ ЭКВИВАЛЕНТНОСТИ 1. Препараты должны быть зарегистрированы как эффективные и безопасные. 2. Препараты должны содержать одинаковые действующие вещества в одной дозе, иметь одинаковую лекарственную форму (например, таблетки), должны быть предназначены для одного пути введения и должны быть качественными. 3. Препараты должны являться биоэквивалентными. 4. Препараты должны производиться в соответствии с требованиями надлежащей производственной практики (GMP). 5. Препараты должны иметь надлежащую инструкцию. Вывод: МНН активного вещества не является и не может являться единственным критерием при выборе взаимозаменяемых препаратов. ОРИГИНАЛЬНЫЕ И АНАЛОГИЧНЫЕ БИОЛОГИЧЕСКИЕ ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ: не углубляясь в подробности Биотехнологические препараты: например, генно-инженерные белки (инсулин). Иммунобиологические препараты: например, вакцины, сыворотки, аллергены. Средства генной и клеточной терапии. Лекарственные средства биологического и биотехнологического происхождения имеют сложное строение и состав, их производство и контроль качества имеют массу особенностей. К биоаналогам (biosimilars) неприменим «дженерический» подход. Поэтому в отношении биоаналогов не используется понятие «дженерик» или «воспроизведенное лекарственное средство». Вопрос биопрепаратов требует отдельного рассмотрения, но аксиома «качество – эффективность – безопасность» и здесь является основой. НАДЛЕЖАЩАЯ ПРОИЗВОДСТВЕННАЯ ПРАКТИКА GOOD MANUFACTURING PRACTICE (GMP) ОБЕСПЕЧЕНИЕ КАЧЕСТВА (QUALITY ASSURANCE) У производителя тогда на выходе имеются качественные лекарства, когда они получаются таковыми в процессе производства, а не потому что хорошо отбраковываются некачественные. Лекарственные средства, производимые без соответствия международным стандартам GMP, не могут быть однородными от серии к серии и не имеют гарантии качества, эффективности, безопасности. Доказанная терапевтическая эквивалентность для одной серии такой продукции не будет означать, что вся продукция в последующем будет соответствовать необходимым стандартам биоэквивалентности. СТРУНЫ ИННОВАЦИОННОГО ПРОСТРАНСТВА КВАЛИФИЦИРОВАННЫЙ ПЕРСОНАЛ R&D СОВРЕМЕННОЕ ОБОРУДОВАНИЕ СОВРЕМЕННОЕ ОБРАЗОВАНИЕ ГАРМОНИЗИРОВАННЫЕ СТАНДАРТЫ ЧИСТЫЕ ПОМЕЩЕНИЯ ИНВЕСТИЦИИ ГАРМОНИЗИРОВАННАЯ ПОЛИТИКА ВЗАИМОЗАМЕНЯЕМОСТЬ КАЧЕСТВО ЭФФЕКТИВНОСТЬ БЕЗОПАСНОСТЬ СТРУНЫ БИОЭКВИВАЛЕНТНОСТЬ