Презентация к уроку Уравнение состояния идеального газа
реклама

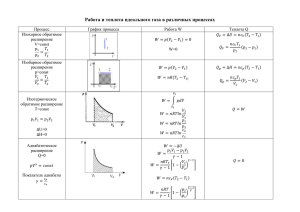
Краевое государственное бюджетное профессиональное образовательное учреждение «Заринский политехнический техникум» УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ГАЗОВЫЕ ЗАКОНЫ Малеева Татьяна Николаевна Ответьте на вопросы: • От чего зависит скорость движения молекул газа? • Записать формулу, по которой определяется среднеквадратичная скорость молекул. • Кто впервые экспериментально определил среднеквадратичную скорость молекул. • В чем заключается суть опыта Штерна? • Молекулы какого вещества движутся быстрее: углерода или азота? Почему? • Скорость молекул газов составляет несколько сотен метров в секунду. Почему же тогда запахи веществ распространяются значительно медленнее? Актуализация знаний • Давайте вспомним, что такое идеальный газ • Что мы называем макроскопическими параметрами? • Какие величины относятся к макроскопическим параметрам? • Что мы называем основным уравнением МКТ идеального газа? • Какие параметры связывает основное уравнение МKT идеального газа? УРАВНЕНИЕ СОСТОЯНИЯ ИДЕАЛЬНОГО ГАЗА. ГАЗОВЫЕ ЗАКОНЫ Уравнение состояния идеального газа Зависимость давления идеального (достаточно разреженного) газа от температуры и концентрации его молекул имеет вид: p = nkT Попытаемся получить на основе этой зависимости уравнение, связывающее все три макроскопических параметра, характеризующие состояние идеального газа: p, V , T m N 1 p= p = nkT n = N А kT V M V m N обе части уравнения умножим на V, получим : pV = А kT M 23 -23 . х х х p = N kT N = m NА V M NAk = R = 6,02 10 1/моль 1,38 10 Дж/К = 8,31Дж/(моль К) R = 8,31 Дж/(моль К) – универсальная газовая постоянная m pV = RT M уравнение состояния идеального газа Запишем уравнение состояния pV = m RT в виде M pV m = R M T Выберем газ с молярной массой М и рассмотрим два его состояния в закрытом сосуде (m = const) pV m = R M T p1V1 m = R M T1 p2V2 m = R M T2 p1V1 pV = 2 2 T1 T2 получил Б.Клапейрона Клапейрон уравнение m pV = RT M уравнение получил Д.И.Менделеев Менделеева - Клапейрона ppV p2V2 1V1 ==const TT1 T2 С помощью уравнения состояния можно исследовать процессы, в которых масса газа постоянна: m = const Количественные зависимости между двумя параметрами газа при неизменном значении третьего параметра называют газовыми законами. Процессы, протекающие при неизменном значении одного из параметров: p, V, T называют изопроцессами. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС Процесс изменения состояния газа при постоянной температуре называют ИЗОТЕРМИЧЕСКИМ pV = const T при Т = const pV = const Закон Бойля – Мариотта: для газа данной массы произведение давления на объем постоянно, если температура не меняется р1V1 = р2V2 ИЗОПРОЦЕССЫ В ГАЗАХ процесс m = const закон графики Бойля изотермиМариотта ческий изотермы Т = const р1V1 = р2V2 р р V T1<T2 р2 T2 р1 T1 V V T T ВАЖНО: из двух изотерм в координатах pV выше расположена та, на которой температура больше. Из графиков видно, что при фиксированном значении V р1 < р2, что возможно лишь при T1<T2 ИЗОБАРНЫЙ ПРОЦЕСС Процесс изменения состояния газа при постоянном давлении называют ИЗОБАРНЫМ pV = const T при р = const V = const T Закон Гей-Люссака: для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется V1 V2 = T1 T2 ИЗОПРОЦЕССЫ В ГАЗАХ процесс закон графики m = const изобарный р = const Гей Люссака V1 T1 = изобары V2 V T2 V2 p2 < p1 V1 р р р2 р1 T T V T ВАЖНО: из двух изобар в координатах VТ выше расположена та, на которой давление меньше. Из графиков видно, что при фиксированном значении Т V1 < V2 , что возможно лишь при p1 > p2 ИЗОХОРНЫЙ ПРОЦЕСС Процесс изменения состояния газа при постоянном объеме называют ИЗОХОРНЫМ pV = const T при V = const p = const T Закон Шарля: для газа данной массы отношение давления к температуре постоянно, если объем газа не меняется р1 р2 = T1 T2 ИЗОПРОЦЕССЫ В ГАЗАХ процесс m = const изохорный V = const закон графики Шарля p1 T1 = Изохоры p2 р T2 V2 < V1 p2 p1 р V V2 V1 T T V T ВАЖНО: из двух изохор в координатах pТ выше расположена та, на которой объем меньше. Из графиков видно, что при фиксированном значении Т р1 < р2 , что возможно лишь при V2 < V1 . Расположите номера процессов в соответствующие колонки таблицы V р 2 T V р 1 V р 7 р р V 13 14 р изохорное 12 T V 17 18 T T V изотермическое V V р 16 T 6 11 T р 15 T V 10 р T р р T: V 5 T V 9 V 4 T 8 T р 3 изобарное нагревание охлаждение расширение сжатие нагревание охлаждение 13, 14, 15 3, 5, 8 4, 6, 7 11, 12, 18 1, 2, 9 10, 16, 17 Решить задачу Давление воздуха в велосипедной шине при температуре 42ºС равно 1,7·10 Па. Каким станет давление воздуха в шине при понижении температуры до 12ºС? Дано: СИ Решение t1 = 42ºC 315K процесс изохорный p1 = 1,7·105 Па р1 р2 р1Т 2 t2 = 12ºC 285K Т Т р 2 1 2 Т1 p2 -? 1,7 105 285 р2 1,5 105 Па 315 5 Ответ: 1,5·10 Па Ответить на вопросы. • Что называют уравнением состояния идеального газа? • Какая форма уравнения состояния содержит больше информации: уравнение Клапейрона или уравнение Менделеева-Клапейрона? • Почему газовую постоянную называют универсальной? • Какие изопроцессы характерны для газов? • Сформулировать газовые законы. Домашнее задание: Мякишев Г.Я. Буховцев Б.Б. § 68-69 Упражнение 13 №1, №9.