25. Лекция №6 Нарушение гемостаза
реклама

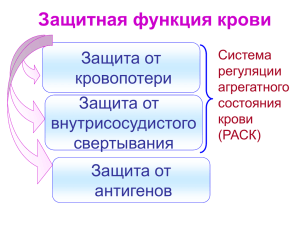
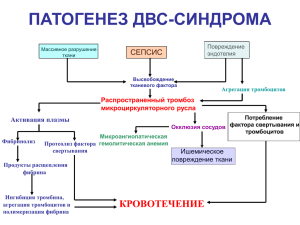
Тема: НАРУШЕНИЕ ГЕМОСТАЗА И РЕОЛОГИЧЕСКИХ СВОЙСТВ КРОВИ Лекция № 6 Лектор: профессор Х.З. Турсунов Цель: ознакомить с видами НК, сопровождающихся с нарушением гемостаза и реологических свойств крови. Педагогические задачи: Ознакомить с механизмом гемостаза в норме. Дать определение cтаза, тромбоза и виды тромбов, исходы и значение их. Знать виды эмболов по природе, их осложнения. Дать определение ДВС-синдрома и шока, их этиологию, патогенез и морфологические проявления. Ожидаемый результат: Дают определение тромбоза, эмболии, шока и ДВС-синдрома. Знают виды эмболов и тромбов. Раскрывают этиологию и патогенез ДВС-синдрома и шока. Описывают макро- и микроскопические изменения в органах и тканях. Методы обучения: лекция АННОТАЦИЯ В лекции рассматриваются определение, классификация, причины и патогенез нарушений кровообращения, сопровождающихся нарушение гемостаза и реологических свойств крови: тромбоза, эмболии, ДВС-синдрома и шока. Изучается механизм свертывания крови в норме, морфология, осложнения и исходы тромбов, эмболов. Описывается причины и патологическая анатомия ДВС синдрома, дается классификация и морфология шока. ABSTRACT A lecture gives a general understanding of the disease: definition, etiology, pathogenesis and classification. It’s explaining the biological nature of the disease. It’s disclosing the reasons and the mechanism of alteration of the cell. It’s specifying types of adaptive responses to cell damage. It’s distinguishing morphological manifestations of otherness. It gives the definition and classification of parenchymal dystrophy. It’s describing the macro- and microscopic changes in the parenchymatous organs. It’s explaining the outcome and significance of parenchymal dystrophy. НАРУШЕНИЯ ГЕМОСТАЗА И РЕОЛОГИЧЕСКИХ СВОЙСТВ КРОВИ СТАЗ Стаз — это замедление и остановка кровотока в сосудах микроциркуляторного русла. С общебиологической точки зрения стаз следует рассматривать как срыв или декомпенсацию приспособительных механизмов, лежащих в основе регуляции периферического кровообращения и кровенаполнения. Изменение кровотока, непосредственно предшествующее стазу, именуется как престатическое, Изменения, которые следуют за разрешением стаза,— постстатические. Эти изменения обусловливают дополнительные расстройства — ишемическую деструкцию, диапедезные кровоизлияния. Престатическое состояние крови может способствовать тромбообразованию. Стойкие стазы обычно приводят к некрозу. Стаз необходимо дифференцировать со «сладж-феноменом». Сладж – это феномен склеивания эритроцитов не только в капиллярах, но в сосудах различного калибра, в том числе в венах и артериях. ТРОМБОЗ Тромбоз — это процесс прижизненного выделения из крови плотных масс с осаждением их на стенке или в просвете сосуда, то есть прижизненное свертывание крови. Эта плотно свернувшаяся масса называется тромбом. Тромбоз — весьма важный физиологический процесс, возникающий вследствие активации гемостаза — защитной реакции организма, направленной на остановку кровотечения при повреждении стенки сосуда. ГЕМОСТАЗ В процессе гемостаза важную роль играют: 1) эндотелиальные клетки, 2) форменные элементы крови, особенно тромбоциты, 3) свертывающая система крови. Интактные эндотелиальные клетки, обладают множеством функций, служат главным образом для ингибиции (угнетения) адгезии тромбоцитов на начальных этапах свертывания крови. И, наоборот, при повреждении эндотелиальных клеток их противосвертывающее свойство исчезает, и они принимают активное участие в тромбообразовании. В неповрежденном сосуде интактный эндотелий изолирует тромбоциты, плазменные факторы свертывания крови от активного тромбогенного субэндотелиального компонента, в основном от коллагена. Таким образом, тромбоциты, находящиеся в токе крови, в норме не прилипают к эндотелиоцитам. Нормальные эндотелиальные клетки обладают также мощным противосвертывающим свойством благодаря наличию на их поверхности гепариноподобной субстанции и белка — тромбомодулина. Нормальные эндотелиальные клетки обладают также мощным противосвертывающим свойством благодаря наличию на их поверхности гепариноподобной субстанции и белка — тромбомодулина. Другой антикоагулянт — тромбомодулин, активирует действие другого антикоагулянта — протеина С. Активированный протеин С ингибирует тромбобразование путем протеолитического расщепления факторов V и VIII. Комплекс тромбин — тромбомодулин, образующийся на эндотелиальных клетках, ингибирует тромбообразование двумя разными путями: во-первых, активирует протеин С, что способствует антикоагуляции, во-вторых, снижает способность тромбина активировать образование тромба. Повреждение эндотелия сразу вызывает адгезию тромбоцитов к субэндотелиальному коллагену. Эндотелиальные клетки секретируют фактор ван-Виллебранда (компонент фактора VIII комплекса), который необходим для прикрепления тромбоцитов к коллагену и другим поверхностям. Это один из механизмов, с помощью которого процесс свертывания крови локализуется в пределах поврежденного эндотелия. Тромбоциты играют ключевую роль в гемостазе. Они представляют собой цитоплазматические фрагменты мегакариоцитов костного мозга — кровяные пластинки (бляшки Биццоцеро) и рассматриваются как важные и сложные элементы крови. В крови тромбоциты имеют овальную или округлую форму с гладкой поверхностью. В них выделяют четыре зоны: 1) надмембранную — гликокаликс, 2) мембранную, 3) гель зону — матрикс, 4) зону органелл. Основными физиологическими свойствами тромбоцитов являются: 1) способность к адгезии и агрегации, 2) сорбционно-транспортная функция, 3) способность к адсорбции на поверхности плазменных факторов свертывания крови и их транспорт, 4) ангиотрофическая функция (уменьшение проницаемости капилляров, контакт с эндотелием сосудистой стенки), 5) гемостатическая функция, которая стимулируется фактором ван-Виллебранда, синтезируемым в эндотелии сосудов. Свертывающая система является третьим компонентом гемостатического процесса. Свертывание крови протекает по типу каскада, то есть происходит последовательное превращение проферментов (неактивного фактора) в активные ферменты, заверающие образование тромбина. Последний превращает растворенный плазменный фибриноген в нерастворенный белковый фибрин. В свертывании крови участвуют: 1) плазменные факторы свертывания крови (прокоагулянты), 2) тканевые (сосудистые), 3) клеточные (тромбоцитарные, эритроцитарные) факторы свертывания крови. К основным плазменным факторам относятся факторы I, II, III (тромбопластин), IV (ионизированный кальций), VII (фактор Коллера), V, X, XI, XII, XIII. Тканевыми факторами являются: - фактор ван-Виллебранда, синтезируемый в эндотелии сосудов, - активаторы и ингибиторы фибринолиза, - простациклин — ингибитор агрегации тромбоцитов, - субэндотелиальные структуры (особенно коллаген). Клеточные факторы включают группу коагуляционных тромбоцитарных факторов: 1) фосфолипидный (мембранный) фактор тромбоцитов; 2) белковый антигепариновый фактор; 3) тромбоксан Аг, простагландин ТХАг; 4) эритроцитарный аналог фактора III тромбоцитов (эритропластин, эритроцитин). ТРОМБОГЕНЕЗ В основе патогенеза тромбоза лежат следующие факторы: 1) повреждение эндотелия, 2) замедление тока крови, 3) вихреобразные движения крови (турбулентное течение крови), 4) гиперкоагуляция крови (повышенная свертываемость крови). Повреждение эндотелия может возникнуть при: 1) гипертонических кризах, 2) реакции антиген — антитело, 3) воздействии бактериальных токсинов, 4) воздействии эндотоксинов, 5) гиперхолестеринемии, 6 ) воздействии веществ, абсорбируемых из сигаретного дыма, 7) при активации перекисного окисления липидов, 8) при ряде заболеваний (сыпной тиф, бруцеллез, сифилис, ревматизм, инфекционные васкулиты). Замедление тока крови (стаз) и вихреобразные движения крови также имеют значение в патогенезе тромбообразования: 1) способствуют выходу тромбоцитов в плазменную зону, что создает условия для соприкосновения тромбоцитов с эндотелиоцитами; 2) препятствуют растворению активированных факторов свертывания до субкритических концентраций; 3) тормозят приток ингибиторов факторов свертывания; 4) благоприятствуют агрегации тромбоцитов и образованию фибрина как при замедленном токе крови, так и в зоне тромбоза; 5) способствуют повреждению эндотелия, предрасполагая к депозиции фибрина и тромбоцитов. Повышенная свертываемость крови определяется как изменение механизма свертывания, нарушение взаимоотношения свертывающей и противосвертывающей систем, что приводит к тромбозу. Механизмы тромбообразования: Свертывание крови –коагуляция; Склеивание тромбоцитов – агрегация; Склеивание эритроцитов – агглютинация; Осаждение белков плазмы – преципитация. Патологическая анатомия. Артериальные тромбы начинают формироваться в зоне повреждения эндотелия, в условиях вихреобразных движений крови, в областях бифуркации и разветвления сосудов. Венозные тромбы; известные как флеботромбы, носят характер окклюзионных и часто закрывают просвет вен на значительном протяжении. Они образуются при быстром свертывании крови в условиях замедленного кровотока. Тромбы состоят в основном из фибрина, тромбоцитов, эритроцитов, лейкоцитов. В зависимости от строения выделяют: - белые, - красные, - смешанные - гиалиновые тромбы. Отличие тромба от посмертного сгустка Посмертный сгусток имеет гладкую, блестящую поверхность и не прикрепляются к сосудистой стенке. Они эластичные и напоминают желатинозную субстанцию, могут плавать в просвете сосудистой стенки. Коагуляционные тромбы (венозные) обычно более плотные, компактные, всегда прикреплены к стенке, легко крошатся и ломаются. На поперечном разрезе определяются сплетения бледно-серого фибрина. Макроскопическое строение тромба В венозных тромбах, особенно в больших, колбасовидных, обычно различают головку, тело, хвост. Головка тромба, как правило, является наиболее светлой и плотной его частью и отличается содержанием большого количества тромбоцитов и лейкоцитов. Обычно головка тромба образуется у места его возникновения, имеет небольшие размеры. Следует отметить, что главную массу тромба составляют тело и хвост. В основе их возникновения лежит преимущественно коагуляция крови. Вот почему тело представляет собой смешанный или красный тромб, а хвост выглядит часто как красный тромб и по своей консистенции напоминает посмертный сверток крови. Хвостовая часть тромба нередко достигает больших размеров, располагаясь по току крови. Этиология и патогенез Причины, вызывающие шок, разнообразны. В связи с этим выделяют следующие виды шока: 1) травматический, 2) кардиогенный, 3) гемотрансфузионный, 4) инфекционно-токсический, 5) анафилактический, 6) гиповолемический, 7) нейрогенный шок. Прогноз шока определяется степенью повреждения жизненно важных органов, что усложняет лечение шока. При кортикальном некрозе почек нарастает анурия, что обусловливает значительный дисбаланс в содержании электролитов. Повышается чувствительность организма к бактериальным инфекциям. Имеют значение также возраст больного, вид шока, интенсивность и своевременность терапии. Могут наблюдаются отклонения от типовой структуры тромбов. 1) лейкоцитарные тромбы, состоящие только из лейкоцитов, образующиеся при переливании крови; 2) эритроцитарные (только из эритроцитов), наблюдаемые обычно в условиях неразрешившихся стазов крови, когда эритроциты теряют гемоглобин, набухают и подвергаются агглютинации; 3) коагуляционные (фибринозные), представляющие собой свернувшуюся кровь; 4) гиалиновые (состоящие из компактного фибрина, белков плазмы или тромбоцитов с примесью фибрина). Исходы тромбоза 1) ликвидация тромба благодаря фибринолитическому процессу фибринолиз; 2) организация и реканализация тромба; 3) прогрессирование тромбоза с обтурацией важнейших сосудов; 4) тромбоэмболия; 5) сморщивание тромба с уменьшением его размеров; 6) септический аутолиз; 7) петрификация. Клиническое значение тромбоза определяется его локализацией, скоростью образования тромба, состоянием больного. Печальные последствия тромбоза обусловлены двумя причинами: полным закрытием тромбом просвета сосудов и тромбоэмболией. ДИССЕМИНИРОВАННОЕ ВНУТРИСОСУДИСТОЕ СВЕРТЫВАНИЕ КРОВИ Тромбоз микроциркуляторного русла, или диссеминированное внутрисосудистое свертывание крови (ДВС-синдром),— это патологический процесс, который характеризуется образованием множественных мелких тромбов в микроциркуляторном русле, геморрагическим диатезом и наклонностью к кровотечениям. Этиология и патогенез ДВС - синдром является осложнением различных болезней и патологических процессов, таких, как: осложнения беременности: преждевременная отслойка нормально расположенной плаценты, длительное пребывание мертвого плода в утробе матери, септический аборт, эмболия околоплодными водами, токсемия (гестозы); инфекции (сепсис, менингококкцемия, малярия); злокачественные опухоли: карцинома поджелудочной железы, простаты, легких, желудка; острая промиелоцитарная лейкемия; массивное повреждение тканей (травма, ожог, обширные хирургические вмешательства); разнообразные процессы: переливание несовместимой крови, шок, васкулиты; болезни печени. В основе развития диссеминированного внутрисосудистого свертывания крови лежит тот же механизм, что и при тромбозе: 1) высвобождение тканевого фактора в циркулирующую кровь (внешний механизм свертывания), 2) активация внутреннего механизма, 3) замедление тока крови и стаз, 4) дефект в образовании активированных факторов свертывания крови, 5) недостаточность фибринолиза. При ДВС - синдроме независимо от механизма развития наблюдаются: 1) повсеместное отложение фибрина в микроциркуляторном русле, что приводит к ишемии органов, тканей и гемолизу, так как эритроциты, проходя через нити фибрина, повреждаются (микроангиопатическая гемолитическая анемия); 2) геморрагический диатез в результате снижения числа тромбоцитов и факторов свертывания. Следует отметить, что плазмин не только расщепляет фибрин (фибринолиз), но и переваривает факторы V и VII, снижая их концентрацию. Продукты распада фибрина, образуемые вследствие фибринолиза, оказывают ингибирующее действие на агрегацию тромбоцитов, обладают антитромбиновой активностью и снижают полимеризацию фибрина. Патологическая анатомия Морфологические изменения при ДВС - синдроме определяются распространенностью тромбообразования в микроциркуляторном русле и выраженностью геморрагии. Микротромбы образуются главным образом в артериолах и капиллярах почек, надпочечников, головного мозга, сердца. В процесс может вовлекаться также микроциркуляторное русло легких, печени, слизистой оболочки желудочно-кишечного тракта. Значение – развивается острая полиорганная недостаточность, которая служит причиной смерти больных. Прогноз ДВС- синдрома довольно вариабельный и зависит от локализации процесса, степени внутрисосудистого свертывания, активности моноцитарномакрофагальной системы, степени фибринолиза. ЭМБОЛИЯ I. По месту в кровеносной системе: 1) эмболия малого и большого круга кровообращения, 2) эмболия системы воротной вены (редкая форма); II. По направлению тока крови: 1) прямая (по току крови), 2) ретроградная (против тока крови, обычно в нижней полой вене), 3) парадоксальная (эмбол проникает из вен большого круга в его артерии, минуя малый круг кровообращения: через овальное окно между предсердиями, боталлов проток. III. По природе эмбола: 1) тромбоэмболия; 2) бактериальная (колонии микробов), 3) воздушная эмболия, 4) газовая эмболия, 5) тканевая эмболия, 6) эмболия животными паразитами, 7) инородными телами, 8) жировая. ТРОМБОЭМБОЛИЯ ЛЕГОЧНОЙ АРТЕРИИ - ранний послеродовый период, - длительная иммобилизация в кровати, - сердечная недостаточность, - использование оральных контрацептивов. Тромбоэмболия сосудов большого круга кровообращения Причины: тромбоэмболия в сосудах большого круга кровообращения происходит при образовании эмбола в левой половине сердца или артерии большого калибра. Клинические проявления и значение тромбоэмболии большого круга кровообращения определяются: - размером пораженного сосуда, - развитием коллатерального кровообращения, Чувствительностью ткани к ишемии. Причины воздушной эмболии - хирургические вмешательства или травмы внутренней яремной вены, - роды и аборты, - эмболия при переливании крови, - внутривенные инфузии, - рентгеноконтрастная ангиография. ПОСЛЕДСТВИЯ ЭМБОЛИИ Эмболия, независимо от ее вида, приводит к нежелательным последствиям, основными из которых являются: стойкое выпадение функций и очаговые некрозы в различных органах, кровообращение которых нарушено (серое размягчение головного мозга, инфаркт миокарда, гангрена конечностей); развитие метастазов опухолевого или воспалительного процесса; эмболия может быть причиной смерти, особенно при рефлекторном спазме сосудов жизненно важных областей кровеносной системы (опасна эмболия легочной артерии). ШОК Шок — это патологический процесс, характеризующийся резким уменьшением кровоснабжения тканей, неадекватным уровню обменных процессов. Шок рассматривается как реакция организма адаптивного характера, как пассивная защита, направленная на сохранение жизни при воздействии различных экстремальных факторов. Он сопровождается гипоксией и угнетением функций организма. - Травматический шок возникает при механической травме; - кардиогенный — при инфаркте миокарда, аритмиях, тампонаде сердца, эмболии легочной артерии; - гемотрансфузионный и посттрансфузионный — переливании несовместимой крови; -инфекционно-токсический (эндотоксический, септический) — при бактериальных инфекциях, вызываемых грамотрицательными и грамположительными бактериями; - гиповолемический — в результате кровотечения, при потере значительного количества жидкости (при неукротимой рвоте, диарее, ожогах); - нейрогенный — при анестезиях, повреждении спинного мозга. Стадии шока Шок относится к прогрессирующему патологическому процессу, который может привести к смерти. В его развитии выделяют три стадии: I—стадия компенсации- начальная, непрогрессирующая стадия, при которой активируются компенсаторные механизмы и сохраняется перфузия жизненно важных органов; II— стадия нарушения кровотока-прогрессирующая стадия, характеризующаяся гипоперфузией и появлением дисбаланса между уровнями кровоснабжения и обменных процессов; III— декомпенсациинеобратимая стадия, при которой развиваются тяжелые и необратимые повреждения клеток и тканей. При этой стадии, даже если и корригируется гемодинамика, спасти жизнь человека не удается. Патологическая анатомия Основные патологоанатомические признаки шока: 1) жидкое состояние крови в сосудах, 2) диссеминированное внутрисосудистое свертывание с геморрагическим синдромом, 3) шунтирование кровотока, 4) депонирование крови в микроциркуляторном русле, 5) циркуляторно-гипоксическое повреждение органов.