4-5. Галогенпроизводные
реклама

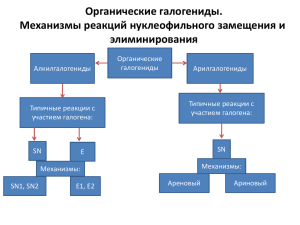
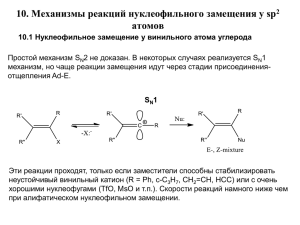
Лекции 4-5 Классификация и номенклатура • первичные, вторичные, третичные • моно-, ди-, три-, … , полигалогенпроизводные • алифатические и ароматические 1. Радикальное галогенирование алканов Недостаток – малая региоселективность процесса. Реакция называется региоселективной, если среди продуктов преобладает один из возможных изомеров. Существуют также региоспецифичные реакции. Инициирование радикальной реакции может быть не только фотохимическим, но и термическим сравнить: 2. Реакции электрофильного присоединения к алкенам и алкинам см. темы о непредельных углеводородах 3. Нуклеофильное замещение гидрокси-группы в спиртах 4. Обмен галогена (реакция Финкельштейна) 1. Реакции нуклеофильного замещения Механизм реакции SN1 (реакции мономолекулярного нуклеофильного замещения) (substitution nucleophilic monomolecular) Стадия 1: Ионизация субстрата, с образованием карбокатиона (медленная стадия лимитирующая): Стадия 2: Нуклеофильная атака карбокатиона (быстрая стадия): Стадия 1: R−X → R+ + X− Стадия 2: R+ + Y− → R−Y v = k · [RX] Если при атоме углерода находятся четыре разных заместителя, то молекула не совпадает с собственным зеркальным отражением – молекула хиральна – существует в виде двух оптических изомеров (антиподов, энантиомеров). Энантиомеры вращают плоскость поляризации света в противоположных направлениях В результате реакции, протекающей по механизму SN1, происходит рацемизация Реакции SN1 характерны для субстратов, образующих относительно стабильные карбокатионы: Alk3C-X ArCH2-X CH2=CH-CH2X X= Hal, OCOR, OSO2Ar, OSO2CF3 Механизм реакции SN2 реакции бимолекулярного нуклеофильного замещения (substitution nucleophilic bimolecular) R−X + Y− → [Y⋯R⋯X]− → R−Y + X− v = k·[RX]·[Y] В реакциях SN2 оптически активных субстратов происходит «обращение конфигурации» и образуется продукт противоположной конфигурации. Т.е. (+) субстрат дает (-)-продукт и наоборот. Одна стадия: Атака нуклеофила и отщепление уходящей группы происходят синхронно, карбокатион не образуется Реакции SN2 характерны для субстратов с первичными алкильными группами AlkCH2-X и особенно для метильных производных CH3-X, т.к. в этих случаях минимальны стерические препятствия в переходных состояниях при атаке нуклеофилами: R=H Кроме того, для AlkCH2-X и CH3-X невыгоден SN1 маршрут реакции, т.к. должны образовываться нестабильные карбокатионы AlkCH2+ и особенно CH3+ R= Alk Влияние растворителя на протекание реакций нуклеофильного замещения Свойства атомов, молекул, ионов в растворах сильно отличаются от свойств в газовой фазе! Основная причина – сольватация, т.е. взаимодействие частиц растворенного вещества с молекулами растворителя. Сольватация снижает свободную энергию молекул. Сольватация возрастает с увеличением полярности растворителя, которая характеризуется диэлектрической проницаемостью (e). Растворитель e (25 оС) вода метанол этанол AcOH MeNO2 MeCN ДМСО Трет-бутанол ДМФА ацетон PhNO2 PhCN дихлорэтан 78.5 32.6 24.3 6.2 38.6 37.5 48.9 12.2 36.7 20.7 34.8 25.2 10.4 Энергия сольватации выше для ионов, чем для нейтральных молекул; энергия сольватации возрастает с уменьшением размеров молекул и ионов 2. Реакции элиминирования 2.1 a-элиминирование 2.2 b-элиминирование – отщепление с образованием p-связи Параллельно с элиминированием может протекать и реакция замещения, так как основание может являться нуклеофилом. Основания: NH2-, C2H5O-, OH-, NR3, NHR2, H2O (сила основания убывает) Механизм элиминирования Как и замещение, элиминирование может подчиняться кинетическим уравнениям первого и второго порядка, различают мономолекулярное и бимолекулярное элиминирование. Механизм бимолекулярного элиминирования E2 v = k·[основание]·[галогенпроизводное] Особенности бимолекулярного элиминирования E2 1. Реакция не сопровождается перегруппировками. 2. Наблюдается значительный кинетический изотопный эффект – изменение скорости реакции при замене одного или нескольких атомов в исходном веществе на их изотопы (чаще всего – водорода на дейтерий). Реакционная способность и выходы продуктов E2 элиминирования возрастают в ряду алкилгалогенидов RX: первичные < вторичные < третичные Реакции E2 являются стереоселективными – преимущественно образуется транс-изомер (если это возможно) Стереоселективность связана с пространственными факторами, действующими в переходном состоянии Реакционная способность возрастает в ряду R-F < R-Cl < R-Br < R-I Конкуренция реакций E2 и SN2 •Сильные основания способствуют реакциям E2, более слабые основания, но более нуклеофильные частицы NH3, I- - реакциям SN2 •Увеличение объема реагента способствует протеканию реакции E2 •Повышение температуры способствует протеканию реакций элиминирования Механизм мономолекулярного элиминирования E1 Стадия 1 – ионизация галогенпроизводного с образованием карбокатиона (совпадает с SN1!) v = k·[галогенпроизводное] Стадия 2 – отщепление протона от b-углеродного атома под действием основания • Связь C-H разрывается в быстрой стадии, поэтому кинетического изотопного эффекта не наблюдается • Возможны перегруппировки карбокатиона • Образуется термодинамически более стабильный транс-изомер Реакционная способность в реакциях E1 элиминирования возрастают в ряду алкилгалогенидов RX: первичные << вторичные < третичные Реакции нуклеофильного замещения в ароматических галогенпроизводных значительно более затруднены по сравнению с алифатическими Два механизма замещения: • ароматическое нуклеофильное замещение SNAr (присоединение – отщепление) • ариновый механизм (отщепление – присоединение) Ароматическое нуклеофильное замещение SNAr Характерно для активированных галогенпроизводных – содержащих электроноакцепторные заместители в о- или п-положениях к атому галогена v = k·[нуклеофил]·[галогенпроизводное] Механизм SNAr (присоединение – отщепление) Стадия 1 – присоединение нуклеофила с образованием комплекса Мезингеймера, медленная стадия Стадия 2 – отщепление галогенид-иона, быстрая стадия Реакционная способность галогенпроизводных в реакциях SNAr снижается в ряду: Ar–F > Ar–Cl > Ar–Br > Ar–I Это связано со стабилизацией комплекса Мезингеймера –I-эффектом галогена Энергетическая диаграмма реакции нуклеофильного замещения SNAr Ариновый механизм (отщепление – присоединение) Наблюдается для «неактивированных» галогенпроизводных – содержащих донорные заместители ипсо-замещение орто-замещение Стадия 1 – отщепление протона под действием основания Стадия 2 – отщепление галогенид-иона с образованием дегидробензола (арина) Стадия 3 – присоединение нуклеофила по тройной связи Стадия 4 – протонирование аниона