Типы химических реакций в органической химии. Учитель химии ГБОУ СОШ №277
реклама

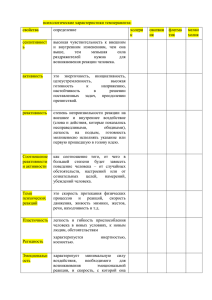
Типы химических реакций в органической химии. Учитель химии ГБОУ СОШ №277 Кировского района г. Санкт-Петербурга Елена Викторовна Переверзева Химическая реакция – превращение одних веществ в другие. Вещества, полученные в результате реакции, отличаются от исходных веществ составом, строением и свойствами. Реагент 1 + Реагент 2 = Продукты Субстрат + Атакующий = Продукты реагент Признаки классификации химических реакций в неорганической химии по по по по по по числу и составу исходных веществ и продуктов тепловому эффекту изменению степени окисления атомов обратимости процесса фазе использованию катализатора Классификация по числу и составу исходных и образующихся веществ: Реакции соединения: А + В = АВ Zn + Cl2 = ZnCl2 Реакции разложения: АВ = А + В 2H2O = 2H2 + O2 CaO + CO2 = CaCO3 Cu(OH)2 = CuO + H2O Реакции замещения: АВ + С = А + СВ CuSO4 + Fe = Cu + FeSO4 Cr2O3 + 2Al = 2Cr + Al2O3 Реакции обмена: АВ + CD = AD + CB CuO + H2SO4 = CuSO4 + H2O NaOH + HCl = NaCl + H2O Даны схемы реакций: 1. Гидроксид меди(II) → оксид меди(II) + вода 2. Хлорид бария + сульфат натрия → … 3. Соляная кислота + цинк → хлорид цинка + водород 4. Оксид фосфора(V) + вода → … I уровень: Укажите типы реакций, запишите одно из уравнений (по выбору). II уровень: Укажите типы реакций, запишите одно из уравнений, в котором не указаны продукты (по выбору). III уровень: Укажите типы реакций и запишите все уравнения. Реакции с участием органических соединений подчиняются тем же законам (закон сохранения массы и энергии, закон действия масс, закон Гесса и др.) и проявляют те же закономерности (стехиометрические, энергетические, кинематические), что и реакции неорганические. Органические реакции принято классифицировать по механизмам протекания Под механизмом реакции понимают последовательность отдельных стадий протекания реакции с указанием промежуточных частиц, образующихся на каждой из этих стадий. по направлению и конечным продуктам реакции - присоединения; - отщепления (элимирования); - замещения; - перегруппировки (изомеризации); - окисления; - восстановления. Способ разрыва ковалентной связи определяет тип механизма реакций: Радикальный (гомолитический) X:Y → X. + .Y R. (X. , .Y) – радикалы (свободные атомы или частицы с неспаренными электронами, неустойчивые и способные вступать в химические превращения) Ионный (гетеролитический) X:Y → X+ + :YX+ - электрофильный реагент (электрофил: любящий электрон) :Y- - нуклеофильный реагент (нуклеофил: любящий протон) Радикальные реакции имеют цепной механизм, включающий стадии: зарождение, развитие и обрыв цепи. Зарождение цепи (инициирование) Cl2 → Cl. + Cl. Рост (развитие) цепи СН4 + Cl. → СН3. + НCl CH3. + Cl2 → CH3-Cl + Cl. Обрыв цепи CH3. + Cl. → CH3Cl CH3. + CH3. → CH3-CH3 Cl. + Cl. → Cl2 Ионные реакции происходят без разрыва электронных пар, образующих химические связи: оба электрона переходят на орбиталь одного из атомов продукта реакции с образованием аниона. Гетеролитический распад ковалентной полярной связи приводит к образованию нуклеофилов (анионов) и электрофилов (катионов). CH3-Br + Na+OH- → CH3-OH + Na+Brсубстрат реагент (нуклеофил) продукты реакции C6H5-H + HO: NO2 → C6H5-NO2 + H-OH субстрат реагент (электрофил) продукты реакции Классификация по направлению и конечному результату Реакции замещения А-В + С → А-С + В Реакции присоединения С=С + А-В → А-С-С-В Реакции отщепления (элиминирования) А-С-С-В → С=С + А-В Реакции перегруппировки (изомеризации) Х-А-В → А-В-Х Реакции окисления и восстановления, сопровождаются изменением степени окисления атома углерода в соединениях, где атом углерода – реакционный центр. Проблема: К какому типу реакций можно отнести реакцию полимеризации? Докажите её принадлежность к определённому типу реакций и приведите пример. Тестовое задание. 1. Соотнесите: Раздел химии 1) Неорганическая 2) Органическая 2. Соотнесите: Схема реакции 1) АВ + С → АВС 2) АВС → АВ + С 3) АВС → АСВ 4) АВ + С → АС + В Тип реакции а) замещения б) обмена в) соединения г) разложения д) отщепления е) изомеризации ж) присоединения Тип реакции а) замещения б) присоединения в) отщепления г) изомеризации 3. Бутан вступает в реакцию с веществом, формула которого: 1) Н2О 2) С3Н8 3) Cl2 4) HCl 4. Субстратом в предложенных схемах реакций является вещество 1) СН3-СООН (А) + С2Н5-ОН (Б) → СН3СООС2Н5 + Н2О 2) СН3-СН2-ОН (A) + H-Br (Б) → CH3-CH2-Br + H2O 3) CH3-CH2-Cl (A) + Na-OH (Б) → CH2=CH2 + NaCl + H2O 5. Левой части уравнения С3Н4 + 4О2 → … соответствует правая часть: 1) → С3Н6 + Н2О 2) → С2Н4 + Н2О 3) → 3СО2 + 4Н2О 4) → 3СО2 + 2Н2О 6. Объём кислорода, который потребуется для полного сгорания 5л метана, равен 1) 1л 2) 5л 3) 10л 4) 15л Выводы Органические реакции подчиняются общим законам и общим закономерностям их протекания. Они имеют общие для всех реакций признаки, но имеют и свои характерные особенности. По механизму протекания реакции делятся на свободнорадикальные и ионные. По направлению и конечному результату химического превращения: замещения, присоединения, окисления и восстановления, изомеризации, отщепления, поликонденсации и др.